稻蟹共作模式下生物对多环芳烃的富集机制
2022-10-13蔡振兴祁博伟王梓健
孙 楠,蔡振兴,祁博伟,王梓健
(东北农业大学水利与土木工程学院,哈尔滨 150030)
东北三省是我国水稻主产区,也是稻蟹综合养殖地区。稻蟹综合养殖在黑龙江省已有20余年历史,种养面积达2.21×105hm2,占全省稻米生产总面积5.5%。稻蟹共作是以水产养殖和农业系统相结合的综合农业-水产养殖系统(IAA),对确保国家粮食安全和促进农业可持续发展具有重要意义[1]。该模式中,水生生物和植物之间有效的内部循环可减少系统对外部能量和物质输入的依赖[2]。尤其是蟹类可疏松土壤,增加土壤含氧量,促进微生物群落生长和发展,丰富微生物多样性[3]。同时有利于水稻对氮等营养元素的吸收,进一步减少化肥使用,提高水稻品质和产量[4-5]。
多环芳烃(PAHs)是一组普遍存在的持久性有机污染物,对生物具有致癌、致畸和致突变性,威胁生态系统和人类健康[6]。美国国家环境保护局已将16种PAHs列为优先控制污染物。环境中PAHs来源分为自然源和人为源。自然来源包括沉积成岩、火山爆发和生物活动;人为源包括化石燃料和有机材料的不完全燃烧、石油精炼和车辆排放等[7]。土壤主要由矿物颗粒和有机物组成,有较强容纳污染物的能力,也为PAHs主要储存库和汇集地。研究表明,我国农田土壤中PAHs含量为9.90~59.11 ng·g-1,总体污染水平较高[8]。
生物扰动显著改变底泥物理、化学和生物特性,影响底泥中污染物迁移,使其重新释放到水体中,增加污染物生物有效性[9]。Karickhoff等研究发现,颤蚓生物扰动导致底泥中有机污染物释放增加,对比无扰动组,水体中有机污染物含量增加4~6倍[10];Timmermann等研究表明生物扰动促进底泥中芘的降解[11];Menone等研究发现雄性穴居蟹(Chasmagnathus granulatus)促进河口底泥中有机氯农药向水体释放[12]。在稻蟹田中,蟹类及其他底栖生物是主要扰动者,可促使底泥中PAHs二次向水体释放,对环境造成潜在风险。目前,关于稻田底泥PAHs释放研究未见报道。
生物扰动可促进底泥污染物释放,重新释放的PAHs包括游离态、溶解态以及吸附态,通常溶解态污染物具有较高生物有效性。生物对PHAs的富集程度与多种因素相关。Zhai等研究斑马鱼(Danio rerio)在不同粒径悬浮颗粒中对PAHs的富集,添加悬浮颗粒组斑马鱼体内PAHs浓度较高,表明悬浮颗粒可增加PAHs生物有效性[13]。生物富集程度可能与生物扰动者的种类相关,不同生物扰动类型不同,影响效果也不同。Tian等基于室内微宇宙试验研究水丝蚓(Tubificid worms)扰动对鲤鱼(Cyprinu carpio)生物富集多溴联苯醚(PBDEs)的效果,结果显示水丝蚓生物扰动并未显著增加鲤鱼对多溴联苯醚的生物富集[14];Zhang等研究表明,泥鳅生物扰动显著促进鲤鱼生物富集六溴环十二烷(HCCB)[15]。底泥中总有机碳(TOC)含量也影响PAHs的生物有效性和吸附特性,从而降低生物利用度和生态毒理学风险,在控制底泥PAHs浓度方面具有重要作用[16]。
综上,生物扰动可增加稻田底泥中PAHs释放量,重新释放的PAHs在生物体内富集程度和富集机制尚不明确。目前对PAHs生物富集机制的分析多采用单一分析方法。本文通过主成分分析(PCA)探究生物扰动对环境的主要影响,基于皮尔逊相关性分析和结构方程模型阐述环境介质与生物富集程度关系,利用3种方法结合说明生物扰动下PAHs富集机制,为稻蟹共作模式风险评估提供依据。
1 材料与方法
1.1 试验材料
1.1.1 代表污染物和生物选择
东北灌区多处被石油废水污染,其中菲(PHE)在东北灌区土壤中浓度较高,且较易在水相、固相和有机相之间转移[17]。本试验选择PHE作为代表性污染物。
试验所用水稻、蟹、鳅、鱼(鲫鱼)均来自黑龙江本土稻田。水稻选择生长较快的分蘖期,高度为15 cm。水生生物生长期选择幼期,以减少因多样性引起的误差。水生生物在试验前驯养两周,其体长及质量如表1所示。

表1 生物平均体长和质量Table 1 Average body length and mass of organisms
1.1.2 污染土壤制备
使用干净未受污染稻田土壤。客土取回后自然风干,剔除根茎和大颗粒杂物,粉碎后过筛,确保粒径小于2 mm。向土壤中加入溶于甲醇的菲溶液,不断搅拌使土壤染毒均匀。陈化一周后使用,最终土壤中PHE浓度为(36.3±1.19)mg·kg-1(干重)。
1.2 试验方法
1.2.1 试验设置
本试验选取常规稻田综合养殖模式:稻-蟹、稻-鳅、稻-蟹-鳅3种共作模式。在室内微宇宙(直径20 cm,高30 cm圆柱体玻璃缸)中进行,装置如图1所示。

图1 试验装置Fig.1 Experimental device
微宇宙包括上覆水和底泥,上覆水采用自来水,充分曝气后使用。采用预先染毒的稻田底泥作为实验底泥,底泥高度为15 cm,上覆水高度为10 cm。按照实际稻田水稻种植密度,每平方米种植水稻25~33穴,1个圆形玻璃缸移植3~4株水稻,水稻生长稳定后再放入水生生物。蟹、鳅、鱼养殖密度分别采用0.60、0.30、0.15 kg·m-2,即每种水生生物数量均为2只。每个微宇宙放置一个空气泵以增加水中含氧量。系统温度保持在(20±3)℃,光照为自然光,为避免有机物对PHE的影响,试验期间不投食,时间为30 d。共设置4组处理,每组处理3个平行样,具体设置如下:
①蟹扰动组(CD):微宇宙中加入底泥和上覆水,同时加入蟹、水稻、鱼(鲫鱼),分析蟹单独扰动时,蟹、水稻及鱼对PHE的富集;②泥鳅扰动组(LD):微宇宙中加入底泥和上覆水,同时加入泥鳅、水稻、鱼,分析泥鳅单独扰动时,泥鳅、水稻以及鱼对PHE的富集;③联合扰动组(MD):微宇宙中加入底泥和上覆水,同时加入蟹、泥鳅、水稻、鱼,分析蟹与泥鳅联合扰动时,蟹、泥鳅、水稻以及鱼对PHE的富集;④无扰动组(ND):微宇宙中加入底泥和上覆水,同时加入水稻、鱼,分析无生物扰动时,水稻、鱼对PHE的富集;设置空白试验组,仅有上覆水和底泥,用于质量控制。
1.2.2 参数测定
取2 g冷冻干燥并研磨的底泥样品于提取管中,使用菲-d10作为内标,加入30 mL正己烷和丙酮(1∶1,V/V)混合液,超声提取后离心,取上清液于旋转蒸发仪中浓缩,用甲醇定容至1 mL。将浓缩提取液加入硅胶层析柱中分离净化,并用40 mL正己烷和二氯甲烷(1∶1,V/V)混合液淋洗,淋洗液浓缩定容至1 mL,转移到小瓶中密封,以便分析。生物取可食用部分,水稻取根茎叶,处理方法同上。取1 000 mL上覆水过滤,滤膜上PHE浓度为悬浮物中PHE浓度,滤液中PHE浓度为上覆水中溶解态PHE浓度,向滤液中加入30 mL二氯甲烷液液萃取,提取液处理方法同上,滤膜样品处理方法与底泥相同。
采用高效液相色谱法分析PHE,包括自动进样器与荧光检测器,流动相为超纯水和色谱级甲醇(1∶9,V/V),流速为1.0 mL·min-1,柱温为30℃。
水中溶解性有机碳、悬浮物中颗粒状有机碳、底泥中总有机碳采用总有机碳分析仪(TOC-5000A,日本岛津)测定。萃取液中脂肪采用重量差法测定。
1.2.3 数据处理与分析
本研究采用生物-底泥富集因子(BSAF)描述PHE在底泥有机质与生物脂肪之间的分配,公式如下:

式中,Cbiota-生物体内PHE浓度(mg·kg-1,干重),flip-生物体内脂肪含量,Csed-底泥中PHE浓度(mg·kg-1,干重),foc-底泥有机质含量。
采用生物富集因子(BAFW)描述生物对水体中溶解性PHE的富集趋势,公式如下:

式中,CW-上覆水中自由溶解态PHE浓度(μg·L-1)。
采用生物-悬浮物富集因子(BSSAF)描述生物对悬浮颗粒中PHE的富集趋势,公式如下:

式中,CTSS-悬浮颗粒中HE浓度(mg·kg-1,干重)。
1.2.4 统计分析
所有样品测定结果以平均值±标准差表示。样品中PHE回收率为65.4%~83.7%。所有数据使用SPSS 26、Amos 24、Origin 2021作统计学分析。采用非参数检验验证数据正态性。采用单因素方差分析评估不同处理组差异性,显著水平为0.05。
2 结果与分析
2.1 上覆水中悬浮物和溶解性有机碳
底泥与上覆水理化性质如图2所示。水稻单一栽培是一个静态系统,导致ND组中悬浮物(TSS)浓度变化不明显,在0.8 g·L-1附近上下波动。CD和MD组中TSS浓度对比ND和LD组明显提高,蟹可使TSS浓度平均提高约90倍。LD组中TSS浓度的增加量相对较小,可能因鳅的生物扰动强度较小。ND组中溶解性有机碳(DOC)浓度增长缓慢,从第5天的98.6 mg·L-1增至30 d的126.5 mg·L-1。扰动组中DOC浓度随时间显著提高,表明底栖生物增加上覆水中DOC浓度。试验结果表明,相比鳅扰动作用,蟹扰动作用显著增加环境中TSS和DOC浓度。TSS和DOC浓度变化幅度反映不同组中生物扰动强度,变化幅度小的ND与LD组属于弱扰动组,变化幅度大的CD与MD组属于强扰动组。
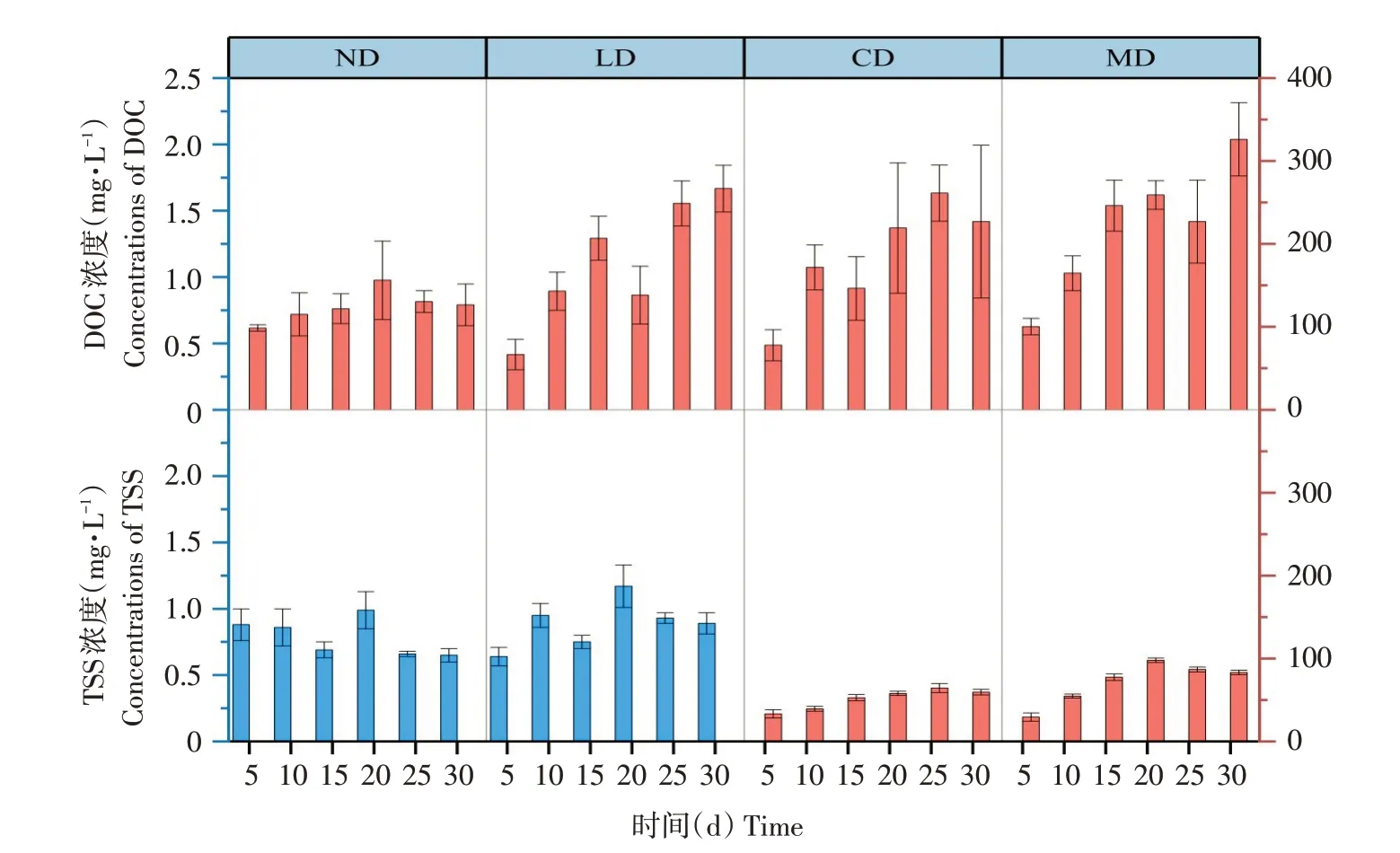
图2 30 d内ND、LD、CD和MD组上覆水中TSS和DOC浓度变化Fig.2 Change of TSS and DOC concentrations in overlying water of ND,LD,CD and MD groups within 30 days
2.2 上覆水、悬浮物、底泥中PHE浓度
环境介质中PHE浓度如图3所示。
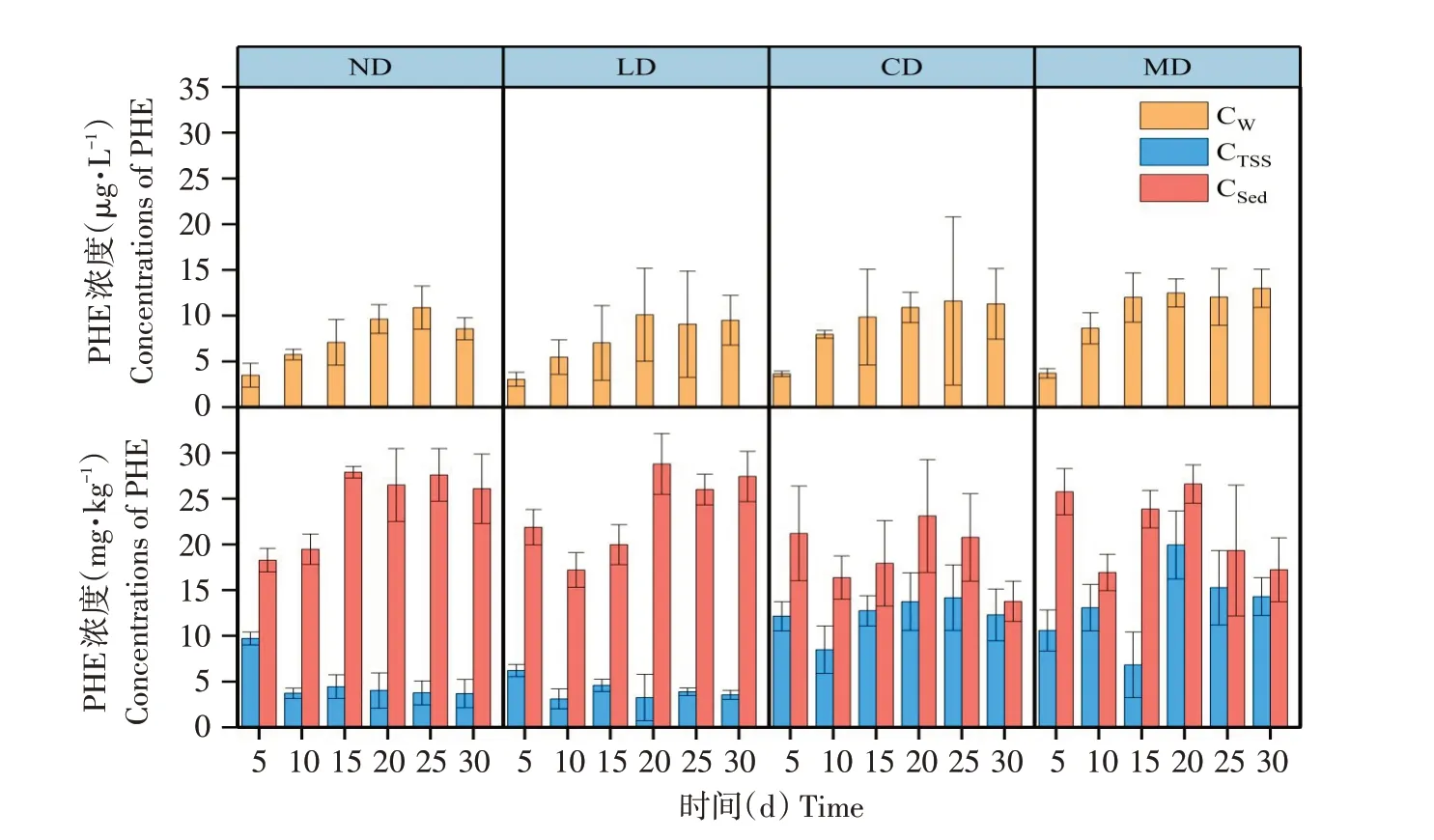
图3 30 d内ND、LD、CD和MD组上层水、TSS和底泥PHE浓度变化Fig.3 Change of PHE concentrations of overlying water,TSS and sediment in ND,LD,CD and MD groups within 30 d
上覆水中PHE浓度(CW)总体呈上升趋势,弱扰动组(ND,LD)中上覆水PHE浓度低于强扰动组(CD,MD)。CD与MD组中上覆水PHE浓度和增长趋势相似。30 d时,上覆水PHE浓度分别为11.29和13.00 μg·L-1。强扰动组悬浮物PHE浓度(CTSS)相比弱扰动组更高,波动更剧烈。弱扰动组中底泥与悬浮物PHE浓度差异明显高于强扰动组。
2.3 PHE在生物中的浓度变化
3种生物脂肪含量试验前后变化不明显。生物在试验期间生长状态良好,表明PHE存在对生物30 d内生长发育无明显影响。蟹、鳅、鱼、水稻中PHE浓度变化如图4所示。
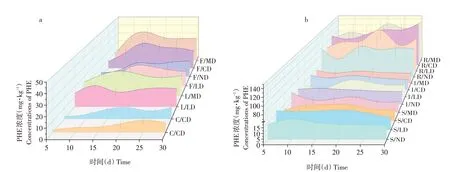
图4 30 d内ND、LD、CD和MD组水生生物(a)和水稻(b)中PHE浓度变化Fig.4 Change of PHE concentrations of aquatic organisms(a)and rice(b)in ND,LD,CD and MD groups within 30 d
扰动组中鱼类(CF)和水稻中PHE浓度普遍高于无扰动组,蟹鳅混合扰动组高于单独扰动组。PHE在水稻根部浓度最高为138.7 mg·kg-1,高于同一时间茎(8.39 mg·kg-1)和叶(6.47 mg·kg-1)的PHE浓度。而在LD组中,鳅对PHE的富集程度高于鱼类。30 d时鳅体内PHE浓度为18.05 mg·kg-1,而鱼体内PHE浓度为15.15 mg·kg-1,可能与底栖生物习性有关。
综上,生物扰动促进PHE在鱼和水稻中的富集。本文首次证明蟹等底栖生物的生物扰动可增加稻蟹田中环境风险。
2.4 PHE在生物体内富集的影响因素
图5为环境介质与水稻及生物体内PHE浓度的皮尔逊相关性分析,4组装置中鱼类富集程度均与上覆水中PHE浓度显著正相关(P<0.05),上覆水中PHE浓度与DOC浓度显著正相关(P<0.05),表明DOC浓度可能间接影响生物富集。在CD与MD组中,生物富集程度受多种因素影响,蟹体内PHE浓度与TSS、DOC、上覆水中PHE浓度均具有显著相关性(P<0.05)。为探究生物扰动对环境的影响,分析鱼、水稻体内PHE浓度和环境参数主成分,结果如图6所示。不同扰动类型中TSS和DOC浓度在坐标轴上被明显区分,表明生物扰动对TSS和DOC浓度影响最显著。ND和LD组中TSS和DOC浓度较小,在不受外界干扰的条件下,环境中PHE随时间推移在底泥、水、生物中趋于稳定。在扰动强度较大MD组中情况较复杂,基于结构方程模型对MD组中水稻及水生生物PHE富集程度的影响因素分析,结果见图7。蟹、鳅、鱼和水稻根中PHE浓度均受上覆水中PHE浓度直接影响,DOC浓度和上覆水中PHE浓度受TSS浓度直接影响,路径系数分别为0.86、0.61(P<0.001)。DOC浓度可影响上覆水中PHE浓度,路径系数为0.4(P<0.05)。皮尔逊相关性分析和结构方程模型计算结果表明,水稻茎和叶中PHE浓度与环境的改变无明显相关性,反映PHE在水稻茎、叶浓度主要与水稻内部转运能力有关。综上,基于相关性分析、主成分分析、结构方程模型3种方法联合阐明生物扰动的作用机制,揭示生物扰动作用可提高上覆水中TSS和DOC浓度,且高浓度TSS和DOC可促进PHE在生物体内富集。
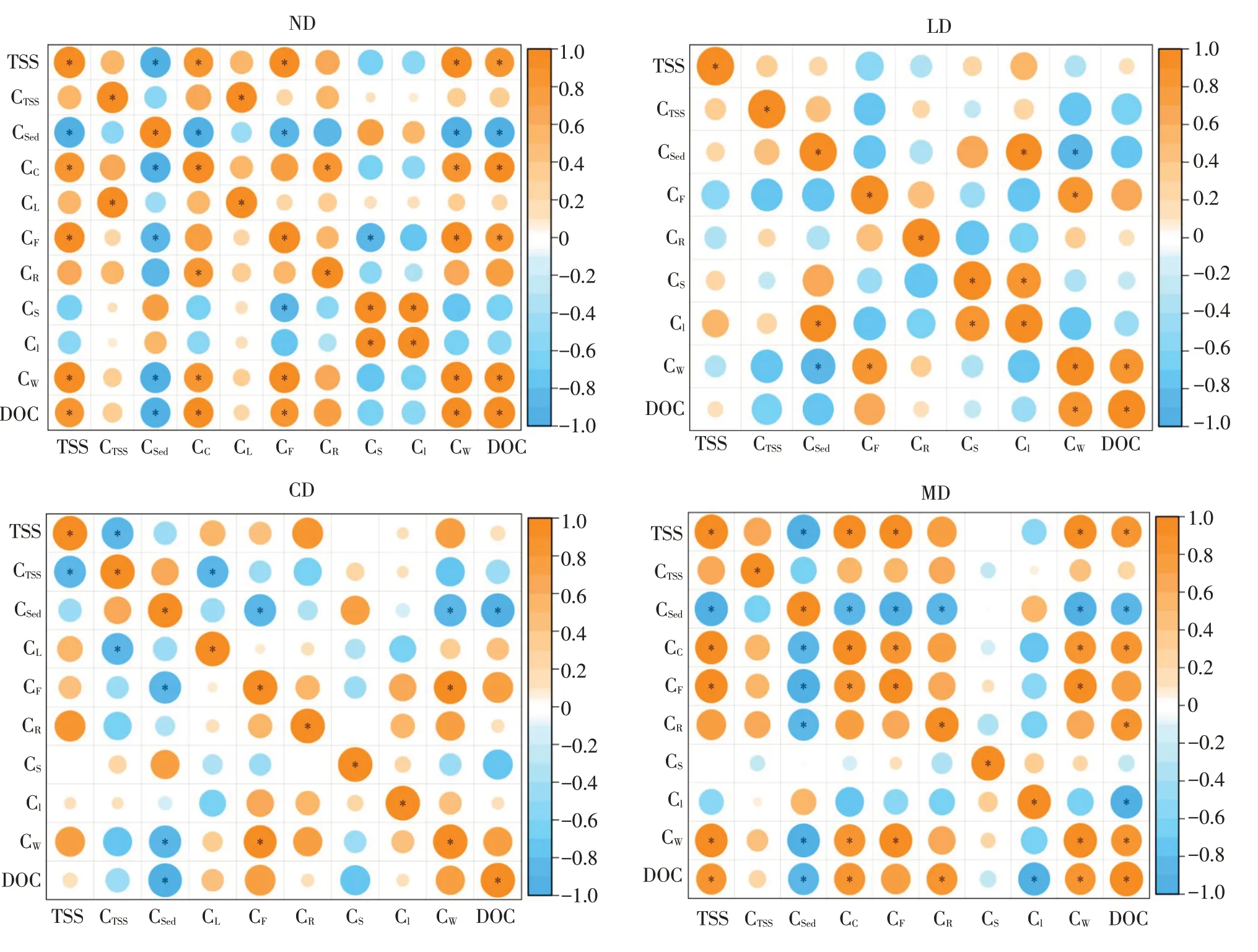
图5 4组中生物体内PHE浓度与环境介质相关性分析Fig.5 Correlation analysis of PHE concentrations in organisms with environmental media in four groups
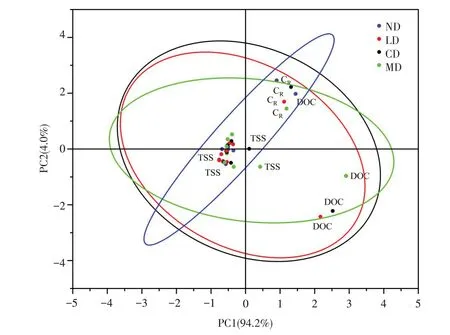
图6 ND、LD、CD、MD四组数据的主成分分析Fig.6 Principal component analysis of data in four groups of ND,LD,CD,MD
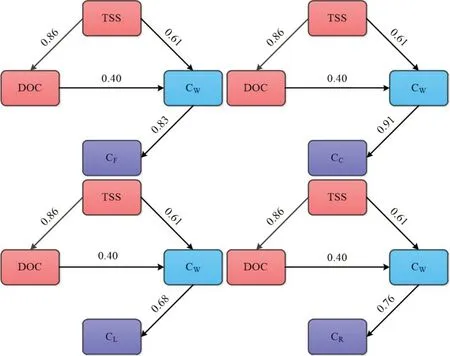
图7 CF、CC、CL、CR结构方程模型Fig.7 Structural equation models of CF,CC,CL,CR
2.5 生物富集系数
生物富集潜力对评价环境生态效益具有重要意义。通过计算BAF、BSAF、BSSAF 3种生物富集因子,比较各组装置中PHE在生物体内浓度水平,评价生物扰动的影响。当BAF值>5 000时,认为该污染物具有生物富集效应,BAF值在2 000~5 000时考虑潜在生物富集效应[18]。生物的3种富集因子计算结果如图8所示。蟹的3种生物富集因子在CD组与MD组中无明显差异,BSAF与BSSAF值均<1,BAF值均<2 000,未表现富集趋势。鳅在LD组中BSSAF值为(2.91±1.58)>1,远高于MD组。当TSS浓度和悬浮物PHE浓度提高时,鱼BSSAF值呈降低趋势。鱼BAF值与生物扰动类型无明显相关性,4组装置BAF值均在2 000波动。鱼对底泥中PHE富集趋势在不同扰动组中差异显著,ND与LD组BSAF值分别为(1.18±0.08)、(0.85±0.30),而CD与MD组BSAF值均超过2,且ND与LD组中水稻根BSAF值为2~3。CD和MD组BSAF值分别为(9.19±2.17)、(5.09±1.58)。水稻根部BSSAF值在不同扰动组中也有较大波动。
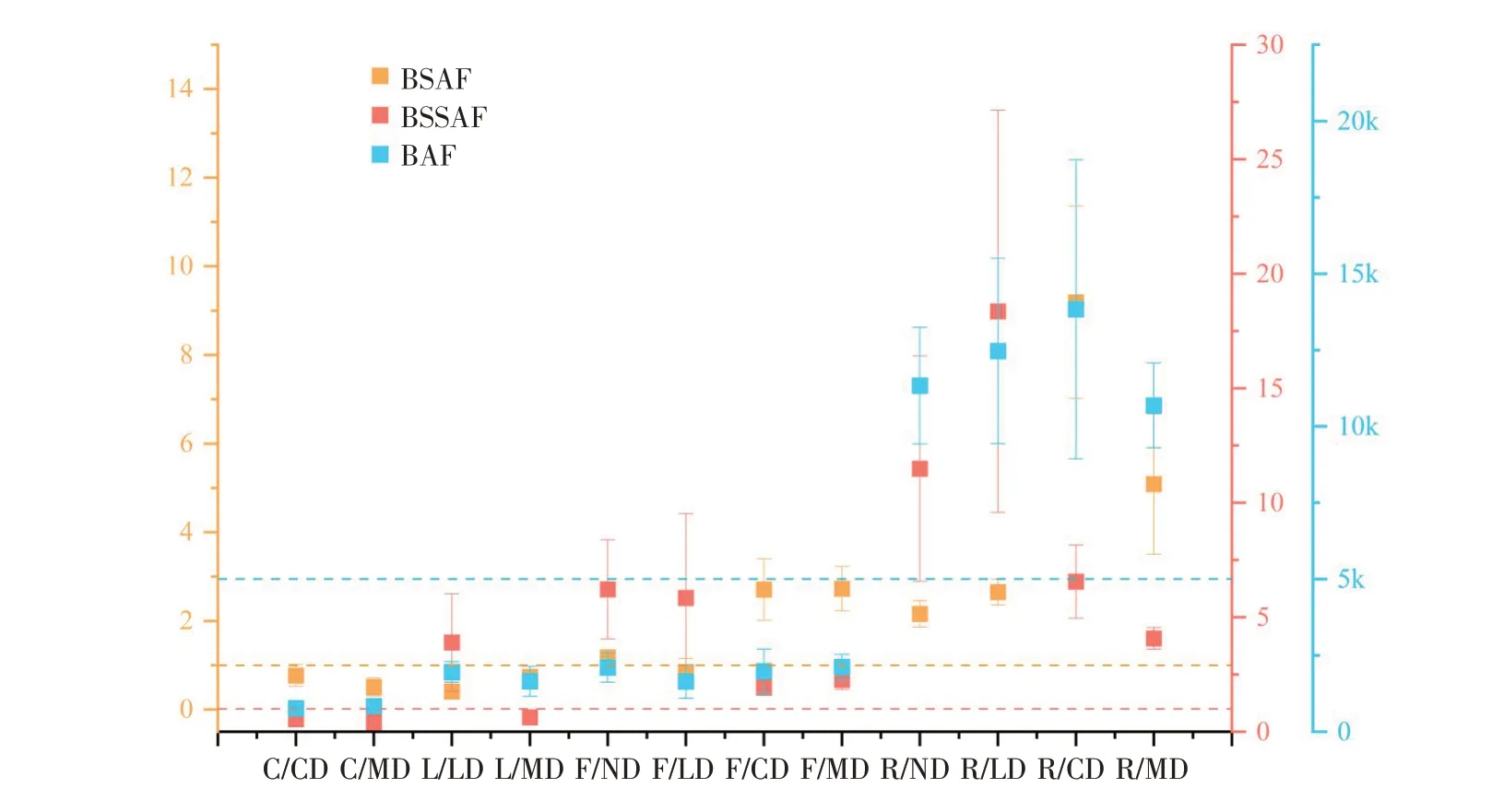
图8 蟹、鳅、鱼和水稻根系在ND,CD,LD,MD中的3种生物富集因子Fig.8 Three bioaccumulation factors of crab,loach,fish and rice root in ND,LD,CD and MD
3 讨 论
在生物扰动作用对环境要素影响方面,研究表明,底栖生物如蟹、河蚬(Corbicula fluminea)等可增加上覆水中TSS和DOC含量,与本研究结论一致[19-20]。生物扰动作用可使带有PHE的固体颗粒从底泥进入上覆水,直接增加上覆水中TSS含量与PHE浓度。致使上覆水中DOC浓度发生变化原因主要有两方面:一是底栖生物可混合颗粒和孔隙水,改变底泥向水中的释放通量,促进有机碳从底泥向水中释放[21];二是底栖生物排泄物中有大量小分子溶解性有机质,直接提高上覆水中DOC浓度[22]。同时,生物扰动作用可促进底泥中多环芳烃在泥水交界处发生吸附-解吸作用,造成本研究底泥和悬浮物中PHE浓度处于动态波动[23]。
在环境介质影响生物富集程度方面,针对体系中鱼类而言,PHE可通过溶解态形式进入鱼类体内,还可通过鳃以悬浮物形式被鱼吸收,导致在TSS浓度较高的扰动组中,鱼类生物富集程度普遍偏高[24]。不同于鱼类,底泥摄入是底栖生物主要的生物富集途径[25]。蟹与鳅均为穴居底栖生物,本试验中底泥PHE浓度直接影响PHE在其体内的富集。PHE在水稻中的富集程度则取决于体系中底泥和上覆水两部分PHE可利用浓度。一方面,水稻主要通过根系在底泥中富集PHE,导致根系部位PHE富集浓度大于茎叶,且不同于水稻其他部位,PHE作为一种具有挥发性PAHs,可从叶片挥发到大气中,最终导致叶片中PHE浓度有所下降,这种差异在小麦和水稻的研究中均有报道[26-27]。另一方面,生物扰动增强PHE从底泥到水中释放,导致水稻获得大部分上覆水中PHE,增加PHE生物有效性,导致扰动组中水稻PHE富集程度较高[22]。
在生物富集机制与生态风险评估方面,基于上述相关性分析、主成分分析、结构方程模型分析的结果则证明PHE在生物体内的富集与诸多因素有关。在扰动组中,菲富集最主要原因是生物扰动作用使环境条件发生变化,打破体系原有平衡,提高上覆水中TSS浓度,间接提高上覆水中DOC浓度,最终加剧PHE在生物体内富集状况,导致生物体内相关富集因子偏高。因DOC是溶解性有机质(DOM)的重要组成成分,Lin等研究表明,DOM对PAHs具有增溶作用,可促进PHE在生物体内富集[28]。在无扰动组中,鱼类等生物的BSAF和BSSAF等也有相应累积,说明PHE在生物体内富集程度主要受上覆水中PHE浓度影响。试验结束后,无扰动组中水稻根3种生物富集因子整体偏高,可能因水田饱和状态下,水稻根浸泡在水中可能增加根表面对PHE的吸附,导致水稻根中PHE浓度偏高,对水稻产生健康风险[29]。
4 结论
本试验结果表明:①生物扰动作用提高微宇宙环境中TSS和DOC浓度,TSS和DOC浓度变化程度反映生物扰动强度。蟹是主要扰动者,当蟹、鳅同时存在时,扰动更为剧烈。②生物扰动促进底泥中PHE解吸,导致PHE在水稻和水生生物中的富集程度增加,提高稻蟹共作模式的环境风险。③在不同扰动类型中,生物富集PHE机理不同。在无生物扰动(ND)或扰动强度较小(LD)的微宇宙装置中,PHE在生物体内富集程度受上覆水中PHE浓度直接影响。在生物扰动较大(CD,MD)的装置中,生物扰动提高TSS和DOC浓度,高浓度TSS和DOC促进PHE在生物体内富集。④生物扰动对生物富集因子的影响表现在改变鱼、鳅、水稻的根BASF值和BASSF值,对BAF值影响较小。
