纤维素纳米纤维-海藻酸钠复合微球制备及吸附亚甲基蓝研究
2022-10-12滕克勇黄家毅易泽德秦志永
*滕克勇 黄家毅 易泽德 秦志永
(1.广西高林林业股份有限公司 广西 537500 2.广西大学资源环境与材料学院 广西 530000)
随着纺织和皮革等行业的快速发展,大量染料分子废水排放到水体中造成水体污染,水体污染已经成为全球性环境问题之一[1-2]。染料分子在水体中能够稳定存在,较难进行生物降解,并且这种染料会对人体及生态环境造成不利影响[3-4]。在众多水体污染防治方法中,吸附法因其操作简单、成本低等特点,受到了广泛的关注[5-6]。其中,活性炭因高比表面积、吸附能力强和吸附速率快等优点被认为是最有效的吸附材料之一[7]。然而,高性能活性炭材料成本高,导致其使用受到了极大的限制且不可以生物降解。因此,开发储量丰富、价格便宜、绿色环保的吸附材料已经迫在眉睫,其中,生物质材料吸附剂因对环境友好等优点而备受关注[8]。
海藻酸钠(SA)属于天然高分子多糖聚合物[9],能够与二价及二价以上金属离子发生交联反应,富含丰富的羧基和羟基,可以和染料分子结合,被用于去除水体中染料污染[10]。纤维素纳米纤维(CNF)具有比表面积大,力学强度优异等特点,同时含有丰富的羧基和羟基官能团,可以能吸附水体的染料分子,CNF的引入为提高SA吸附材料的强度和吸附性能提供了可能[11]。
采用CNF及SA为主要原材料通过金属离子交联的方法,制备SA/CNF复合微球,研究SA/CNF微球对亚甲基蓝(MB)的吸附性能,采用傅里叶变换红外光谱(FTIR)和扫描电子显微镜(SEM)对化学结构、物理形貌进行表征。
1.材料与方法
(1)实验材料
纳米纤维素(CNF,北方世纪纤维素材料有限公司);海藻酸钠(SA,AR),无水氯化钙(CaCl2,AR),亚甲基蓝(MB),盐酸和氢氧化钠等均购买于麦克林生物化学有限公司。
(2)实验方法
①SA/CNF混合溶液的配制
用蒸馏水分别配置1%质量分数SA溶液和1%质量分数CNF溶液,调节SA与CNF质量比为4:1,配置混合溶液,室温下搅拌6h,使其混合均匀,备用。
②SA/CNF复合微球的制备
用注射器取SA/CNF混合溶液10g,缓慢滴入到2%质量分数的CaCl2溶液中。交联24h后用蒸馏水清洗,清除多余未交联的Ca2+,冷冻干燥24h,即得SA/CNF复合微球,置入干燥器中,备用。
③表征及吸附实验
A.吸附剂表征
采用扫描电子显微镜(ZEISS Sigma 300)分别对吸附前后的纯SA和SA/CNF复合微球表面及断面进行观察。其中,电压为3kV,放大倍数为100×。将纯SA和SA/CNF微球于60℃下烘至绝干,采用溴化钾压法,置于Nicolet iS 50型傅里叶变换红外光谱仪上进行红外测试。波数范围为400~4000cm-1,分辨率4cm-1,扫描次数32次。
B.吸附实验
取50ml MB溶液(质量浓度为100mg/L),放入微球15mg,研究吸附时间、pH、初始浓度和温度对吸附性能的影响。吸附完成后通过UV-1800PC型双光束紫外-可见分光光度计在最大吸收波长λmax=664nm处,检测吸光度,通过标准曲线换算出MB质量浓度的变化,见公式(1)。

式中,C0为MB染料的初始浓度(mg/L);eC为达到吸附平衡后剩余MB染料的质量浓度(mg/L);V为吸附时MB染料的体积(mL);m为吸附剂的质量(g);eq为吸附剂的吸附值(mg/g)。
2.结果与讨论
(1)扫描电镜分析(SEM)
吸附前后SA/CNF微球表面与断面形态如图1所示,从图1(a)可以看出,吸附前SA/CNF微球的表面有许多褶皱,这为吸附MB分子提供了大量的活性位点;吸附后的SA/CNF微球的表面仍有许多褶皱,但是其表面出现了许多粒子,这是因为其吸附了MB分子所导致,见图1(b);从图1(c)可以看出,SA/CNF微球内部是多孔的形态,这有助于提高吸附性能,且吸附前后变化不大,见图1(d)。

图1 吸附前后SA/CNF复合微球表面与断面的SEM图
(2)FTIR分析
纯SA微球和SA/CNF微球的红外谱图如图2所示。SA/CNF微球并未形成新的吸收峰,这说明SA与CNF未发生化学反应,二者通过氢键作用连接[12]。3450cm-1处对应的是-OH的伸缩振动吸收峰,这也是吸收MB染料的活性官能团。通过比较,研究人员可以发现SA/CNF复合微球在3450cm-1的吸收峰更为强烈,CNF的引入提供了丰富的羟基活性官能团;1630cm-1处和1400cm-1对应的是SA与CNF分子羧酸根对称伸缩振动峰。
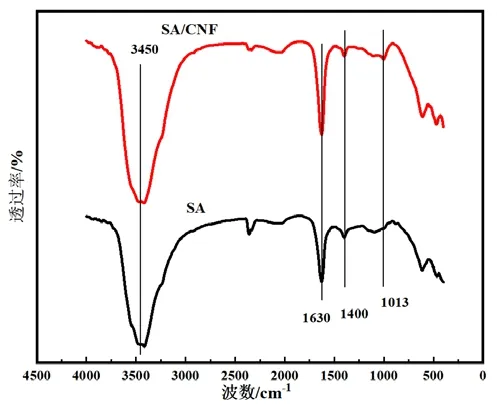
图2 纯SA与SA/CNF复合微球的红外吸收光谱
(3)吸附时间的影响结果及吸附动力学的研究
不同吸附时间SA/CNF微球对MB分子的吸附值如图3所示。SA/CNF微球对MB的吸附值随时间的增加而增加,最终达到吸附平衡。吸附过程可分为两个阶段:第一阶段为0~120min内,微球对MB分子的吸附速率较快,在吸附约120min后达到吸附平衡,吸附值为173.52mg/g,为快吸附阶段,该阶段内,SA/CNF微球上有充足的活性位点MB分子结合,吸附MB速率快;第二阶段为吸附120min以后,SA/CNF微球对MB分子吸附值趋于稳定,为缓慢吸附过程,该阶段,SA/CNF微球上的活性位点已经与MB充分结合[5]。

图3 吸附时间对SA/CNF吸附MB的影响
采用动力学模型研究吸附过程,主要包括拟一级动力学模型和拟二级动力学模型。拟合结果如图4所示。拟二级动力学方程的相关系数(R2=0.9998)大于拟一级动力学方程的相关系数(R2=0.1955)。该吸附过程更符合拟二级动力学模型,化学吸附在吸附过程中占据主导地位。

图4 SA/CNF复合微球吸附MB的拟一级动力学方程(a)和拟二级动力学方程(b)
(4)MB浓度、温度及pH对吸附过程的影响
在不同MB染料浓度下,SA/CNF微球对MB的吸附值如图5(a)所示。随着MB染料浓度的增加,吸附值呈现同步增加的趋势,其原因是当MB染料的质量浓度较低,微球有充足的吸附位点来吸附染料,吸附值增加。
不同温度SA/CNF微球对MB的吸附如图5(b)所示。从20~30℃,SA/CNF对MB的吸附值逐渐增加,在30℃时达到最大值,温度低,染料分子运动速率慢,吸附值偏小。从30~60℃,SA/CNF对MB的吸附值急剧下降,温度升高不利于对MB的吸附。这是由于温度过高MB分子的运动速率过快,微球对MB分子的吸附量小于脱附量,阻碍了吸附反应的进行。
在不同pH下,SA/CNF微球对MB的吸附值如图5(c)所示。随着pH的增加,SA/CNF对MB的吸附值先增大后稳定。当处于强酸条件下,溶液中的H+质量浓度过高,MB染料为阳性染料,导致了H+与MB染料的竞争吸附,而当H+被吸附到吸附剂表面时更会阻碍吸附剂对MB染料的吸附;随着pH的增加,染料中OH-也逐渐增多,H+对吸附剂吸附MB的阻碍减小;当pH大于7时,吸附值保持不变,其原因是MB分子之间存在空间位阻,阻碍了吸附反应的进行。
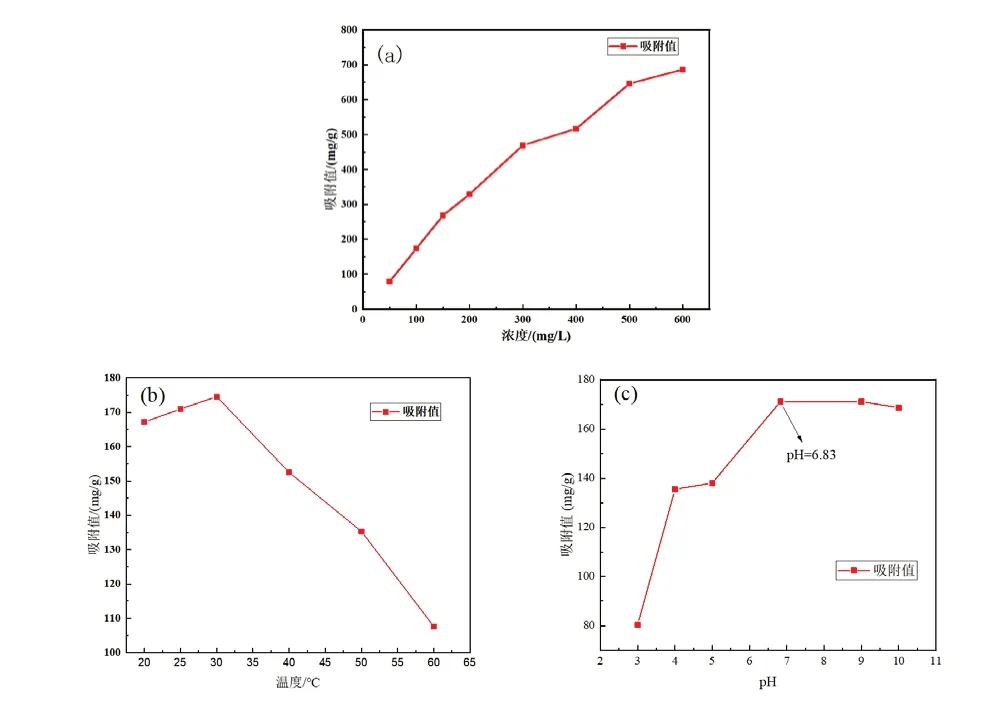
图5 MB质量浓度(a)、温度(b)及pH(c)对吸附过程的影响
采用等温线吸附模型Langmuir吸附等温线和Freundlich吸附等温线研究温度对吸附过程的影响[1],如图6所示。Langmuir吸附等温线模型的相关系数(R20.9842)大于Freun-dlich吸附等温线模型的相关系数(R20.9053),说明该吸附过程更符合Langmuir吸附等温线模型。根据Langmuir吸附等温线模型计算吸附剂最大理论吸附值为775.19mg/g。

图6 Langmuir吸附等温线模型(a)和Freundlich吸附等温线模型(b)拟合
3.结论
(1)SEM表明,SA/CNF微球表面具有大量的褶皱,比表面积较大,为吸附行为提供了丰富的活性位点,SA/CNF的内部是多孔形态,有利于提高吸附剂的吸附性能。FTIR分析表明,SA与CNF通过氢键交联,CNF的引入为吸附MB染料的吸附提供了丰富的羟基活性官能团。
(2)吸附动力学模型表明,吸附过程更符合拟二级吸附动力学模型;吸附等温线模型拟合结果表明,该吸附过程符合Langmuir吸附等温线模型,最大理论吸附值为775.19mg/g。SA/CNF微球在pH约为6.83时,对MB染料吸附值最大。
