云南曲靖下泥盆统桂家屯组一种新的工蕨类植物及栖生的微螺虫
2022-10-11杨帅黄璞刘璐王嘉树张久东薛进庄
杨帅 黄璞 刘璐 王嘉树 张久东 薛进庄
云南曲靖下泥盆统桂家屯组一种新的工蕨类植物及栖生的微螺虫
杨帅1黄璞2,†刘璐3王嘉树1张久东4薛进庄1
1.造山带与地壳演化教育部重点实验室, 北京大学地球与空间科学学院, 北京 100871; 2.中国科学院南京地质古生物研究所, 南京 21000 8; 3.北京自然博物馆, 北京 100050; 4.宿州学院资源与土木工程学院, 宿州 234000; †通信作者, E-mail: puhuang@nigpas.ac.cn
记述发现于云南曲靖锅盖山剖面桂家屯组的一种早期维管植物。该植物茎轴裸露, 根状茎以连续多次K 型或 H 型分枝形成复杂的分枝系统, 直立轴呈简单的二歧式分枝, 孢子囊侧视呈匙形至卵形, 螺旋状着生于穗轴上。该植物体型较小, 保存较完整的根状茎, 但孢子囊穗的保存状况较差, 孢子囊结构不够清晰, 无明显可见的孢子囊开裂线, 因此将其暂定为 cf.sp.。尽管如此, 该植物展现的性状特征不同于典型的及其他相关属种, 丰富了人们对早期维管植物形态变异及桂家屯组植物组合的认识。在 cf.sp.的直立轴表面栖生大量微螺虫(microconchids)标本, 直径为 0.7~2.2mm。微螺虫是一种已灭绝的水生无脊椎动物, 发现于晚奥陶世到中侏罗世末期地层中, 其壳体为螺旋状的钙质管, 习惯固着在包括植物在内的各种硬质基体上。微螺虫在 cf.sp.的直立轴栖生, 表明该植物在生长期间曾被水体淹没, 之后微螺虫伴随植物茎干被搬运和埋藏。
早期维管植物; 工蕨类; 微螺虫; 桂家屯组; 下泥盆统
我国西南地区的下泥盆统分布广泛且出露情况良好, 其中产出种类丰富的植物化石, 以云南文山和曲靖地区的早泥盆世植物群为代表[1]。云南曲靖地区的下泥盆统自下而上分为下西山村组、西屯组、桂家屯组和徐家冲组, 是中国非海相下泥盆统的代表性地层单元[2]。各组地层中植物化石的丰度不同, 研究程度也有很大的差别。徐家冲组的植物化石最丰富, 研究也最细致[3−7], 其他各组则较为薄弱。对于桂家屯组, 迄今只描述过(米尔顿工蕨)[8], 但归入的标本保存状态较差, 其分类归属存疑。
基于多年的野外工作, 我们在云南曲靖一个新发现的桂家屯组剖面上采集大量植物化石, 其中包括一种工蕨类植物。有趣的是, 在这种工蕨类植物的茎轴上, 栖生一种具螺旋壳体、营水生习性的动物——微螺虫(microconchids)。有关微螺虫栖生于植物茎轴上的现象, 可以追溯到 Høeg[9]1942 年的研究工作。依据化石记录开展植物与微螺虫相互关系的研究, 对揭示植物的生存环境、沉积环境和埋藏条件有重要意义。本文对桂家屯组新发现的工蕨类植物进行详细的形态描述、分类学比较和讨论, 并对其茎轴上栖生微螺虫的现象进行描述和解释。
1 地层、材料与方法
本文报道的植物及微螺虫标本采自云南曲靖下泥盆统桂家屯组, 化石产地位于市区以北的锅盖山, (25°34′0″N, 103°47′14″E)(图 1)。桂家屯组的岩性为紫红色、灰绿色粉砂质泥岩及灰绿色、浅灰色细粒石英砂岩, 发育钙质古土壤, 实体化石较少, 目前仅记录植物(存疑)、sp.和? sp., 双壳类等, 腹足类cf., 胴甲鱼类和, 肉鳍鱼类sp.及孢子化石等[10−12]。
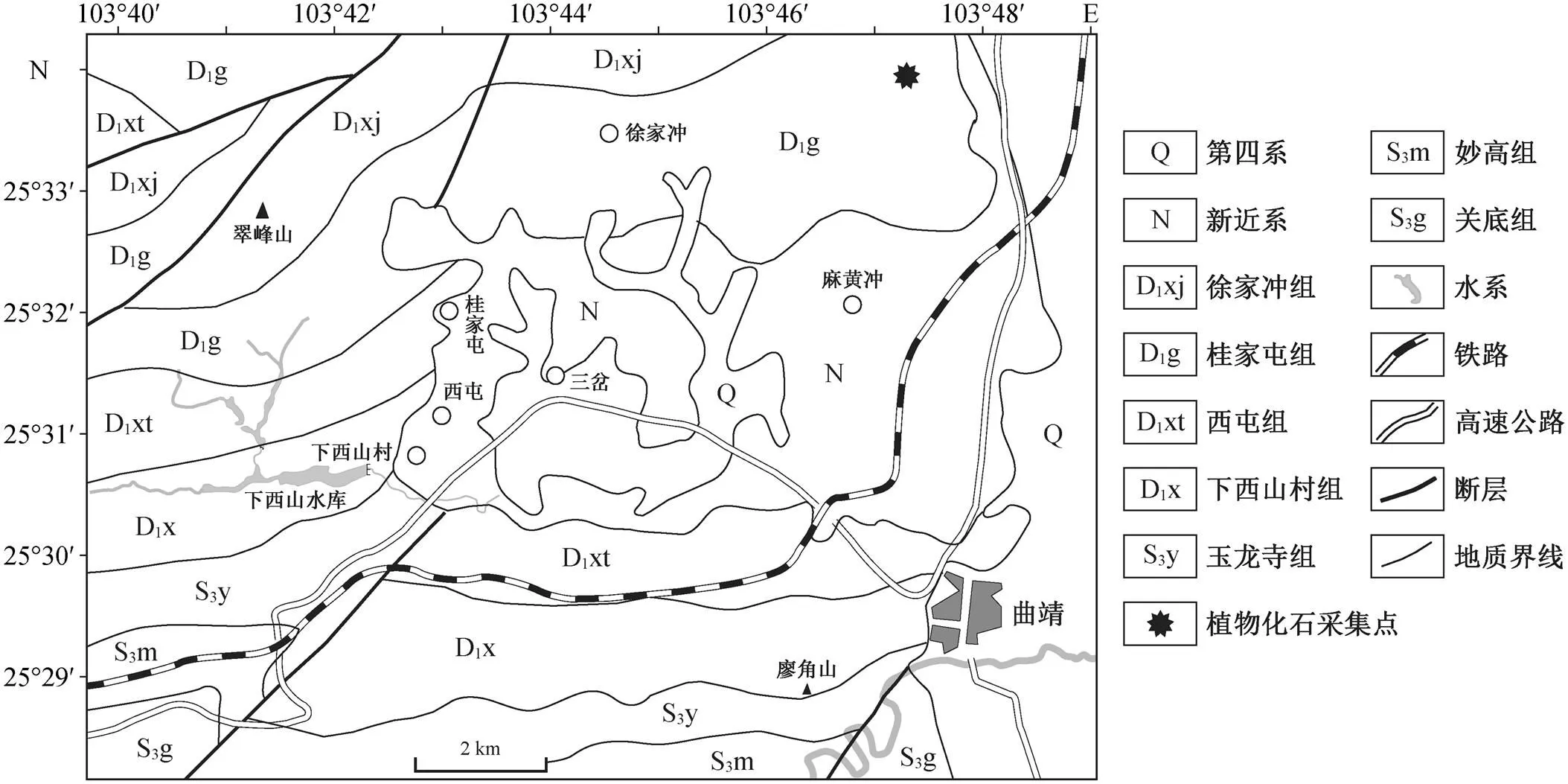
图1 化石产地及曲靖附近地区地质图(修改自文献[1])
本文研究的植物化石标本有近 100 块, 以压型和印痕方式保存于灰绿色粉砂岩中, 其中包含附着微螺虫的茎轴标本 20 余块。在植物化石的围岩中, 未发现离散保存的微螺虫化石。所有标本均保存在北京大学地球与空间科学学院。
在实体显微镜下, 对部分植物化石标本进行针修, 使围岩中的植物结构暴露出来, 再进行拍摄。使用 ImageJ 软件进行标本的形态学测量, 使用 R 语言和 Origin 软件分析度量数据, 并进行图示。
2 cf.Zosterophyllum sp.的描述及分类学讨论
2.1 根状茎
本文研究的植物化石标本来自同一层位, 根据形态特征, 可分为根状茎、直立营养轴和能育轴 3类。化石保存状态较为破碎, 表明经历了一定距离的搬运。一般认为, 植物的根状茎在土壤中或近地表生长, 而直立轴为气生。如果当前的根状茎和直立轴分别代表两种植物, 那么应该经历不同的搬运过程, 才能使它们被埋藏在一起, 并且其搬运和埋藏的时间和空间要同步。但是, 根据岩性及化石保存状态, 这种情况不大可能发生。能育轴呈离散状保存, 但在营养轴和能育轴上栖生的微螺虫特征一致。因此, 依据标本的保存状态、表面特征和宽度等信息, 我们推断这 3 类标本属于同一种植物。
根状茎以具有 K 型或 H 型分枝为特征, 以前者最为常见(图 2)。根状茎的宽度范围为 1.7~4.2mm, 平均宽度为 2.5mm。
图 2(a)和(b)示一枚正、负面保存的标本, 图3(a)为该标本的线条图。从该标本上可识别出 12 次分叉(分枝点), 形成分别由分叉 b1-b2, b3-b4, b5-b6, b7-b8, b9-b10 和 b11-b12 构成 6 个 K 型分枝(图 3 (a))。一个根状茎先分叉一次, 形成一个呈锐角或近似直角状延伸的短侧枝(简称短枝), 该侧枝再次分叉, 形成两个呈钝角状延伸的子枝(简称长枝), 形成 K 型分枝。在这枚标本中, 分叉 b1, b3, b5, b7, b9 和 b11 为典型 K 型分枝的第一次分叉, 分叉角度为 75°~99° (平均 88°); 分叉 b2, b4, b6, b8, b10 和 b12为 K 型分枝的第二次分叉, 分叉角度为 78°~122° (平均 102°)。这 6 个 K 型分枝中, 短枝和长枝的长度分别为 4.5~9.0mm (平均 7.2mm)和 14.8~29.4mm (平均 22.6mm)。
图 2(d)和(e)为另一枚正、负面保存的标本, 图3(b)为其线条图。该标本下部保存较完整, 可观察到连续分叉 5 次, 分叉角度介于 66°~79°之间。依据图 3(b), 茎轴 A 先分叉一次, 形成近似垂直伸出的侧枝 B。侧枝 B 延伸约 5.8mm 后, 以较小的角度(66°)分叉, 形成子枝 C 和 D。因此, 茎轴 A 经两次分叉, 形成枝 A′, B, C 和 D, 构成 1 个 K 型分枝。枝D 延伸 13.8mm 后, 以 76°角度再次分叉, 形成枝 E和 F。枝 A′和 B 呈现不同的延伸方向, 前者继续延伸 43.8mm后再发生分枝, 后者仅延伸 5.8mm 后多次分叉。
其他解释为根状茎的标本显示至少一个 K 型分枝(图 2(c)和(f)~(i))。图 2(c)中可识别出 10 次分叉, 观察到 4 个 K 型分枝(图 3(c)中 K1~K4), 第一次分叉和第二次分叉的角度分别为 45°~85° (平均 70°)和 90°~103° (平均 98°), 短枝和长枝的长度分别为3.1~7.5mm (平均 5.6mm)和 9.0~12.4mm (平均10.9 mm)。图 2(f)~(i)均为由两次分叉构成的在围岩中分散保存的单个 K 型分枝, 这些 K 型分枝中, 第一次分叉和第二次分叉的角度分别为 74°~105° (平均 78°)和 103°~123° (平均 110°), 短枝和长枝的长度分别为6.2~10.9 mm (平均 7.6 mm)。
2.2 直立轴
直立轴保存长度最大的为 95.0mm (图 4(a)), 宽度范围为 2.6~6.9mm, 平均宽度为 3.8mm, 分叉后有向上变细的趋势(图 4(c)和(e))。直立轴保存宽度最大者为图 4(a)和(e)的茎轴, 分别为 5.0 和 6.9mm, 其他大多解释为直立轴的标本宽度范围为 3.0~4.0 mm, 据此推断宽度最大的直立轴位于植物体下部。与根状茎相比, 直立轴呈简单的二歧式分枝(图 4), 分叉角为锐角, 角度范围为 29°~56°。图 4(a)中茎轴的基部以较小的角度(40°)分叉, 形成两个子枝。左侧子枝延伸约 85.8mm, 宽度为 3.5~4.8mm, 茎轴表面具疑似凸起(图 4(a)中箭头所指), 由于保存原因, 不能判定它们是否为侧枝。右侧子枝延伸较短, 长度为 33.3mm, 宽度为 3.9~4.3mm。图 4(c)和(d))中标本是等二歧式分枝, 而图 4(e)和(f))中标本倾向于不等二歧式分枝。大多数直立轴表面粗糙, 碳屑不均匀, 是微螺虫的栖生所致。
2.3 孢子囊穗
孢子囊松散地排列, 可能在枝的顶端形成穗状, 所以暂时按孢子囊穗进行描述。仅发现两个孢子囊穗, 保存状态较差。其中一个为正、负面保存(图 5 (a)和(b)), 但两端均有缺失, 可识别出至少 8 个孢子囊(图 5(a)中数字 1~8 所示)。该孢子囊穗的长度为 34.0mm, 最大宽度为 13.0mm。穗轴的宽度范围为 0.7~2.5mm, 孢子囊呈螺旋状着生于穗轴之上, 在穗轴上分布较为松散, 相邻的孢子囊间隔 5.6~ 7.7mm。另一个孢子囊穗上仅保存一个完整的孢子囊, 其他孢子囊在囊柄处发生断裂(图 5(c))。孢子囊穗向上略变窄, 孢子囊个体向上亦有变小的趋势(图 5(a))。
孢子囊囊柄呈 27°~37°锐角倾斜地从穗轴向上伸出, 呈向上变粗的趋势, 延伸至孢子囊的基部。囊柄的长度为 2.4~3.3mm, 宽度为 0.5~1.5mm。在其中一个孢子囊上, 可以观察到囊柄的向上延伸物包裹住孢子囊本体(图 5(d)和(e)), 囊柄延伸物与孢子囊本体的碳屑质地显示出异质性, 两者紧密地接触。在其他孢子囊上, 该现象不明显。孢子囊(囊柄延伸物+孢子囊本体)侧视呈匙形至卵形(图 5(d)~ (g)), 顶端圆凸, 无明显的开裂线。从侧视看, 孢子囊的高度受压实作用影响较小, 其宽度因保存的位置和角度受到一定程度的影响。孢子囊高度为 3.6~ 5.5mm, 平均高度为 4.5mm(= 7); 侧面宽 2.6~3.4mm, 平均宽度为 3.0mm (= 7)。孢子囊高度与宽度的比值约为 1.5。
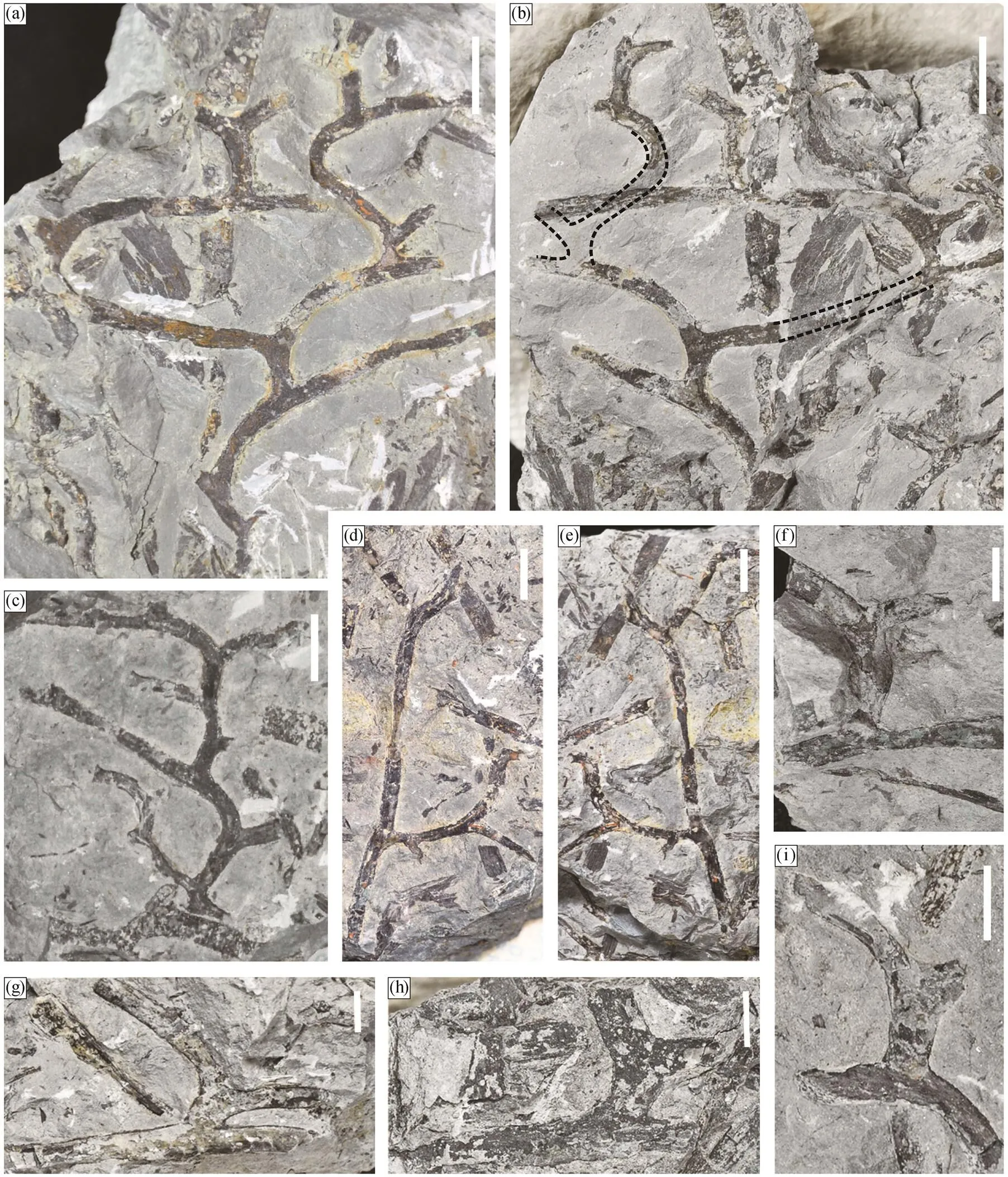
(a)和(b)正、负面标本, 根状茎重复多次 K 型分枝, 标本号分别为 PKUB18209a 和 PKUB18209b; (c)多次重复 K 型分枝的根状茎, 标本号为 PKUB18225; (d)和(e)正、负面标本, 具 K 型分枝的根状茎, 标本号分别为 PKUB18254a 和PKUB18254b; (f)~(i)较破碎的根状茎, 仅显示一次 K 型分枝, 标本号分别为 PKUB18205, PKUB18211, PKUB18221和 PKUB18212。比例尺: (a)~(e)为 10 mm; (f)~(i)为 5 mm
2.4 比较与讨论
本文标本的直立轴略宽于根状茎, 穗轴较为细小(图 6), 孢子囊呈螺旋状, 以短柄着生于穗轴之上, 孢子囊上未见明显的开裂线, 个别孢子囊的囊柄向上延伸, 包裹住孢子囊本体(图 5(d)和(e))。本文标本的孢子囊形态特征与(中国工蕨)[13]非常相似, 我们在一些的标本上也观察到其“孢子囊”实际上是由孢子囊柄的延伸物和孢子囊本体两部分构成(见文献[13]中图 5(B)和(C), (H)和 (I)), 这一特点与的其他种差别很大。本文标本的孢子囊宽度以及囊柄的长度、宽度和插入角度都与非常相近, 但有一些差别。比如,孢子囊的高度为 2.4~4.7mm, 略小于本文标本, 其茎轴宽度不足本文标本的一半。尽管本文标本的繁殖结构与有一定的相似性, 但现有的标本较少, 对其孢子囊形态变异及结构的了解不够完善, 因此这里将其暂定为 cf.sp。
(工蕨属)是早泥盆世维管植物中最常见的分子之一, 至今已经报道 20 余种[1]。自Penhallow[14]1892 年建立以来, 该属的特征几经修订。Penhallow 最初认为该属的特征为具有匍匐茎, 分枝方式为二歧式分枝, 孢子囊呈圆球形至卵形, 以短柄着生于穗轴上。随着研究的深入, 目前认为该属有两个关键特征, 一是孢子囊呈螺旋状排列, 二是孢子囊以短柄着生于穗轴上, 顶端横向开裂成两瓣[15]。依据孢子囊在穗轴上的排列方式,分为(工蕨亚属)和(扁工蕨亚属), 前者的孢子囊在穗轴上呈螺旋状排列, 后者的孢子囊在穗轴上排列成一排或两排[16−18]。对于属内各个种, 主要根据孢子囊的排列方式、囊柄形态以及插入穗轴的角度等形态学特征进行划分[1]。
虽然大多数的种孢子囊宽度大于高度, 如.[19]、.[20]、.[21]、.[22]和.[23]等, 但也有一些种的孢子囊高度大于宽度, 如Z.[8]、.[24]、.[1]、.[1]和.[13]。表 1 中的对比表明, cf.sp.与后几个种的形态学特征(如茎轴、孢子囊穗、孢子囊和囊柄等)均存在区别。
(先骕蕨属)与 cf.sp.具一定的可比性。目前报道的有两种:[25]和[3]。的孢子囊在穗轴上的排列较为松散, 这一特点与 cf.sp.较为相似, 但孢子囊的囊柄较长(表 1), 没有向上渐粗的趋势, 并且孢子囊具有向穗轴回弯, 甚至向内倒垂着生的特点[3,25], 这一特征与 cf.sp.的差别较大。
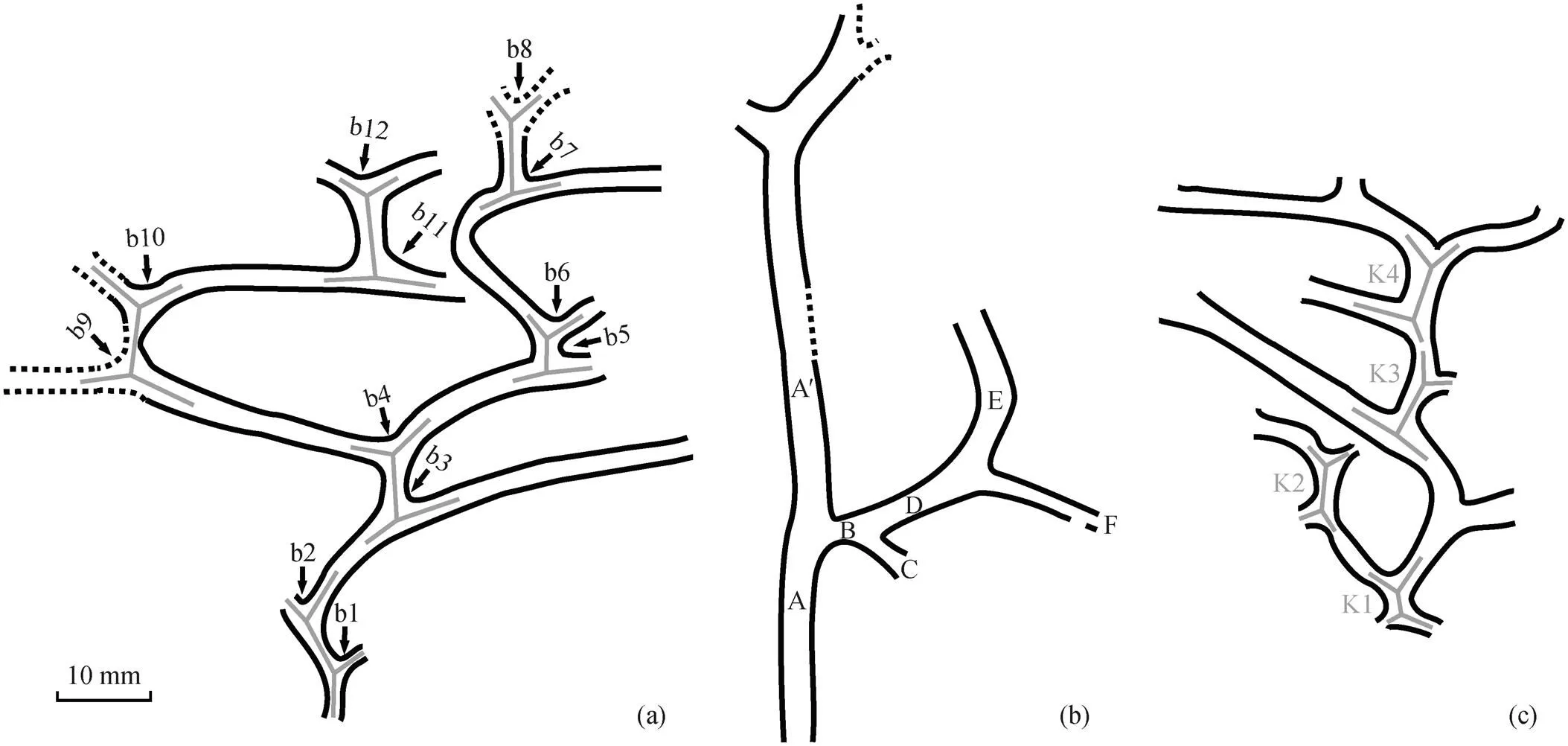
(a)基于图2(a)和(b)绘制, b1~b12为分叉点; (b)基于图2(d)和(e)绘制, A~F和A′为分叉后的分枝; (c)基于图2(c)绘制, K1~K4为4个K型分枝
早期维管植物的繁殖结构具有丰富的形态多样性, 体现在其孢子囊的着生方式(顶生或侧生, 单生或簇生, 是否具有营养附属物)、形状、大小、壁层结构以及孢子特征等多个方面, 是分析其系统关系和分类位置的重要依据[1]。莱尼蕨类、工蕨类、石松类和真叶植物等各类群在早泥盆世已经显现, 它们的繁殖结构各具特色, 呈现爆发式辐射的特点。本文报道的 cf.sp.的囊柄延伸物与孢子囊本体紧密结合, 类似的特征也见于的一些标本。这种孢子囊代表了一个新的类型。如果将囊柄的延伸物理解为营养性的附属物, 那么这种类型的孢子囊与(西屯蕨和(奇异蕨)等的繁殖结构可能存在联系, 后者的孢子囊分别具有营养性的附属物和孢子叶[1,26]。特别是坡松冲组的sp. (见文献[1]中图 4.49), 其孢子囊的形状与 cf.sp.非常相似, 但前者具有与孢子囊分离的扇状孢子叶, 而 cf.sp.囊柄的延伸物与孢子囊明显愈合。目前, cf.sp.的繁殖结构标本较少, 进一步比较与上述植物之间的系统关系需要研究更多的新材料。
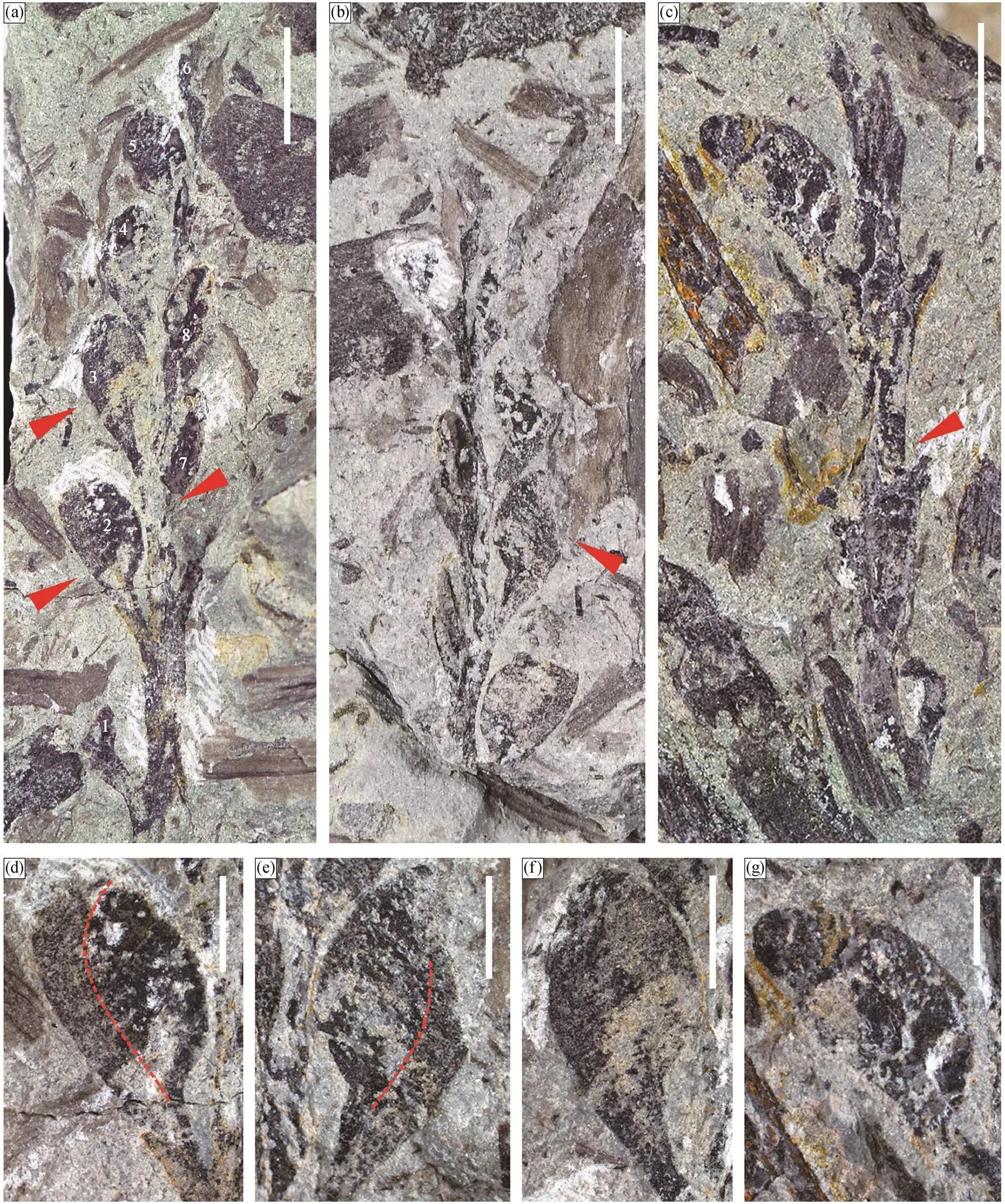
(a)孢子囊穗(下部箭头所指孢子囊的放大图示于(d), 上部箭头所指孢子囊放大图示于(f)), 中部箭头所指孢子囊有部分叠覆在穗轴之下, 孢子囊螺旋式排列于穗轴上, 标本号为PKUB18201a; (b)为(a)的负面标本(箭头所指孢子囊的放大图示于(e)), 孢子囊保存不完整, 标本号为PKUB18201b; (c)孢子囊穗, 仅显示一个完整的孢子囊(放大图示于(g)), 其他孢子囊已脱离, 仅可见其断裂的孢子囊柄(箭头所指), 标本号为PKUB18202; (d)和(e)2 号孢子囊的正、负面放大图, 囊柄向上延伸, 似包裹孢子囊本体, 红色虚线为孢子囊本体与囊柄延伸物的分界线; (f)和(g)孢子囊的放大图。比例尺: (a)~(c)为5 mm; (d)~(g)为2 mm
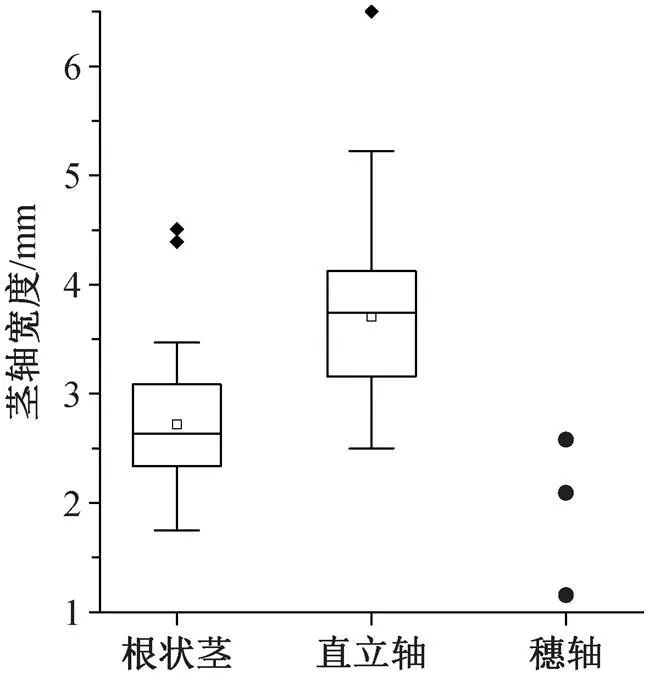
图6 云南曲靖桂家屯组cf. Zosterophyllum sp.的形态度量值
3 cf. Zosterophyllum sp.茎轴上的微螺虫(microconchids)
3.1 微螺虫描述
部分 cf.sp.的茎轴上附有大量个体较小、壳体盘绕的动物(图 7), 其形态和尺寸与微螺虫吻合。壳体为圆盘状, 其最大宽度范围为 0.7~ 2.2mm (平均 1.3mm) (图8(b),= 34), 具有最多两个旋环(图 7(i)), 第二个旋环的宽度略大于第一个旋环(图 8(a))。管径均匀地增大, 脐孔不清晰。大多数标本的虫管盘绕程度都不同, 有较为松散的(图 7(b)和(g)), 也有较为紧实的(图 7(e)、(k)和(i))。虫管的盘绕方向既有左旋(图 7(k)中箭头所指和图 7(a)), 也存在右旋(图 7(e)中箭头所指以及图 7(b)和(i))。整个虫管的底部都固着在植物茎干上, 虫管终端部分没有明显的向外螺旋式展开迹象。虫管的外表面较为平滑(图 7(b)、(g)和(k)), 但有的个体具有垂直于生长方向的脊状纹饰(图 7(c))。
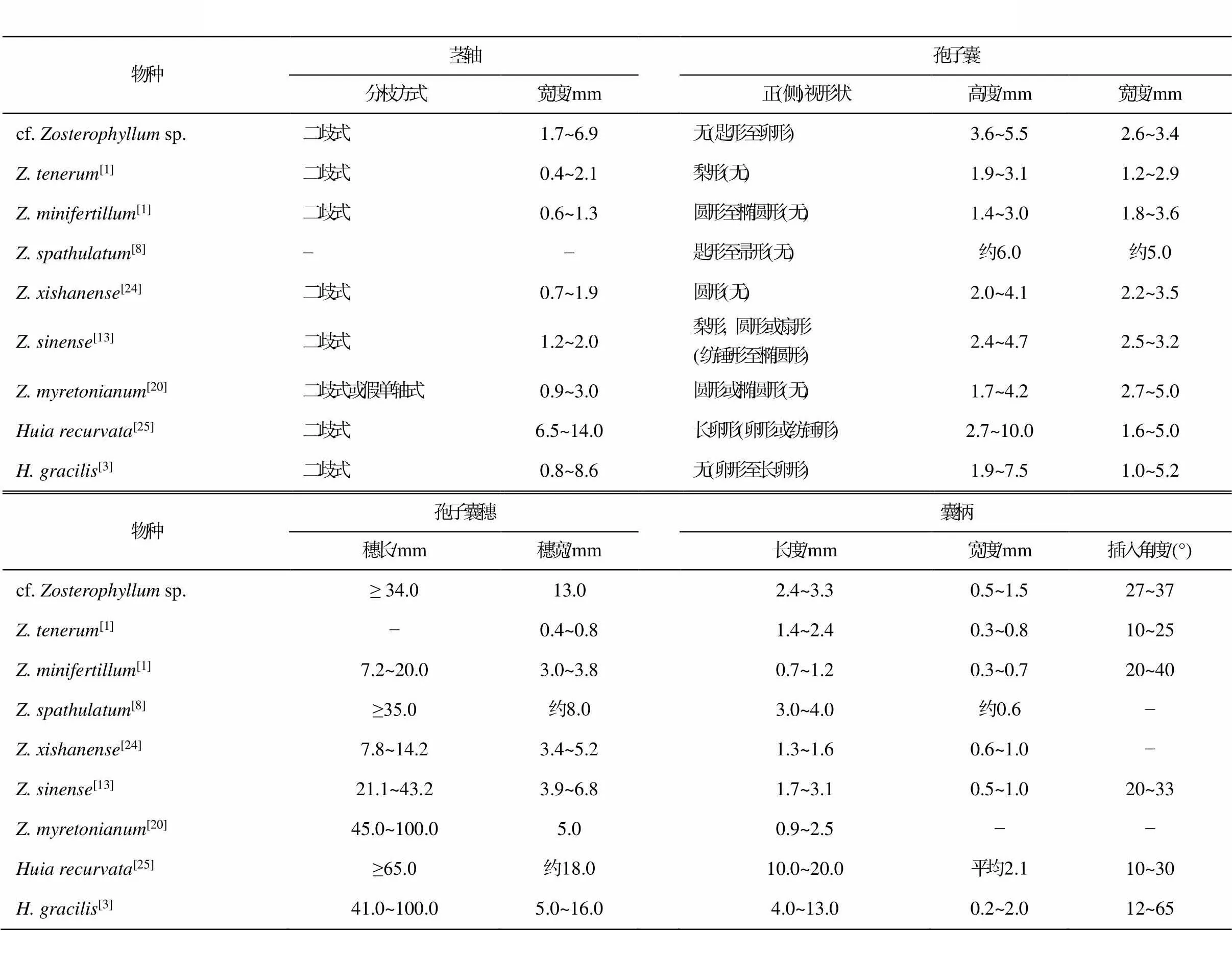
表1 本文标本与其他相关属种的形态学对比
(a)和(b)微螺虫保存在植物茎轴上, 标本号分别为PKUB18270和PKUB18202; (c)微螺虫的局部放大图, 管壁表面具有垂直于生长方向的脊状纹饰(箭头所指), 标本号为PKUB18254; (d) 4 个微螺虫松散地排列在植物茎轴上, 标本号为PKUB18251; (e)为(d)的局部放大图; (f)茎轴分叉点上的微螺虫, 标本号为PKUB18210; (g)为(f)的局部放大图; (h) 植物茎轴上的大量微螺虫, 标本号为PKUB18209a; (i)为(h)上部箭头所指微螺虫的放大图; (j) 茎轴上的微螺虫(箭头所指), 其中右侧3个密集排列(放大图示于(k)), 标本号为 PKUB18252; (k)为(j)中箭头所指处的局部放大图; (l) 两个微螺虫保存在茎轴上, 标本号为PKUB18213。比例尺: (d)、(f)、(h)和(j)中代表2 mm; (a)、(b)、(i)和(l)中代表1 mm; (e)和(k)中代表500 μm, (c)和(g)中代表200 μm
图7 云南曲靖桂家屯组cf. Zosterophyllum sp. 直立轴上伴生的微螺虫
Fig. 7 Microconchids occupying upright axes of cf. Zosterophyllum sp. from the Guijiatun Formation of Qujing, Yunnan Province
这些微螺虫化石普遍保存于直立轴上, 孢子囊穗轴下部也有少量微螺虫着生(图 5(c)中箭头所指和图 7(b)), 但未在根状茎上发现微螺虫。微螺虫所在茎轴的宽度范围为 2.2~4.9mm, 在植物直立轴的不同区域都分布着微螺虫(图 7(d)、(k)和(h))。通过统计发现, 微螺虫倾向于固着在较为粗壮的茎干上(图 8(d)), 但不同大小的微螺虫在直立轴上的分布没有明显的规律(图 8(c))。基于上述描述, 绘制 cf.sp的直立轴和桂家屯组微螺虫复原图(图 9)。
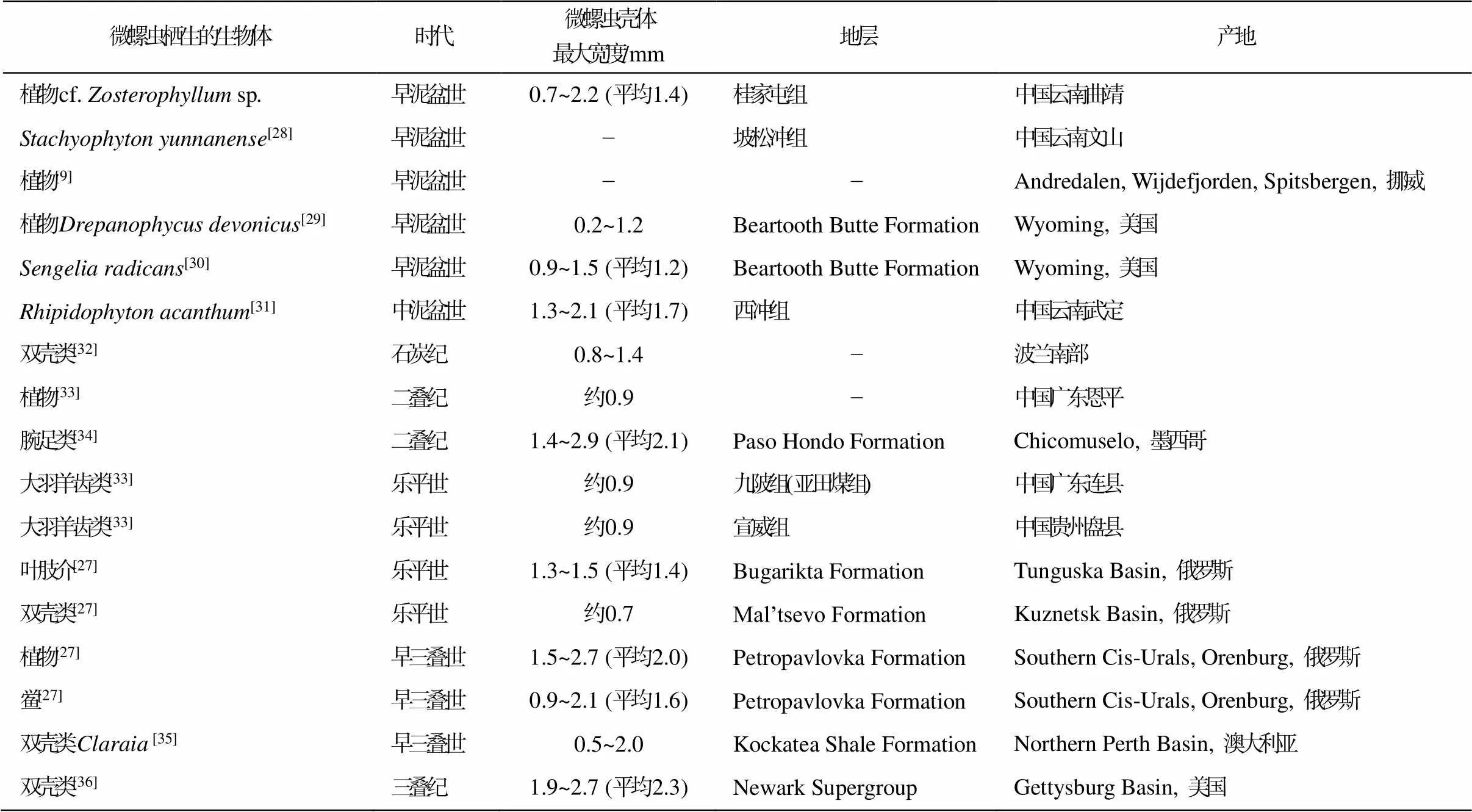
表2 栖生于其他生物体上微螺虫的代表性化石记录
3.2 对比与讨论
微螺虫是一种已绝灭的水生无脊椎动物, 具有盘绕的钙质管, 习惯固着在各种坚硬的生物体上(表 2), 包括双壳类[27,32,35‒36]、腕足类[34]和陆生植物等[9,27‒31,33], 其化石记录可追溯到晚奥陶世至中侏罗世末期[37‒41]。在 20 世纪的几十年中, 这类动物一直被当成盘旋虫()。后来, Weedon[42]通过对其壳壁、隔膜及虫管形态等的观察, 认为这类生物可能是末螺环呈展开状的腹足类, 将其解释为蠕虫状“腹足类”。但是, Weedon[43‒44]对其微观结构进行详细的观察和分析后, 发现这类生物在壳壁的超微结构、疹壳和假疹壳的结构以及隔膜的结构等方面与已灭绝的竹节石类有更近的亲缘关系, 而非多毛类或软体动物, 因此创建微螺虫目(Microcon-chida), 并将其划入竹节石纲。有些学者甚至认为微螺虫很可能是由另一种竹节石类动物——角环石(cornulitids)演化而来[38,41,45]。微螺虫与盘旋虫的主要区别是, 微螺虫壳壁的断面呈薄层状, 具疹壳或假疹壳, 虫管初始部分为灯泡状, 盘旋虫则不具有这些特征[42‒44,46‒47]。
cf.sp.茎轴上保存的微螺虫壳体最大宽度的范围为 0.7~2.2mm, 位于已知微螺虫尺寸范围内[40]。比较遗憾的是, 由于大多数微螺虫化石受成岩作用影响, 导致无法通过扫描电子显微镜观察管壁的超微结构以及虫管初始部分的灯泡状管等典型特征[40,43‒44,46]。这种情况是鉴定古生代微螺虫的难题[39], 所以无法对本文标本上的微螺虫进行属种划分。从一些标本具有与生长方向垂直的脊状纹饰(图 7 (c))来看, 本文描述的 cf.sp.茎轴上栖生的微螺虫很可能属于或。

(a) 微螺虫的复原图, 整体形态依据图7(a), 大小取其壳体的最大宽度, 软体触手依据触手冠类动物的触手[27]推测, 比例尺代表500 μm; (b) 微螺虫壳体最大宽度的频率分布; (c) 微螺虫壳体最大宽度与所附着处茎轴宽度的散点图(n = 31); (d) 微螺虫在不同宽度茎轴上的频率分布
4 古生态学意义
微螺虫是一种通常固着在硬质基体上的水生动物, 在咸水和淡水环境中都曾发现过[36], 其栖生在陆生植物的茎轴上的原因有两种: 一是该植物死亡后, 被淹没于水中, 由于植物腐烂较慢, 水中的微螺虫在此期间固着在植物茎轴上; 二是植物在生长期间曾被水淹没, 淹没时间可能较长, 随水流而来的微螺虫在此期间固着在植物茎轴上。
在桂家屯组 cf.sp.的茎轴上可以发现, 一定区域内微螺虫个体的大小存在差异(图 8(b)), 表明微螺虫是在活着时就栖生在植物茎轴上。如果是死亡后沉积到水底的植物表面, 则微螺虫会通过水流被搬运和分选, 在同一地点植物上保存的微螺虫大小应差异不大。通过定量统计, 发现不同大小的微螺虫没有各自统一的分布模式(图8(c)), 一旦有适合微螺虫寄栖的植物基体存在, 大小不同的微螺虫会同时固着在植物茎轴上面。植物根状茎的宽度范围为 1.7~4.2mm, 有 68%的微螺虫寄栖在此宽度范围内的植物直立轴上(图 8(c)), 而在目前采集到的标本中却未在植物的根状茎上发现微螺虫。比较合理的解释是, 早期植物的根状茎位于植物的基部, 处于地表以下或近地表的位置, 当植物被水淹没时, 植物的根状茎并没有暴露在水体中, 也就无法被微螺虫寄栖。据此推测 cf.sp.在生长期间曾一次或数次被水淹没, 届时水中的微螺虫附着在其茎轴上。
5 结论
本文描述云南曲靖下泥盆统桂家屯组的一种工蕨类植物新材料。由于标本数量有限, 孢子囊结构保存状况较差, 将其暂定为 cf.sp.。本文还报道桂家屯组 cf.sp上栖生的一种水生动物微螺虫。在陆生植物的茎轴上发现微螺虫, 推测植物在生长期间很可能被水淹没过。
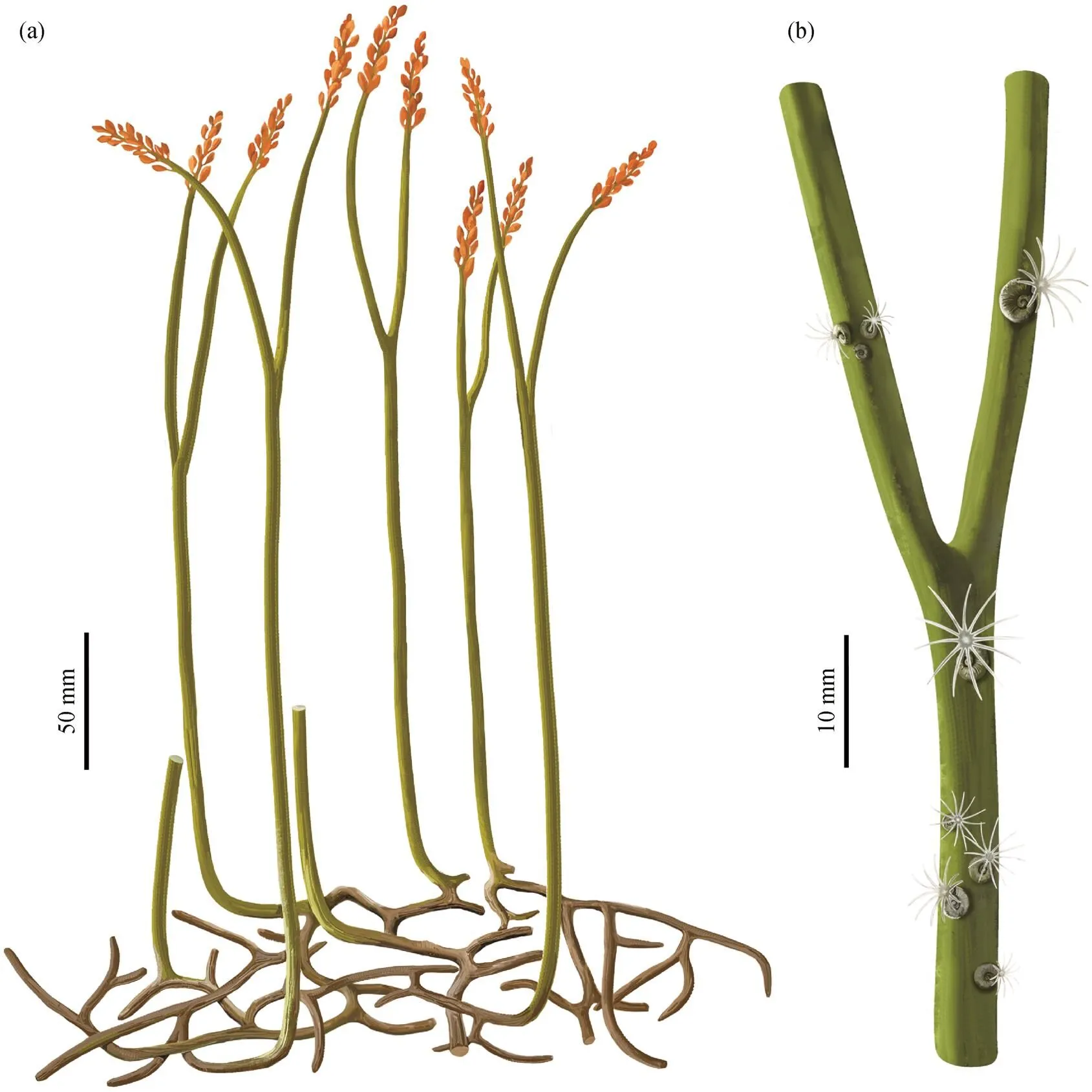
(a)为cf. Zosterophyllum sp.的整体复原图; (b)为(a)的局部放大图, 示意茎轴上栖生的微螺虫(触手部分依据文献[27])
本文报道的 cf.sp.与微螺虫的共生组合为探索早期维管植物、水生动物及其生活环境之间的关系提供了新的化石证据。但是, 目前对微螺虫的分类、生活环境和地理分布等方面的认识还较为有限, 关于微螺虫与植物之间的相互作用, 还有待更深入的研究。
致谢 感谢王德明教授、郝守刚教授和孙作玉副教授的有益意见。
[1] Hao S G, Xue J Z. The Early Devonian Posongchong Flora of Yunnan —a contribution to an understanding of the evolution and early diversification of vascular plants. Beijing: Science Press, 2013
[2] Xue J Z, Huang P, Wang D M, et al. Silurian-Devonian terrestrial revolution in South China: taxonomy, diver-sity, and character evolution of vascular plants in a pa-leogeographically isolated, low-latitude region. Earth-Science Reviews, 2018, 180: 92–125
[3] Wang D M, Hao S G. A new species of vascular plants from the Xujiachong Formation (Lower Devonian) of Yunnan Province, China. Review of Palaeobotany and Palynology, 2001, 114: 157–174
[4] Wang D M, Hao S G, Liu Z F. Researches on plants from the Lower Devonian Xujiachong Formation in the Qujing district, eastern Yunnan. Acta Geologica Sinica (English Edition), 2002, 76(4): 393–407
[5] Wang D M, Hao S G.gen. et sp. nov. from the Lower Devonian of Yunnan Province, China. Review of Palaeobotany and Palynology, 2002, 122: 13–27
[6] Wang D M, Hao S G, Wang Q.sp. nov. from the Xujiachong Formation (Lower Devonian) of eastern Yunnan, China. Botanical Journal of the Lin-nean Society, 2003, 142(3): 255–271
[7] Wang D M, Hao S G.gen. et sp. nov. , an Early Devonian plant from the Xujiachong Formation of Yunnan, China. International Journal of Plant Sciences, 2004, 165(2): 337–345
[8] 李星学, 蔡重阳. 中国西南地区早泥盆世工蕨化石——中国西南部早泥盆世植物群研究之一. 古生物学报, 1977, 16(1): 12–34
[9] Høeg O A. The Downtonian and Devonian flora of Spits-bergen. Olso: I komnnsjon hos Jacob Dybwad, 1942
[10] 李星学, 蔡重阳. 西南地区早泥盆世地层的一个标准剖面及其植物组合的划分与对比. 地质学报, 1978, 13(1): 1–14
[11] 高联达. 云南曲靖下泥盆统桂家屯组孢子和疑源类. 中国地质科学院地质研究所文集, 1984, 9: 125–136
[12] 朱敏, 王俊卿, 范俊航. 云南曲靖地区桂家屯组与徐家冲组早期脊椎动物化石及相关生物地层问题. 古脊椎动物学报, 1994, 32(1): 1–20
[13] Wang Y, Xu H H, Wang Y, et al. A further study ofLi and Cai (Zosterophyllopsida) based on the type and the new specimens from the Lower Devonian of Guangxi, southwestern China. Review of Palaeobotany and Palynology, 2018, 258: 112–122
[14] Penhallow D P. Additional notes on Devonian plants from Scotland. Canadian Record of Science, 1892, 5: 1–13
[15] Edwards D., a new name forfrom the Lower Devonian of Artois, northern France. Review of Palaeobotany and Palynology, 2006, 142: 93–101
[16] Lang W H. Contribution to the study of the Old Red Sandstone flora of Scotland. VI. OnPenh. and some other plant-remains from the Carmyllie Beds of the Lower Old Red Sand-stone. Transactions of the Royal Society of Edin-burgh, 1927, 57: 443–455
[17] Croft W N, Lang W H. The Lower Devonian flora of the Senni Beds of Monmouthshire and Breconshire. Philosophical Transactions of the Royal Society of London, 1942, 231: 131–163
[18] Hueber F M., its vegetative morpho-logy and classification with the Zosterophyllophytina. Review of Palaeobotany and Palynology, 1972, 14: 113–127
[19] Lang W H, Cookson I C. Some fossil plants of Early Devonian type from the Walhalla Series, Victoria, Australia. Philosophical Transactions of the Royal Society of London, 1930, 219B(2): 133–163
[20] Edwards D. Some observations on the fertile parts ofPenhallow from the Lower Old Red Sandstone of Scotland. Transactions of the Royal Society of Edinburgh, 1975, 69(11): 251–265
[21] Schweitzer H J. Die Zosterophyllaceae des Rheini-schen Unterdevons. Bonner Paläobotanische Mittei-lungen, 1979, 3: 1–32
[22] 郝守刚. 对云南工蕨的新认识. 植物学报, 1985, 27(5): 545–549
[23] Hao S G, Xue J Z, Guo D L, et al. Earliest rooting system and root: shoot ratio from a newplant. New Phytologist, 2010, 185: 217–225
[24] Hao S G, Xue J Z, Liu Z F, et al.Penhallow around the Silurian-Devonian boundary of northeastern Yunnan, China. International Journal of Plant Sciences, 2007, 168(4): 477–489
[25] 耿宝印. 先骕蕨——滇东南早泥盆世一个新属. 植物学报, 1985, 27(4): 419–426
[26] Xue J Z. Two zosterophyll plants from the Lower De-vonian (Lochkovian) Xitun Formation of northeastern Yunnan, China. Acta Geologica Sinica (English Edi-tion), 2009, 83(3): 504–512
[27] Shcherbakov D E, Vinn O, Zhuravlev A Y. Disaster microconchids from the uppermost Permian and Lo-wer Triassic lacustrine strata of the Cis-Urals and the Tunguska and Kuznetsk basins (Russia). Geological Magazine, 2021, 158(8): 1335–1357
[28] 耿宝印. 云南早泥盆世穗蕨(新属)的发现及意义. 植物学报, 1983, 25(6): 574–579
[29] Caruso J A, Tomescu A M F. Microconchid encrusters colonizing land plants: the earliest North American record from the Early Devonian of Wyoming, USA. Lethaia, 2012, 45(4): 490–494
[30] Matsunaga K K S, Tomescu A M F. An organismal concept forgen. et sp. nov. —morphology and natural history of an Early Devonian lycophyte. Annals of Botany, 2017, 119: 1097–1113
[31] 王怿, 朱祥根. 云南武定中泥盆世晚期植物与腹足动物共生标本的发现及其古生态意义. 古生物学报, 2020, 59(2): 192–197
[32] Zatoń M, Vinn O, Tomescu A. Invasion of freshwater and variable marginal marine habitats by microcon-chid tubeworms —an evolutionary perspective. Geo-bios, 2012, 45(6): 603–610
[33] 姚兆奇. 大羽羊齿植物的生态和埋葬学. 中国科学院南京地质古生物研究所丛刊, 1983(6): 62–84
[34] Heredia-Jiménez D P, Vinn O, Buitron B, et al. A new middle Permian microconchid from Chiapas, Mexico, and its palaeoecological implications. Palaeobiodiver-sity and Palaeoenvironments, 2020, 100(6): 975–983
[35] Yang H, Chen Z Q, Mei X, et al. Early Triassic microconchids from the Perth Basin, Western Aus-tralia: palaeoecology and flourishing in the aftermath of the end-Permian mass extinction. Geological Jour-nal, 2021, 56: 6210–6222
[36] Gierlowski-Kordesch E H, Cassle C F. The ‘’ problem revisited: sedimentology and biology of mic-roconchids in marine-nonmarine transitions. Earth-Science Reviews, 2015, 148: 209–227
[37] Zatoń M, Krawczyński W. Microconchid tubeworms across the upper Frasnian–lower Famennian interval in the Central Devonian Field, Russia. Palaeontology, 2011, 54(6): 1455–1473
[38] Vinn O. Adaptive strategies in the evolution of en-crusting tentaculitoid tubeworms. Palaeogeography Palaeoclimatology Palaeoecology, 2010, 292(1/2): 211– 221
[39] Zatoń M, Krawczyński W. New Devonian Microcon-chids (Tentaculita) from the Holy Cross Mountains, Poland. Journal of Paleontology, 2011, 85(4): 757–769
[40] Taylor P D, Vinn O. Convergent morphology in small spiral worm tubes (‘’) and its palaeoenviron-mental implications. Journal of the Geological Society, 2006, 163: 225–228
[41] Vinn O, Mutvei H. Calcareous tubeworms of the Pha-nerozoic. Estonian Journal of Earth Sciences, 2009, 58(4): 286–296
[42] Weedon M J. Shell structure and affinity of vermi-form ‘gastropods’. Lethaia, 1990, 23: 297–309
[43] Weedon M J. Microstructure and affinity of the enig-matic Devonian tubular fossils. Lethaia, 1991, 24: 223–234
[44] Weedon M J. Tube microstructure of recent and Ju-rassic serpulid polychaetes and the question of the Pa-laeozoic spirorbids. Acta Palaeontologica Polonica, 1994, 39(1): 1–15
[45] Taylor P D, Vinn O, Wilson M A. Evolution of bio-mineralization in lophophorates. Palaeontology, 2010, 84(84): 317–333
[46] Vinn O, Taylor P D. Microconchid tubeworms from the Jurassic of England and France. Acta Palaeonto-logica Polonica, 2007, 52(2): 391–399
[47] Vinn O. Two new microconchid (Tentaculita Bouček, 1964) genera from the Early Palaeozoic of Baltos-candia and England. Neues Jahrbuch fur Geologie und Palaontologie Monatshefte, 2006, 2: 89–100
A New Zosterophyllopsid Plant with Encrusted Microconchids from Lower Devonian Guijiatun Formation of Qujing, Yunnan Province
YANG Shuai1, HUANG Pu2,†, LIU Lu3, WANG Jiashu1, ZHANG Jiudong4, XUE Jinzhuang1
1. The Key Laboratory of Orogenic Belts and Crustal Evolution (MOE), School of Earth and Space Sciences, Peking University, Beijing 100871; 2. Nanjing Institute of Geology and Palaeontology, Nanjing 210008; 3. Beijing Museum of Natural History, Beijing 100050; 4. School of Resources and Civil Engineering, Suzhou University, Suzhou 234000; † Corresponding author, E-mail: puhuang@nigpas.ac.cn
A new early vascular plant is described from the Guijiatun Formation of the Guogaishan section, Qujing, Yunnan. This plant shows smooth axes; the rhizomes are characterized by multiple K- or H-shaped branchings, forming a complex branching system; the erect axes are dichotomously branched; and the sporangia are helically arranged, spoon to ovoid shaped in lateral view. The plant is small in size, with better-preserved rhizomes, while the spikes are in poor preservation and the dehiscence line of the sporangia is invisible, and thus it is tentatively designated as cf.sp. Nevertheless, the character combination of this plant is different from typical species ofand other related taxa, enriching the knowledge about the morphological variations of early vascular plants and about the floral assemblages from the Guijiatun Formation. Abundant microconchids, with a diameter of ca. 0.7~2.2 mm, occur on erect axes of the plant. Microconchids are a type of extinct aquatic invertebrates, spanning from the Late Ordovician to late Middle Jurassic, and they show a spiral-shaped calcareous shell and have been found to habitually colonize on various hard substrates including plants. Our finding that microconchids settled on erect axes of cf.sp. indicates that this plant was submerged by water during its growth period, and afterwards, the microconchids and their occupied plant axes were transported and then buried.
early vascular plants; zosterophyllopsids; microconchids; Guijiatun Formation; Lower Devonian
10.13209/j.0479-8023.2022.058
2021-10-07;
2021-11-22
国家自然科学基金(41722201, 41802003)资助
