绿茶多糖提取工艺优化及其抗氧化活性分析
2022-10-11张轶斌纪海玉贾晓昱凌4
张轶斌,刘 鹏,纪海玉,贾晓昱,田 凌4,
(1.天津现代职业技术学院生物工程学院,天津 300451;2.天津科技大学食品工程与生物技术学院,天津 300457;3.天津市农业科学院,农产品保鲜与加工技术研究所,天津 300384;4.唐山市盛川农产品股份有限公司,河北唐山 064105)
我国是绿茶生产大国,2020 年产量达184 万吨,占全国茶产量的60%。茶因其优良的抗氧化、抗癌、抗炎、免疫调节和降糖功效等健康促进作用而越来越受欢迎。茶多糖因其优异的生物活性而备受关注。早期研究表明,茶多糖具有降低血糖和胆固醇水平、调节免疫、提高抗氧化能力、抗疲劳能力、调节肠道微生物等作用。近年来,植物多糖的提取受到越来越多的关注,水提法、超声提取法、酶提取法、有机溶剂提取、微波等。其中热水浸提法技术成熟,成本低,安全性较高且无污染,而超声提取可能改变多糖的分子量,酶解提取对设备的pH 和温度控制要求较高,微波提取设备存在辐射风险等。多糖的结构决定其生物活性,其生物活性受不同提取工艺的影响。热水浸提法中提取的液料比、温度、时间和次数等关键参数均是影响多糖产率的重要因素。不同产地的绿茶的抗氧化活性也不同,如免疫调节、抗疲劳、抗氧化、降血糖等。
氧化代谢过程中不断产生活性氧(ROS),包括超氧化物、氧离子和氧自由基。ROS 在机体细胞中均可产生,并可参与多种生化过程。然而,ROS 在不受控制的情况下会积累并诱发多种身体疾病,过量的ROS 可通过酶(相关酶)和非酶抗氧化(非酶化合物)系统消除。目前已开发出多种抗氧化剂,如多酚、黄酮、多糖等,以清除自由基,减少体内氧化损伤。茶多糖的抗氧化等生物活性与多糖分子量大小、糖醛酸含量、单糖比例和化学成分有关,另外,茶多糖与无机元素和蛋白质结合可增强其生物活性,低分子量多糖因可以较容易的进出细胞而表现出较好的抗氧化活性。因此,研究茶多糖的结构和抗氧化活性,对于进一步从天然资源中开发新型抗氧化剂是十分必要的。
目前,绿茶醇溶多糖的提取技术尚不成熟,结构、功能和生物活性有待进一步明确,本文优化水提法工艺,结合光谱技术表征茶多糖的结构和抗氧化活性,为绿茶行业新产品研制,行业标准化发展提供依据。
1 材料与方法
1.1 材料与仪器
绿茶 日照2020 年新茶,采购自天津市正兴德茶叶有限公司;抗氧化活性检测试剂盒、DPPH(1,1-diphenyl-2-picrylhydrazyl)、ABTS(2,2-azinobis-(3-ethylbenzthiazoline-6–sulfonate)、OH 自由基 南京建成生物工程研究所;无水乙醇 天津市江天化工技术有限公司;葡萄糖标准品、单糖标准品 北京索莱宝科技有限公司;其他试剂 均为分析纯。
SHZ-D 循环水真空泵 上海保玲仪器有限公司;HH-W600 电热恒温水浴锅 上海岛韩实业有限公司;Instron3369 万能材料试验机 美国英斯特朗公司;721G-100 紫外分光光度计 上海仪电分析仪器有限公司;VECTOR-22 傅里叶变换红外光谱仪Bruker;1200 高效液相色谱仪 安捷伦科技(中国)有限公司;TSK-gel G4000PWxL 液相色谱柱(7.8 mm×300 mm)、GC-2010 Pro 气相色谱仪、HP-5 气相色谱柱 日本岛津公司。
1.2 实验方法
1.2.1 绿茶粗多糖的提取工艺 绿茶原料筛选→清洗→打浆→热水浸提→离心→浓缩→澄清→离心→80%乙醇处理→离心→上清液→浓缩→透析→粗多糖。
操作要点:将绿茶干燥至恒重,粉碎成粗粉,得到均匀的粉样。每个预处理样品(5.0 g)用蒸馏水在指定的液料比、提取温度、提取时间和次数下提取。提取后,用60 ℃真空旋转蒸发器浓缩上清,4 ℃下加入80%乙醇过夜沉淀,去除沉淀,去除乙醇收集上清。最后将溶液透析(截留分子量,600 Da),并冻干得到绿茶粗多糖(GTP)。
GTP 的得率(%)计算如下:
GTP 得率(%)=GTP 重量(g)∕预处理粉末重量(g)×100
1.2.2 单因素实验 采用单因素实验设计,考察了液料比、提取温度、提取时间和提取次数对GTP 得率的影响。对每个单一因素进行优化,每个实验重复3 次,实验设计如表1。
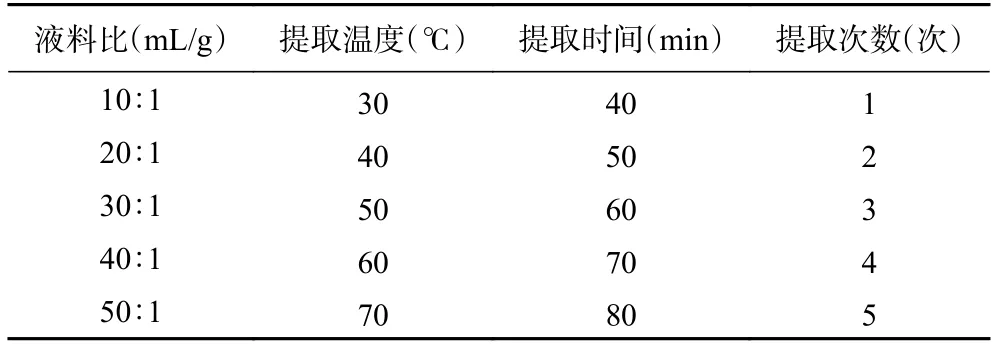
表1 单因素水平设计Table 1 Single factor level
1.2.3 响应面试验 基于单因素实验,采用3 个因素、3 个水平进行提取优化实验,即液料比、提取温度、提取时间,响应值选择多糖得率。各因子水平的范围以初步实验结果为依据,因素与水平设计见表2。
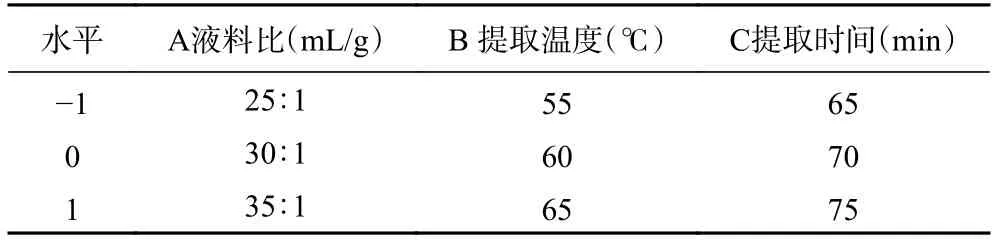
表2 响应面试验因素水平设计Table 2 Factors and levels of response surface test
1.2.4 多糖的结构鉴定
1.2.4.1 多糖化学组成测定 以葡萄糖为标准品,用苯酚-硫酸法测定绿茶醇溶多糖中的总糖含量(y=0.9948x+0.0018,=0.9997);以牛血清白蛋白为标准品,用考马斯亮蓝法定量测定多糖中蛋白质含量(y=1.0598x-0.0048,=0.9998)。以葡萄糖醛酸为标准品,用咔唑-硫酸法测定糖醛酸含量(y=1.2543x-0.0092,=0.9984)。
1.2.4.2 平均分子量测定 采用高效液相色谱仪对多糖的平均分子量分布情况进行检测。以葡聚糖T-1(1×10Da)、T-3(3×10Da)、T-10(1×10Da)、T-40(4×10Da)、T-70(7×10Da)、T-110(1.1×10Da)为分子量标准品,以超纯水为溶剂,将各个样品和标准品配制成1.5 mg/mL 的溶液备用。采用配备液相色谱柱的高效液相色谱仪对本文中的样品和标准品分子量进行分析,其具体参数及设备配置如下:流动相为超纯水,检测器为示差检测器,检测器温度为35 ℃,上样量为20 μL,柱温为30 ℃,洗脱流速为0.8 mL/min。最后以标准品的分子量对数值(lg M)为纵坐标,出峰时间R为横坐标,建立相应的标准曲线,然后将多糖的出峰时间代入标曲内,得出其平均分子量的数值。
1.2.4.3 单糖组成分析 采用气相色谱仪对本文中纯化所得的绿茶醇溶多糖的单糖组成进行分析。将冻干后的GTP 用2 mL 三氟乙酸(TFA)(2 mol/L)在密闭的试管中以110 ℃油浴水解4 h,去除多余的TFA 后,将水解产物乙酰化进行GC 分析。以六乙酸肌醇为内标物(Inositol),D-葡萄糖(D-Glc)、L-鼠李糖(L-Rha)、D-半乳糖(D-Gal)、D-甘露糖(DMan)、D-阿拉伯糖(D-Ara)和D-木糖(D-Xyl)的衍生物为标准品。
1.2.4.4 主要官能团检测 绿茶醇溶多糖的官能团性质由傅里叶变换红外光谱仪在红外区间4000~400 cm测得。称取0.7 mg 的多糖样品和150 mg的溴化钾粉末,快速混合后研磨成细粒度很高的粉末,并压制成KBr 压片上机进行红外光谱分析。
1.2.5 绿茶多糖的抗氧化活性测定
1.2.5.1 ABTS自由基清除能力 根据查学强等的方法并做了一定修改,称取0.0384 g ABTS,过硫酸钾0.0134 g,蒸馏水定容至20 mL,避光室温过夜得ABTS 母液。以1:40 加入蒸馏水,在室温,=734 nm条件下,将吸光值调节在0.7 备用。称取粗多糖配制成2.5 mg/mL 溶液,再依次稀释为0.5、1.0、1.5、2.0 mg/mL。测定过程准备多糖溶液0.2 mL,ABTS稀释液3.0 mL,避光反应10 min,测定其在734 nm吸光值。对照组使用蒸馏水,选用V溶液为阳性比对液。

式中:A多糖溶液的吸光值;A表示对照组吸光值;A表示蒸馏水代替ABTS 吸光值。
1.2.5.2 DPPH 自由基清除率 根据孙玉姣等的方法。称取粗多糖配制成2.5 mg/mL 溶液,再依次稀释为0.5、1.0、1.5、2.0 mg/mL,随后再分别放进0.004% DPPH 配制的甲醇溶液3 mL,摇匀,遮光搁置20 min,选用甲醇液为空白比对液,在517 nm 处检测吸光度值,选用蒸馏水为阴性比对液,选用V溶液为阳性比对液。
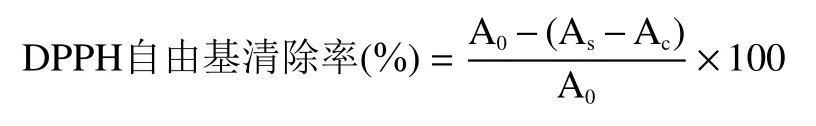
式中:A蒸馏水代替待测液加入DPPH 溶液的吸光值;A待测液加入DPPH 溶液的吸光值;A待测液不加入DPPH 溶液的吸光值。
1.2.5.3 羟基自由基(OH·)清除率 根据Tao 等的方法,称取多糖粗样品和精制样品液1 mL,加入1.5 mL 反应液(含0.1 mmol/L 的EDTA、0.1 mmol/L FeCl和2.8 mmol/L DR 的磷酸盐缓冲液(pH7.4)和0.35 mL HO(20 mmol/L),在37 ℃水浴下反应40 min 后停止,在532 nm 处检测吸光度值,选用蒸馏水为阴性对比值,V为阳性对比。抑制率(%)=(1-A/A)×100(式中:A为样品吸光度;A为蒸馏水吸光度)。
1.3 数据处理
响应面设计软件采用Design Expert 11,作图软件采用Origin 2017,显著性分析采用SPSS 26.0,不同处理间差异显著用<0.05 表示。
2 结果与分析
2.1 单因素实验结果
2.1.1 液料比对多糖得率的影响 对提高GTP 得率的4 个关键参数进行了优化研究。如图1A 所示,随着液料比从10:1 增大到30:1 mL/g,GTP 的得率提高,超过30:1 时,得率开始降低。推测较大的液料比有利于目标组分的浸出,从而提高萃取得率。但过量的萃取溶剂会造成多糖的损失和溶剂的浪费。因此,选择30:1 mL/g 的液料比进行进一步研究。
2.1.2 提取温度对多糖得率的影响 提取温度是影响多糖得率的重要因素之一。因此,在30~70 ℃条件下,液料比为30:1 mL/g,提取时间为3 h,提取次数为2,考察提取温度对GTP 得率的影响。图1B表示从30 到60 ℃,随着萃取温度的升高,GTP 的得率迅速上升,而超过60 ℃,GTP 得率开始下降。相关研究已经证明高萃取温度可以提高多糖的溶解度和提高水溶性多糖,而高温可能导致的氧化和热降解多糖。因此,后续实验认为提取温度为60 ℃为最佳。
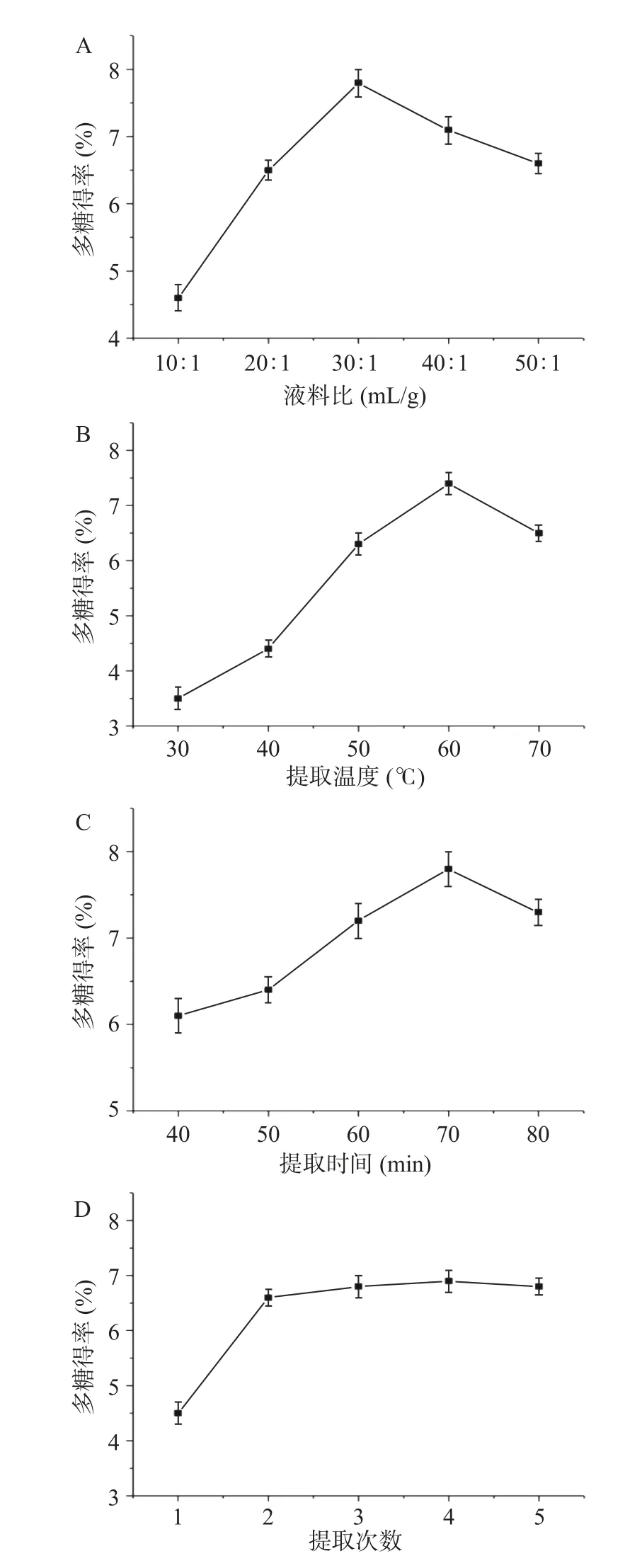
图1 单因素实验结果Fig.1 Single factor experimental results
2.1.3 提取时间对多糖得率的影响 提取时间是影响多糖提取率的另一个因素。从图1C 中可以看出,GTP 的得率在70 min 达到峰值,然后随着提取时间的延长而降低。推测提取时间过长会导致多糖的水解,从而降低多糖的得率。因此,选择70 min 作为GTP 后续优化的最佳提取时间。为考察提取次数对GTP 得率的影响,试验1~5 次不同的提取次数,从图1D 可以看出,随着提取次数增加到2 次,GTP 得率急剧上升,然后逐渐平稳。考虑萃取率和损失考虑到提取频率为2 次。
2.2 响应面试验优化结果
由单因素实验,确定了液料比、提取温度和提取时间为响应面因素,响应面优化试验设计如表3所示。
由表3 和表4 可知,响应面试验结果最佳工艺参数为:液料比30:1 mL/g,提取温度60 ℃,提取时间70 min。应用响应曲软件对数据进行拟合分析(采用编码数据),可以获得多元二次回归方程模型。

表3 响应面试验优化提取工艺结果Table 3 Extraction process results optimized by response surface

表4 响应曲面优化方差分析Table 4 Analysis of variance for response surface optimization

从方差分析表中可以看出,响应面回归模型极显著(<0.01);回归模型决定系数为0.9696,反映该线性回归模型能在96.96%程度上解释反应变量Y 的变异性。由显著性水平检验可知,B、AB、A²、B²、C²项对响应值影响极显著(<0.01),A、C 项对响应值影响显著(<0.05),AC、BC项对响应值影响不显著,表明实验因素对综合得分的影响不是简单线性关系。实验因素交互作用对综合得分影响的3D 曲面图和等高线图如图2。各因素之间的交互作用与响应面曲线的陡峭程度有关,陡峭度越大,越显著,通过陡峭程度分析发现,提取温度对多糖得率影响最显著,其次是液料比和提取时间,而且液料比和提取温度的交互作用显著。

图2 因素交互作用影响的3D 响应曲面图和等高线图Fig.2 3D response surface diagrams and contour diagrams of factors interaction
2.3 验证结果
通过响应面软件对数据进行进一步的拟合分析,得出最佳提取条件为液料比30.48:1 mL/g、提取温度61.29 ℃、提取时间71.21 min,此时,多糖得率达到10.61%。经实验验证,设定液料比30:1 mL/g、提取温度60 ℃、提取时间70 min,结果显示该条件下绿茶得率为10.56%±0.18%,与理论值接近,说明模型拟合度良好,可靠性强。
2.4 绿茶多糖(GTP)的理化特性
纯化后,GTP 中总糖、蛋白质和糖醛酸的比例分别为90.75%±3.69%、0.92%±0.09%和0.82%±0.07%,表明其是几乎不含蛋白质和糖醛酸的中性多糖。图3 显示GTP 的HPGPC 结果表明,根据标准曲线(y=8.6977-0.385x,=0.9932)(y 表示分子量的自然对数,而x 表示相应的保留时间),GTP 的平均分子量约为7.3 kDa。图4 通过GC 分析确定GTP 主要由葡萄糖和半乳糖组成,摩尔比为1.00:0.13。
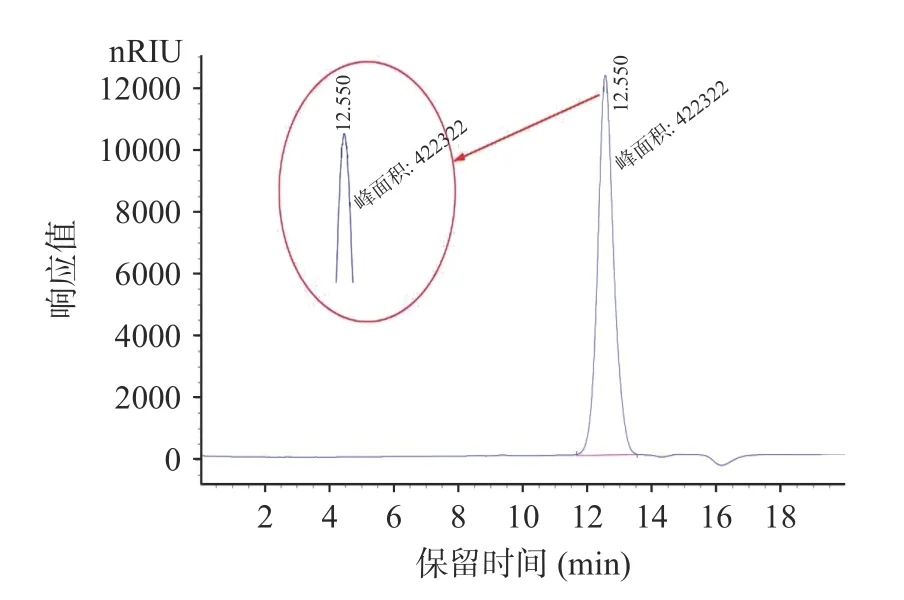
图3 HPGPC 光谱分析结果Fig.3 HPGPC spectrum of GTP
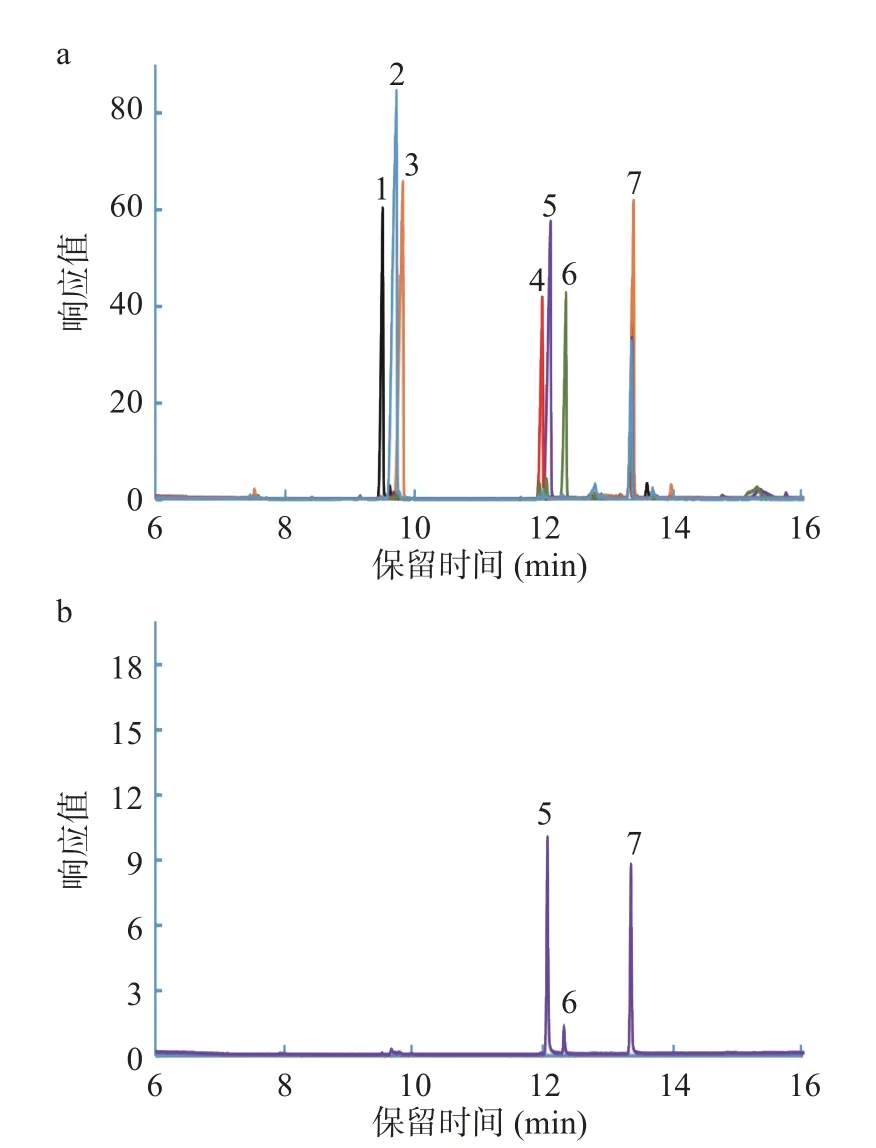
图4 单糖标准品(a)和GTP 单糖组成(b)检测结果Fig.4 Test results of standard monosaccharides (a) and monosaccharide compositions of GTP (b)
2.5 绿茶多糖(GTP)的红外光谱结果分析
由图5 可知,绿茶多糖在3423.63、2918.78、1624.97、1431.66、1256.63、1080.02、533.89 cm等处均有吸收峰。其中,3423.63 cm处的谱峰代表O-H 基团的伸缩振动,2918.78 cm代表C-H 伸缩振动和弯曲振动,1431.66 和1256.63 cm(C-H弯曲振动)等多处强吸收峰代表了多糖的特征峰。1624.97 cm的吸收峰表示结合水的存在,在1200~1000 cm范围内的峰为多糖中C-O-H 侧基和C-O-C 糖苷键的特征。533.89 cm表明含有吡喃环,红外光谱结果印证了上述数据。
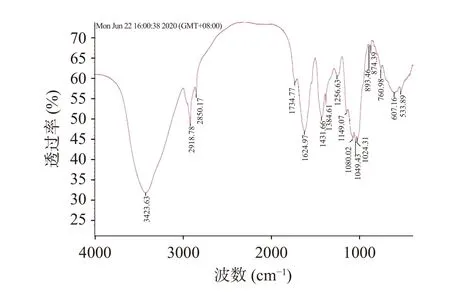
图5 绿茶多糖主要官能团检测结果Fig.5 Main functional groups detection results of GTP
由此可见,本文中从绿茶醇溶上清中分离得到的多糖GTP 是一种低分子量的含吡喃糖环的中性多糖,主要由葡萄糖和半乳糖组成。据报道,多糖的分子量会显著影响其溶解度和生物活性,随着乙醇浓度的增加,高分子量的多糖更难溶解。与高分子量的多糖相比,低分子量的多糖具有较高的溶解性和渗透性,因此更易表现出较强的生物活性。此外,目前关于绿茶多糖的提取普遍采用的水溶醇沉法,而上清液多被舍弃,造成能源和资源的浪费。因此本文从绿茶水提醇沉后的上清液中分离得到一种低分子量的多糖,进而初步研究其抗氧化活性,为其后续的研究和实际应用提供理论和数据基础。
2.6 绿茶多糖的抗氧化活性分析
2.6.1 绿茶多糖对ABTS自由基清除能力 ABTS法常用于测定样品的总抗氧化能力,随着浓度的增大,多糖的ABTS自由基的清除能力逐渐增加,2.0和2.5 mg/mL GTP 对ABTS自由基的清除率分别为39.8%和42.5%,图6 显示,此时以V为阳性对照的ABTS自由基清除分别为71.4%和81.2%,表面绿茶多糖具有一定的清除ABTS自由基能力,具有较好的体外抗氧化活性,但低于V。
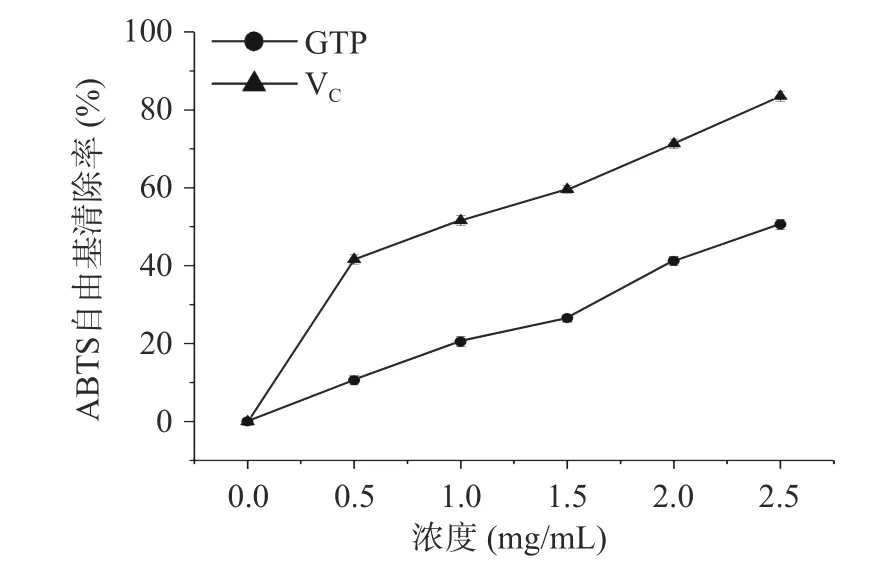
图6 绿茶多糖的清除ABTS+自由基能力Fig.6 Scavenging ability of GTP on ABTS+ free radical
2.6.2 绿茶多糖对DPPH 自由基的清除能力 DPPH是一个稳定的基团,广泛用于评价抗氧化剂对自由基的清除活性,能够较好的反映溶液的抗氧化活性。在DPPH 测定中,抗氧化剂清除DPPH 自由基的作用归因于它们的供氢能力,图7 为绿茶多糖对DPPH自由基的清除活性,随着多糖浓度的增加,DPPH 自由基清除率逐渐增强,当多糖浓度提高到2.0 mg/L时,其清除率高达72.2%,而阳性对照V为85.1%,说明绿茶多糖具有较好的清除DPPH 自由基能力。
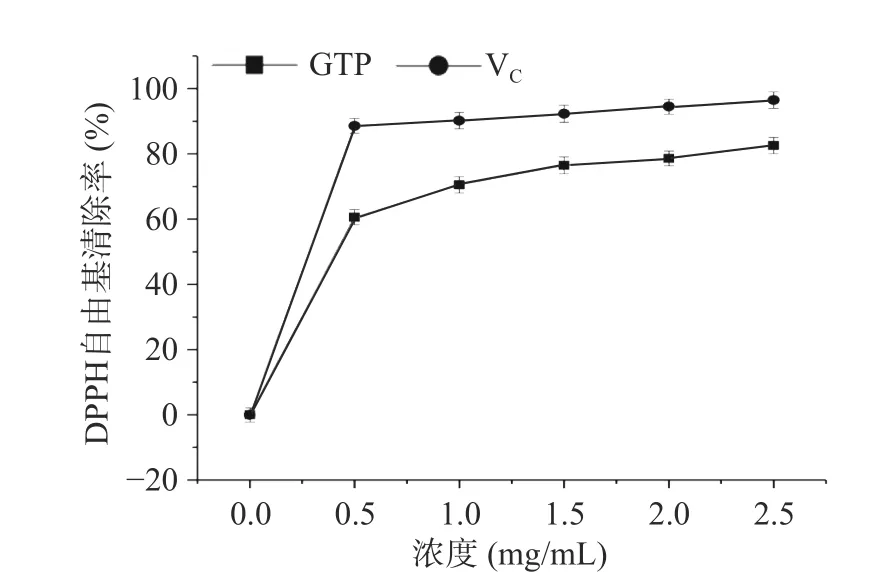
图7 绿茶多糖的清除DPPH 自由基能力Fig.7 Scavenging ability of GTP on DPPH free radical
2.6.3 绿茶多糖对羟基自由基(OH·)的清除能力OH·是生物体内最具活性的自由基,几乎所有类型的大分子,包括蛋白质、脂质、碳水化合物和核酸,都可能被羟基自由基破坏,从而导致生物体老化。对比分析了醇沉和壳聚糖澄清两种工艺条件对清除羟自由基能力的差异,如图8,在0.5~2.5 mg/L 范围内均具有较好的羟基自由基清除能力,当多糖浓度为2.0 mg/L 时,其对羟基自由基的清除能力已达到32.5%。当多糖浓度为2.5 mg/L 时,其对羟基自由基的清除能力达39.2%。
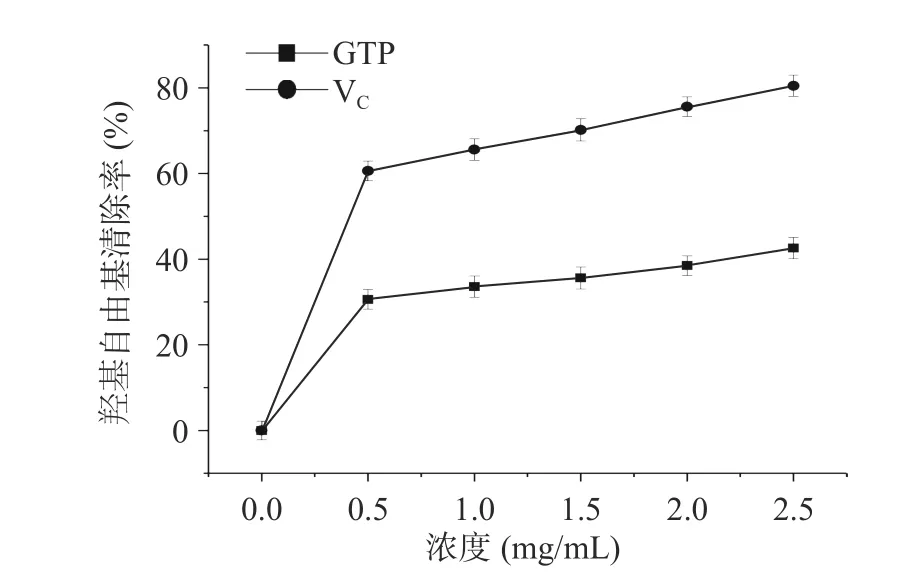
图8 绿茶多糖的清除羟基自由基能力Fig.8 Scavenging ability of GTP on OH free radical
3 结论
本研究通过单因素实验和响应面优化了绿茶多糖的提取工艺,并对其初步结构特性和体外抗氧化活性进行研究。结果表明绿茶多糖的最佳工艺条件为:液料比30:1 mL/g,提取温度60 ℃,提取时间70 min,在此条件下,实验得到的GTP 产率为10.56%。多糖结构和抗氧化分析结果表明,GTP 中总糖、蛋白质和糖醛酸的比例分别为90.75%±3.69%、0.92%±0.09%和0.82%±0.07%,分子量约为7.3 kDa,主要由葡萄糖和半乳糖组成(摩尔比1.00:0.13),且在2 mg/mL浓度下其对ABTS自由基、DPPH 自由基和羟基自由基(OH·)清除率分别为39.8%、72.2%和32.5%。本研究所得绿茶多糖得率高,分子量低,且具有较高的抗氧化活性,为其在抗氧化功能性食品工业中的实际应用提供了一定的理论基础。
