Cu-Fe/AC催化剂连续CWPO法处理苯酚废水
2022-10-09许洪祝李长波赵国峥杨佳潼
许洪祝,李长波,赵国峥,王 硕,梁 慧,杨佳潼
(辽宁石油化工大学 环境与安全工程学院,辽宁 抚顺 113001)
含酚废水是典型的有毒、难降解工业废水,主要来自于炼油化工、印染、制药等行业[1]。常规的处理方法如:生物法、吸附法和芬顿氧化法均不能实现酚类物质的彻底降解。催化湿式过氧化氢氧化(CWPO)技术是一种高效处理难降解有毒有害废水的新技术,具有反应条件温和、对污染物降解彻底、经济环保等优点[2-3]。目前,关于催化湿式过氧化氢处理废水的研究集中在考察不同因素对处理效果的影响上。如:XIE等[4]考察了不同因素对CeCu固溶体催化湿式过氧化氢处理苯酚废水的影响;徐增益等[5]以Zn-Co/ZSM-5为催化剂,开展了不同条件下催化湿式过氧化氢处理精细化工废水的实验等。但是,单因素分析方法不能考察各因素之间的相互作用,需要采用新的方法综合考察多因素对处理效果的影响。
本研究以活性炭(AC)为载体,采用微波辅助合成法制备了负载型Cu-Fe/AC催化剂,表征了其形貌特征,在连续反应条件下考察了该催化剂催化湿式过氧化氢氧化处理苯酚废水的效果,应用响应面法(RSM)分析了反应温度、反应时间、初始pH和H2O2加入量等因素之间的协同作用和拮抗作用,以期为连续式催化湿式过氧化氢体系处理实际废水提供理论支持。
1 实验部分
1.1 试剂、材料和仪器
Cu(NO3)2·3H2O、Fe(NO3)3、三嵌段聚合物F127、乙醇 、过氧化氢(w=30%)、浓硝酸、氨水、苯酚(纯度99.9%):均为分析纯;粉末活性炭:粒径2~3 nm;实验用水为去离子水。
模拟苯酚废水:苯酚质量浓度为100 mg/L,制备后避光保存。经测定,该模拟废水pH为 6~8,COD为 238 mg/L,ρ(NH4+-N)为7.86 mg/L,ρ(TN)为10.73 mg/L。
MDS-10型高通量微波消解仪:上海新仪微波化学科技有限公司;UV 6000型智能消解仪:上海元析仪器有限公司;D8 Advance型X射线衍射仪:德国Bruker公司; HL1800-MP型物理吸附仪:北京海鑫瑞科技有限公司;721型分光光度仪:上海菁华有限公司。
1.2 实验方法
1.2.1 催化剂制备
将2.4 g Cu(NO3)2·3H2O和8.0 g Fe(NO3)3溶于200 mL去离子水中,加入50 g粉末状AC,充分搅拌1 h,备用;在混合液中加入1 g三嵌段聚合物F127和50 mL乙醇,用NaOH溶液调节pH至9~10;用磁力搅拌器将混合液搅拌1 h后,放入高通量微波消解仪中消解120 min;将混合溶液过滤,滤渣用去离子水洗涤至中性,然后置于干燥箱中,在100 ℃条件下活化3 h,再置于马弗炉中,500 ℃煅烧3 h,冷却后获得粉末型Cu-Fe/AC催化剂;将粉末型Cu-Fe/AC催化剂加入粉末压粒机中制备成颗粒型催化剂。
1.2.2 模拟废水的CWPO处理实验
模拟废水的CWPO处理实验在连续反应器中进行。工艺流程见图1。在储水罐中加入一定量的模拟苯酚废水,加入0.4~4.0 g/L(以废水计)的H2O2,用浓硝酸或氨水调节废水初始pH为1~10;用精密流量泵将调节后的废水泵入预热器,经加热后进入反应器;反应完成后,出水经冷凝器冷却,气液分离器分离,进入出水罐。Cu-Fe/AC催化剂装填在反应器的中部,并用石英棉固定。连续使用后的催化剂经收集洗涤后,烘干备用。
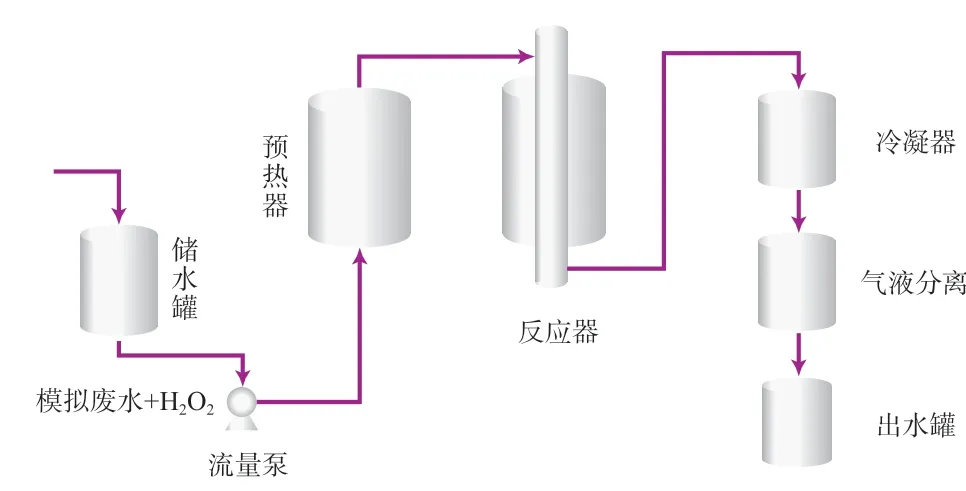
图1 模拟废水的连续CWPO法处理工艺流程
模拟废水在反应器中的反应温度为40~120 ℃,反应停留时间为30~120 min。反应器中Cu-Fe/AC催化剂的填充量为1 g/L(以废水计)。
1.2.3 影响因素分析
选择反应温度、反应停留时间、模拟废水初始pH和H2O2加入量为COD去除率的4个影响因素,按照中心组合设计法(CCD)设计一个4因素的实验方案,见表1。对每个变量进行分析,进而寻找最优点附近的响应面区域。
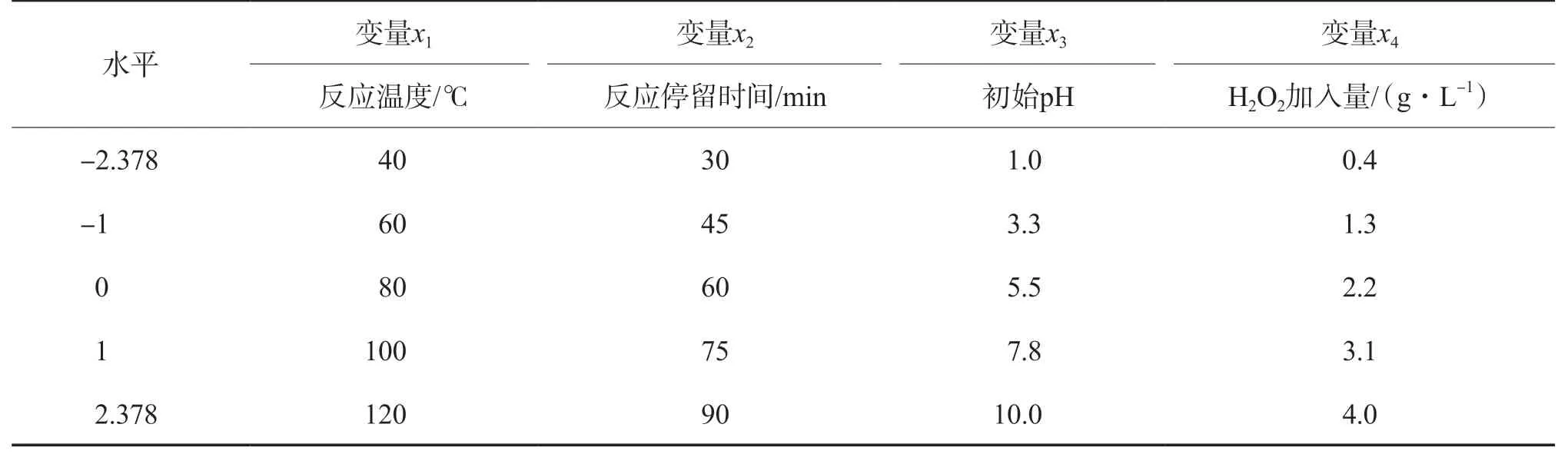
表1 4因素实验方案
采用Design-Expert软件对实验结果进行模拟,建立二阶多项式方程拟合模型。因变量和自变量之间的相互作用见式(1)。
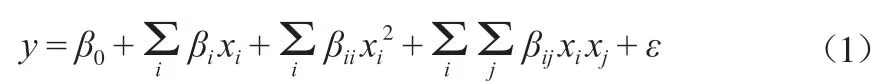
式中:y为因变量;xi为自变量;β0为常数;βi、βii、βij分别为线性系数、二次系数和相互作用系数;ε为随机误差。
1.3 分析与表征
采用快速消解分光光度法测定COD[6]。采用BET方程计算Cu-Fe/AC催化剂的比表面积。采用XRD表征Cu-Fe/AC催化剂的形貌特征。
2 结果与讨论
2.1 催化剂的表征
2.1.1 XRD
图2为Cu-Fe/AC催化剂的XRD谱图。由图2可见:在衍射角2θ为18.3°,30.1°,35.5°,43.1°,57.0°,62.6°,74.0°处出现特征衍射峰,分别归属于金属材料(JCPDS 76-2294)的111,220,311,400,511,440,533晶面[7];未检测到其他杂峰出现,表明晶体纯度较高;也未出现对应于晶体态CuO的衍射峰,表明Cu和Fe以高度分散的状态分布在催化剂表面。
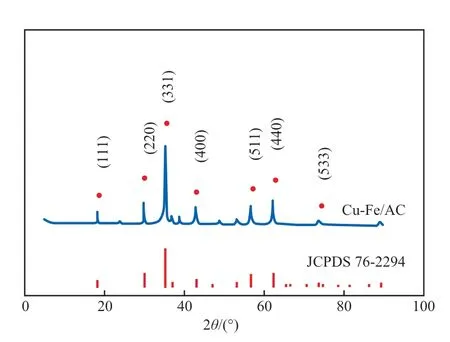
图2 Cu-Fe/AC催化剂的XRD谱图
2.1.2 N2吸附-脱附等温线
图3为Cu-Fe/AC催化剂的N2吸附-脱附等温线。由图3可见,Cu-Fe/AC催化剂的N2吸附-脱附等温线属于Ⅳ型等温线,在相对压力为0.5~0.7之间出现明显的滞后环,为典型的笼状结构,表明双金属材料成功负载到AC上。根据BET方程计算出Cu-Fe/AC催化剂的比表面积为64.3 m2/g。此外,计算得到Cu-Fe/AC催化剂的平均孔径为16.28 nm,孔体积为0.057 1 cm3/g,表明该催化剂具备均一的孔径和充足的比表面积,有利于活性组分在其表面的分布,且保持着较高的分散度。
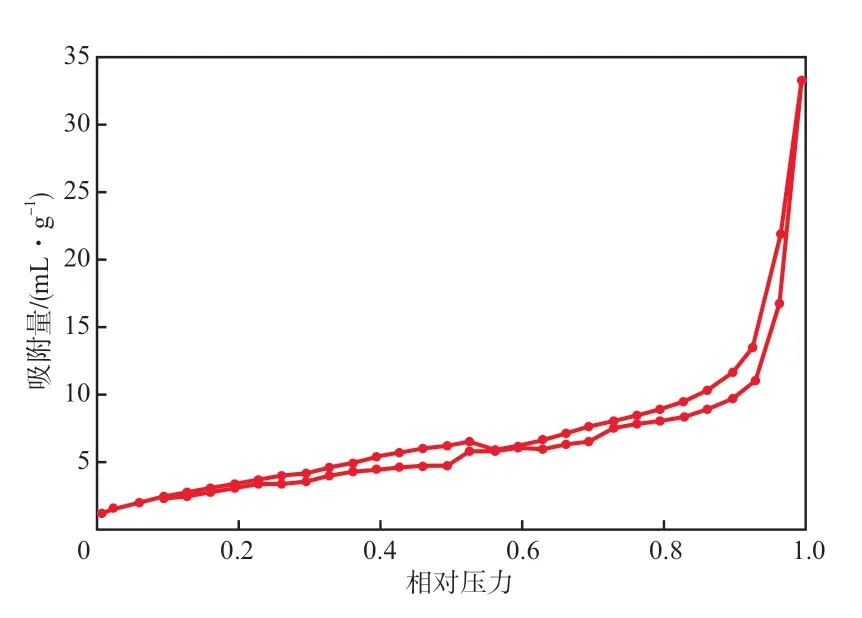
图3 Cu-Fe/AC催化剂的N2吸附-脱附等温线
2.2 反应条件对COD去除率的影响
2.2.1 反应温度
在反应停留时间为0~120 min、初始pH为3.3、H2O2加入量为2.2 g/L的条件下,考察反应温度对模拟废水中COD去除率的影响,结果见图4。由图4可见:反应温度为40~80 ℃时,随着反应停留时间的延长,COD去除率呈明显上升趋势,这是因为在这一温度范围内,H2O2在催化剂表面形成吸附态和自由态两种形式的·OH,降解效果显著;当反应温度进一步升高至100 ℃以上时,COD去除率呈现下降趋势,原因是高温下H2O2被迅速分解为H2O和O2,难以产生·OH。由此可见,当反应温度为80 ℃时,可以最大程度的减少自身的氧化,产生较多的·OH[8]。
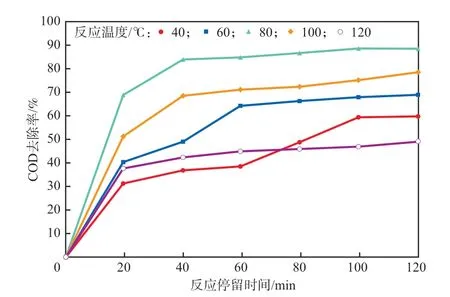
图4 反应温度对COD去除率的影响
2.2.2 反应停留时间
在反应温度为80 ℃、初始pH为3.3、H2O2加入量为2.2 g/L的条件下,考察反应停留时间对模拟废水中COD去除率的影响,结果见图5。由图5可见,在反应停留时间为90 min后,COD去除率趋于稳定,达到82%以上。

图5 反应停留时间对COD去除率的影响
2.2.3 初始pH
在反应温度为80 ℃、反应停留时间为0~120 min、H2O2加入量为2.2 g/L的条件下,考察初始pH对模拟废水中COD去除率的影响,结果见图6。由图6可见:当初始pH为3.2时,反应120 min后COD去除率达到78%;初始pH高于5.5时,反应120 min后COD的去除率仅为51%。由此可见,酸性条件下有利于反应的进行,这是因为pH过高导致某些中间体的生成过多,这些中间体会消耗H2O2,导致COD去除率降低。
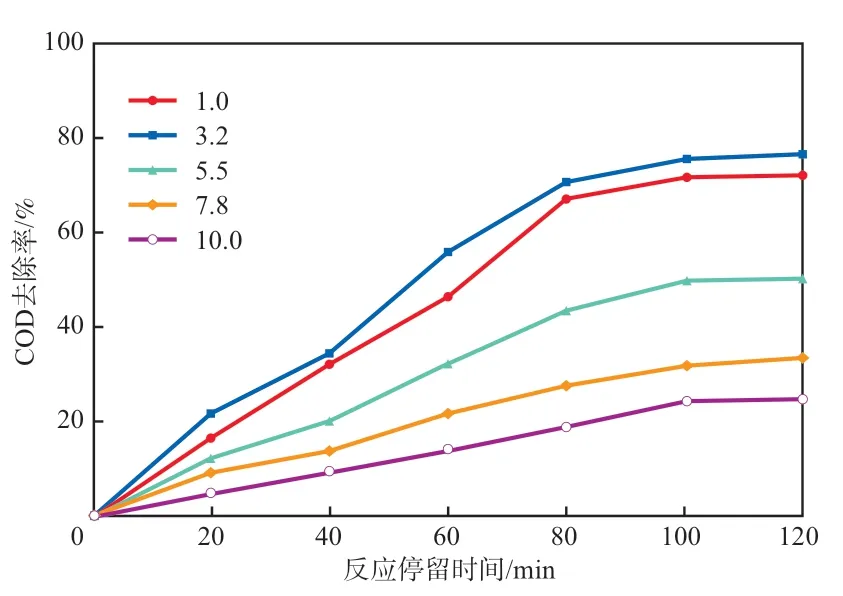
图6 初始pH对COD去除率的影响
2.2.4 H2O2加入量
在反应温度为80 ℃、反应停留时间为0~120 min、初始pH为3.3的条件下,考察H2O2加入量对模拟废水中COD去除率的影响,结果见图7。由图7可见,H2O2加入量从2.1 g/L升高至4.0 g/L时,反应120 min后COD去除率从84%下降至38%,这是由于过量的H2O2起到了羟基自由基清除剂的作用[9],同时也占据了催化剂的活性位点,生成活性较低的次生自由基。
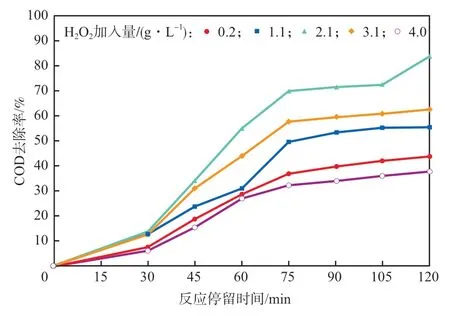
图7 H2O2加入量对COD去除率的影响
2.3 RSM法分析结果
利用RSM法对实验数据(实测值)进行多元回归拟合,结果见式(2):
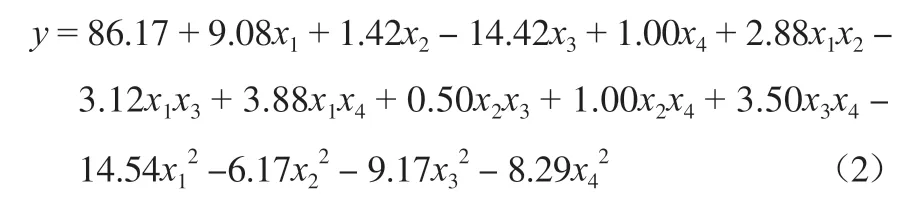
式中,x1、x2、x3、x4表示一阶项线性主因子的影响,x1x2、x1x3、x1x4、x2x3、x2x4、x3x4和x12、x22、分别表示交互项和二阶项两个因子之间的相互作用以及方程中的二次效应。由式(2)可见,反应温度和时间有着明显的协同作用,而二次项具有拮抗效应。
采用式(2)计算出COD去除率的预测值,结果见表2。由表2可见,预测值与实测值基本吻合。
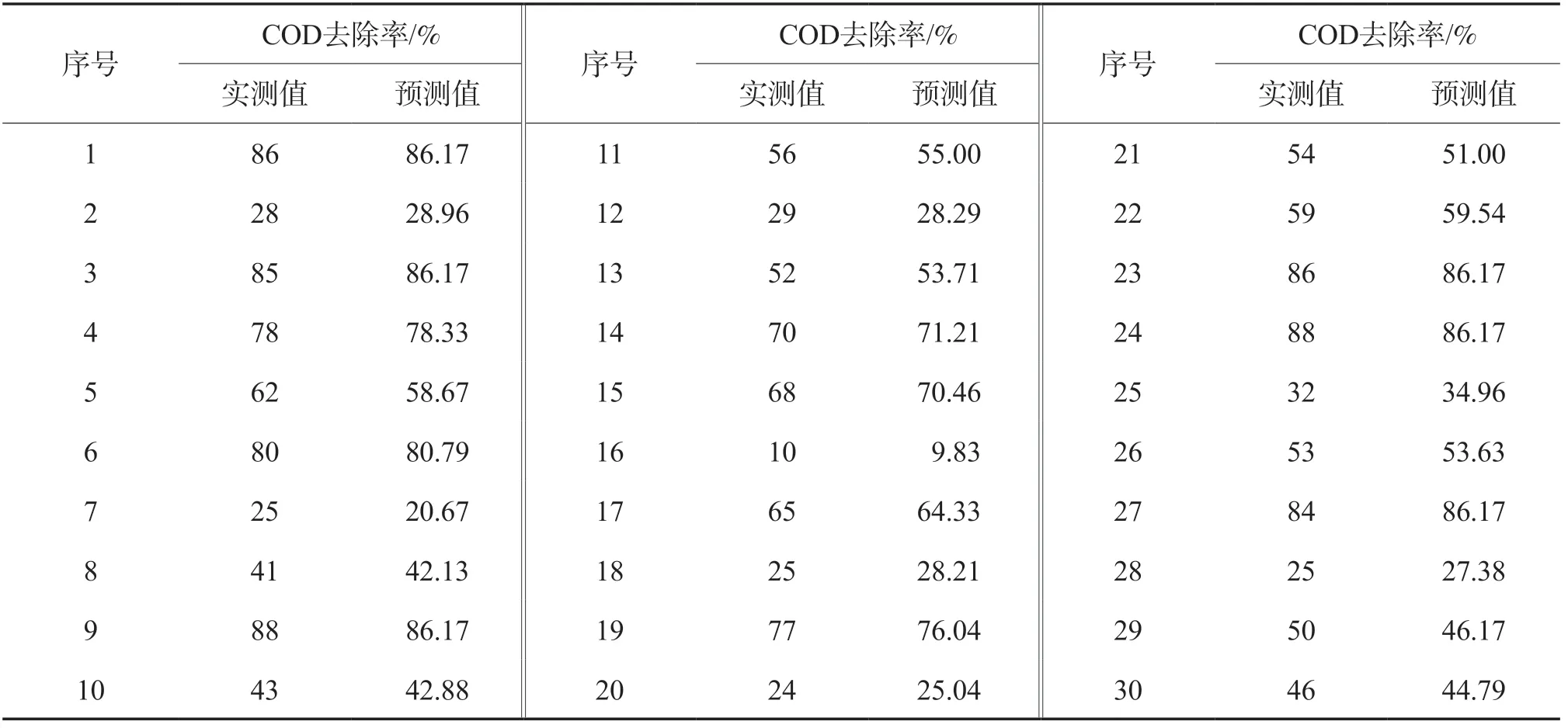
表2 RSM法模拟CWPO处理苯酚废水的结果
2.4 方差分析
采用方差分析(ANOVA)中的Fisher法对多元回归模型系数进行检验,结果见表3。由表3可见,模型的F值>1,表明该模型具有最佳的回归效果;P值<0.000 1,表明发生误差干扰的概率较小[10];失拟项的F值为3.81,P值为0.076 5,表明实测值与预测值的差异不显著,可以用该模型模拟催化湿式过氧化氢处理苯酚废水的实验。响应的决定系数R2为99.31%,校正决定系数R2Adj为98.67%,两者拟合程度较高[11],表明实验值和预测值有很好的相关性。精密度>4,表示模型可用于预测COD在实际处理时的去除率。因此,采用CCD法构建的多元回归模型可以应用于实验中寻找最优条件。

表3 多元回归模型系数的显著性检验
2.5 交互效应分析
2.5.1 温度和时间的交互效应
图8为反应温度和反应停留时间的响应面和三维图。由图8可见:在反应温度为100 ℃、反应停留时间为64 min的条件下,COD去除率为86%;在反应温度为50~100 ℃、反应停留时间为54~66 min的条件下,Cu-Fe/AC催化氧化生成·OH的效能最高,COD去除率也较高;·OH的生成量随反应停留时间的延长逐渐升高,因此较长的反应停留时间有利于催化剂与H2O2的充分接触,进一步延长时间,·OH的生成量趋于稳定,COD去除率基本保持稳定[12]。

图8 反应温度和反应停留时间的响应面分析等高线图(a)和三维图(b)
2.5.2 温度和H2O2加入量的交互效应
图9为反应温度和H2O2加入量的响应面和三维图。由图9可见,COD去除率与H2O2加入量在一定范围内呈正相关。当H2O2加入量大于2.7 g/L时,COD去除率随着温度的升高而降低,这是因为:过量的氧化剂使得溶液中存在大量的·OH,·OH之间彼此相互碰撞又重新产生H2O2。因此,为避免反应消耗过多的·OH,可将H2O2加入量控制在2.7 g/L。由图9还可看出:反应初期,温度的影响更为显著。这是因为这一阶段主要是有机物中间体的矿化,较高的温度加速了·OH的形成。在适宜温度和氧化剂的条件下,催化剂表面更容易获得氧原子来促进氧化,从而加速有机物的分解[13]。
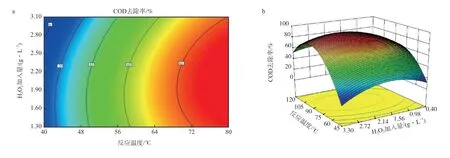
图9 反应温度和H2O2加入量的响应面分析等高线图(a)和三维图(b)
2.5.3 初始pH和H2O2加入量的交互效应
图10为初始pH和H2O2加入量的响应面和三维图。由图10可见,初始pH从1.0提高到3.3时,对COD有明显的去除效果,废水中的苯酚大部分被降解;当pH>5.5时,COD去除率显著下降。当pH 3~4时,Cu-Fe/AC催化湿式氧化过氧化氢处理苯酚废水的效果较好,COD去除率维持在80%左右,这是因为:当pH>4时,H2O2逐渐分解为无机物,溶液中较多的OH-会抑制·OH自由基的形成,加快了氧化剂的分解;当pH<3时,·OH的产生受到抑制,是因为溶液中的H+会和H2O2形成稳定水合物H3O2+,使得H2O2不易被活化[14]。
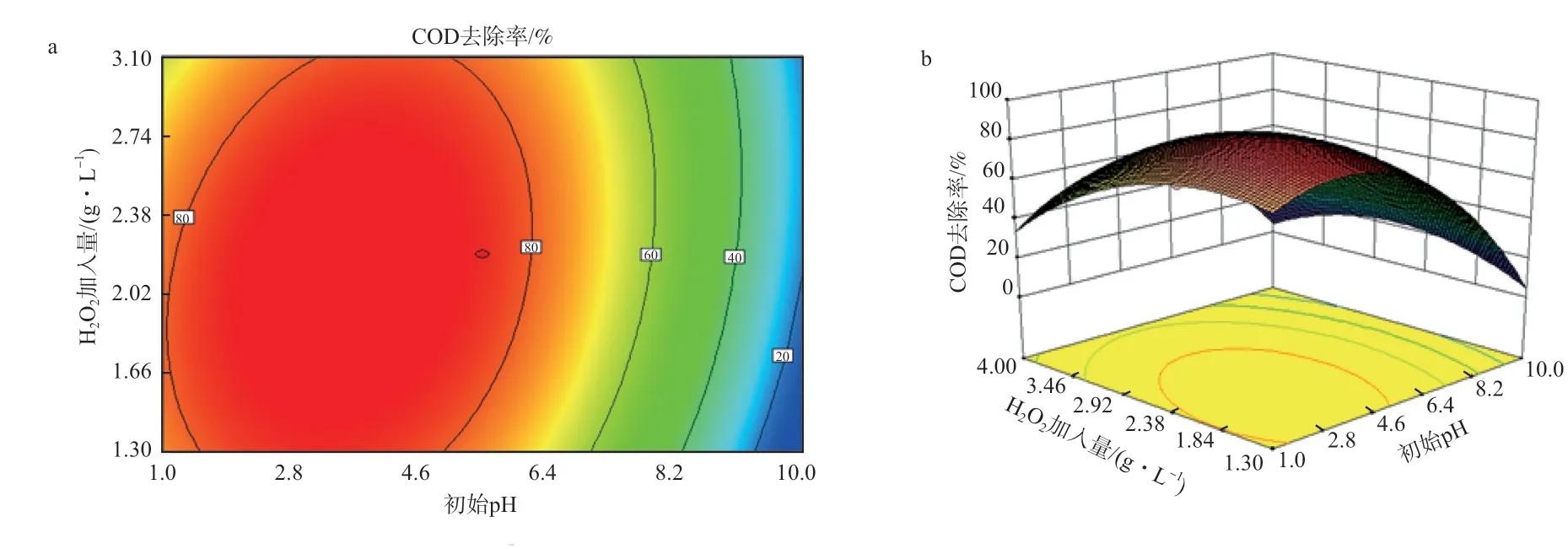
图10 初始pH和H2O2加入量的响应面分析等高线图(a)和三维图(b)
2.6 催化剂重复使用性能
在反应温度为80℃、反应停留时间为120 min、初始pH为3.1、H2O2加入量为2.2 g/L的条件下,重复使用Cu-Fe/AC处理苯酚废水,结果见图11。由图11可见,Cu-Fe/AC催化剂在重复使用4次后,COD去除率始终保持在80%以上,表现出良好的催化性能。

图11 催化剂重复使用次数与催化性能
3 结论
a)微波辅助合成的Cu-Fe/AC材料在苯酚催化湿式氧化过氧化氢中表现出较高的催化活性。在反应温度为80 ℃、反应停留时间为90 min、初始pH为3.1、H2O2加入量为2.2 g/L的条件下,COD去除率为82%。
b)显著性分析结果显示R2和R2Adj分别为99.31%和98.67%,精密度>4,表明多元回归模型可用于预测实际处理时COD的去除率。RSM结果表明:多元回归模型得到的预测值与实测值基本吻合;在反应温度为100 ℃、反应停留时间为64 min、初始pH为3.3、H2O2加入量为2.7 g/L的条件下,COD去除率可达到86%。
c)Cu-Fe/AC催化剂在连续使用4次后,对COD的去除率仍可保持在80%以上,表现出良好的重复利用性能。
