电针技术电化疗肌肉内血管瘤电传导机制建模与分析
2022-10-09张双徐晶余远昱王久江旷江明杨济宁张涛
张双,徐晶,余远昱,王久江,旷江明,杨济宁,张涛
1.内江师范学院人工智能学院,四川内江 641100;2.电子科技大学生命科学与技术学院,四川成都 611731;3.电子科技大学高场磁共振脑成像四川省重点实验室,四川成都 611731;4.内江师范学院智慧医疗工程应用实验室,四川内江 641100;5.内江师范学院内师-容天智慧医疗工程应用联合实验室,四川内江 641100
前言
肌肉内血管瘤是位于横纹肌内呈弥漫性生长的血管瘤,由于比较少见经常容易被忽略。该肿瘤约占海绵状血管瘤的0.8%,常出现在人体的四肢、面部以及躯干,可以微小到某一块组织乃至某一块肌肉;此外,它还可以进入到人体的神经及肌腱,容易引起功能性神经障碍[1-2]。目前关于肌肉内血管瘤患者的治疗主要有手术切除、激光治疗、栓塞治疗、注射治疗、铜针治疗和电针治疗[3]。由于手术治疗容易引起二次感染,而激光治疗、栓塞治疗、注射治疗由于操作难度大,且效果不明显,铜针治疗和电针治疗成为治疗肌肉内血管瘤关注的焦点[3-6]。铜针治疗和电针治疗都是通过向目标区域插入通电导针,然后向导针注入恒定、低强度的直流电信号,来实现对靶区肿瘤的治疗。由于铜针较粗(1~2 mm),对人体造成孔洞较大,且通电时,铜针容易电离[3-4]。电针治疗是精准治疗体积较小的肌肉内血管瘤的最佳方法[5-6]。
为了分析电针信号在肿瘤靶向区域信号的扩散情况,本研究结合解剖学基础与生物组织结构学基础,同时考虑到后期实验需要[7],提出使用有限元的方法建立具有手臂几何特性的精准刺激简化手臂模型;通过向模型中注入±20 mA、载波频率为100 kHz直流电信号,分析电针疗法电信号在手臂模型内部的传导机制,为肌肉内血管瘤精准微创治疗提供理论依据。
1 模型基础
从解剖学分析得知,人体手臂主要组织有皮肤、脂肪、肌肉、骨骼,考虑到软骨组织的电传导性几乎与肌肉相同,因此在本研究理论模型建立中,仅考虑主要组织对信号传递的影响。因此,本研究的手臂模型中仅考虑皮肤、脂肪、肌肉、骨骼4 种组织,当控制电流信号载波频率为100 kHz 时,组织的电导率与介电[8-9]如表1所示。在电针治疗信号注入前,人体手臂内部电信号(肌电等)十分微弱,可以忽略。当刺激信号频率为1 kHz~1 MHz 时,人体中绝大多数组织的电磁特性可以近似看作是电准静态场[10]。因此在模型初始化状态时,标准模型中总的电荷密度为0。
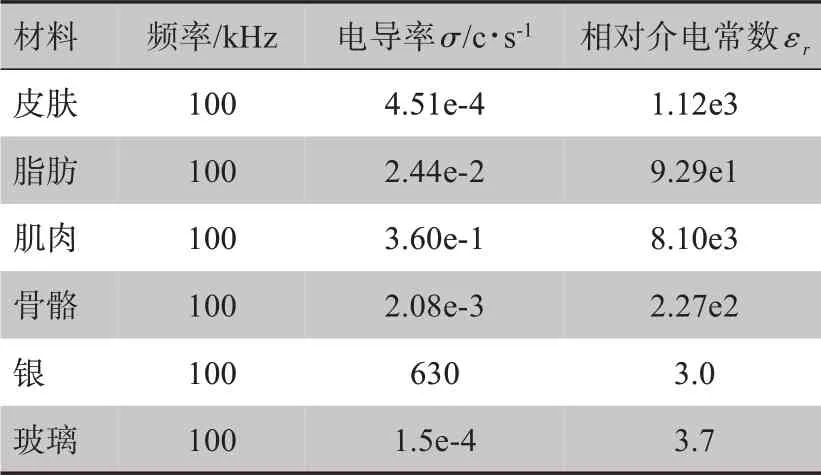
表1 组织电参数Table 1 Tissues electrical parameters
1.1 电势控制方程
在准静态电场中,容积导体须满足∇·J⇀≈0;从而可以得到电势的控制方程为:

其中,表示介质的复电导率=σ+iε0εr,R表示曲面上点的极坐标位置,φ表示导体内的感应电势。
1.2 注入电流控制
在电针治疗系统中,系统通过电针注入直流电信号,因此信号源可以表示为:

其中,Rs表示针头裸露处表面面积。在刺激系统中,正负电极施加电流满足:
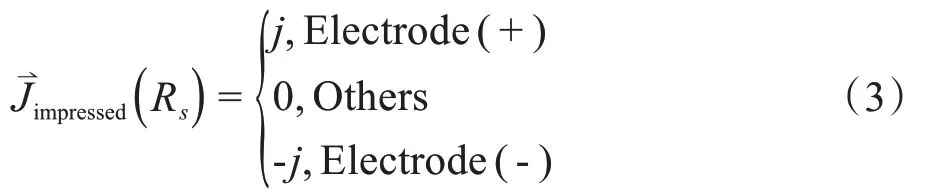
其中,j表示电针电极注入的电流密度,且,I表示注入电极的电流强度,s表示电针裸露处表面积,为了后期验证实验设计的安全性,同时保证实验操作接触时不产生刺痛感[11-12],耦合产生的电势尽可能小于36 V。结合前期研究,电流的取值范围为I≤20 mA[13-14];s表示电针裸露面积。
2 有限元模型建立
2.1 模型几何结构构建
为了便于后期设计实验验证,根据手臂解剖学结构和几何学特性,将手臂上臂与下臂简化成两根圆台。在圆台内部设计两个椭球来表示手臂的关节,上臂用一根圆柱来表示上臂骨骼,下臂用两根圆柱表示下臂骨骼,从外向内分离出皮肤、脂肪、肌肉以及骨骼4个部分(图1)。设计一根具有正负电极的探针为癌症靶向治疗探针。在模型中,设定皮肤厚度为1 mm,脂肪厚度为2 mm,骨骼半径为5 mm,电针半径为0.1 mm,绝缘玻璃厚度为0.1 mm。肌肉厚度为圆台去除皮肤、脂肪、骨骼剩下部分。
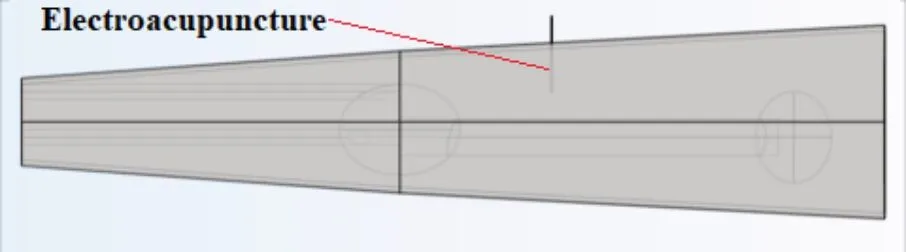
图1 手臂几何结构模型建立Figure 1 Establishment of arm geometry model
2.2 网格划分
在模型中,考虑到电针直径、间隔、绝缘层厚度均小于0.1 mm,且皮肤组织部厚度也仅为1 mm,为了保证模型计算的鲁棒性,同时也为计算机计算预留足够的计算资源,使用自由四面体网格类型对简化的手臂模型实施划分,在网格剖分中,使用用户控制网格序列类型,单元格大小使用较细化,剖分完成后,得到域单元数704 619,边界元数196 464,边单元数5 915。网格划分完成后效果图如图2所示。
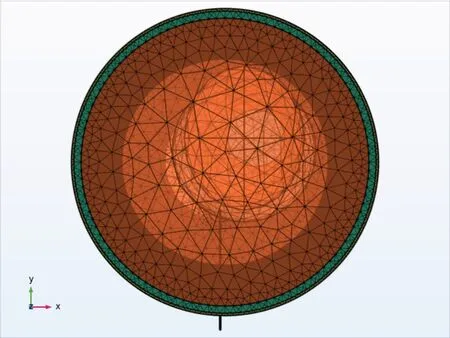
图2 网格剖分效果图Figure 2 Mesh generation
2.3 模型计算参数设定
在模型中,对电针的正负两极分别注入载波频率为100 kHz、±20 mA的电流信号,以此来分析电针治疗肌肉瘤过程中电信号在人手臂内的扩散情况。以此来分析电针的治疗效果以及信号对体内其他设备的干扰情况。在模型计算开始时,定义模型初始化状态时,简化模型各部分电势均为0,参数设置完成后在频域模式下开展计算,分析电流引起的物理场变化。
3 结果与分析
将设置完成的模型在多物理场仿真软件COMSOL Multiphysics 5.5 中执行计算(计算机参数:CPU: Intel(R) Core(TM) i7-8750H CPU @ 2.20 GHz;内存:96.0 GB;系统:64 位Windows 10),用时1 269 s得出的结果如图3~图6所示。从图中分析发现,虽然20 mA电流产生的感应电势最大值达18 V,但是信号主要集中在电极头处,扩散范围仅在电极头中心0.3 mm 半径的球域空间范围内,随着扩散范围的逐渐增加,感应电势逐步变小,当信号扩散到手臂表面及离裸露针头较远的范围时,感应电势趋于0,如图3~图6 所示。仿真结果说明,在电针治疗过程中,注入的电信号对人体内部及表面其他电子设备的影响是非常微小的,可以忽略不计。
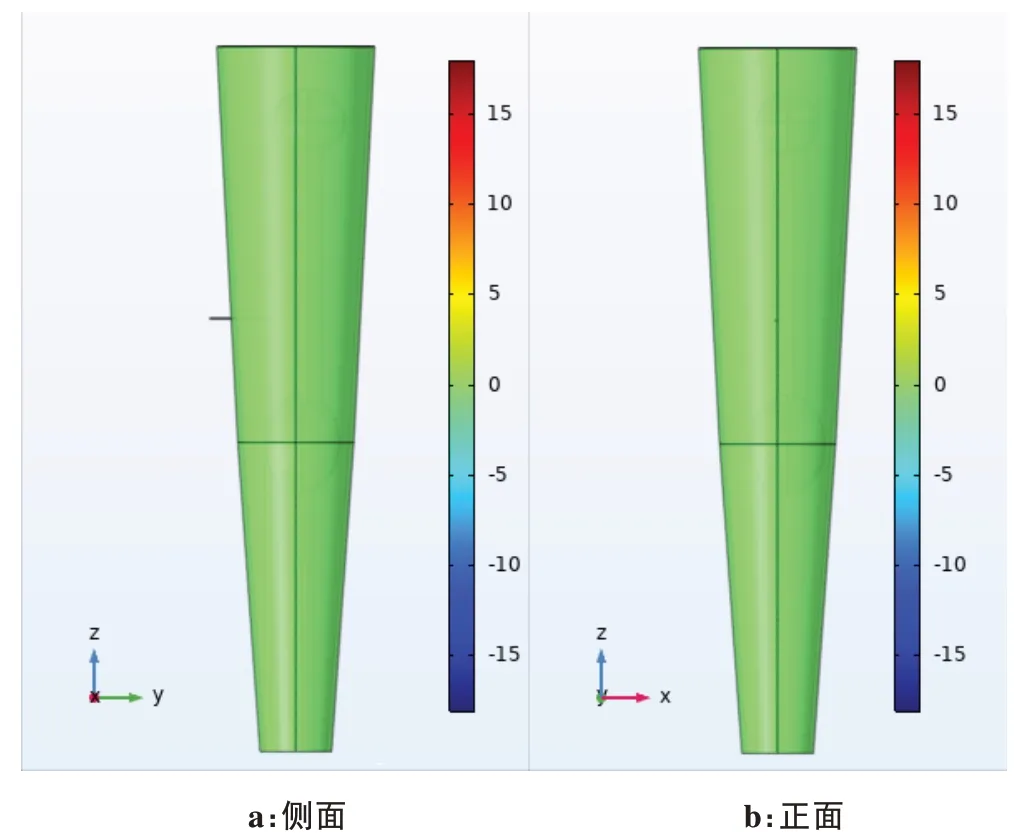
图3 电势空间分布图Figure 3 Spatial distributions of the potential
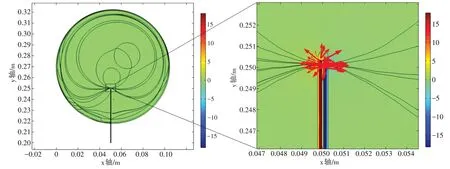
图4 电针中心剖面xy截面电势、电流密度分布图Figure 4 Distributions of potential and current density in xy section of central section of electroacupuncture
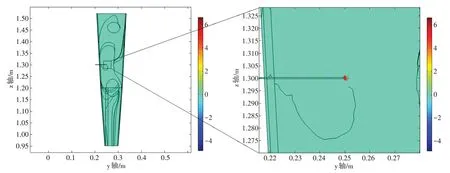
图5 电针中心剖面yz截面电势、电流密度分布图Figure 5 Distributions of potential and current density in yz section of central section of electroacupuncture
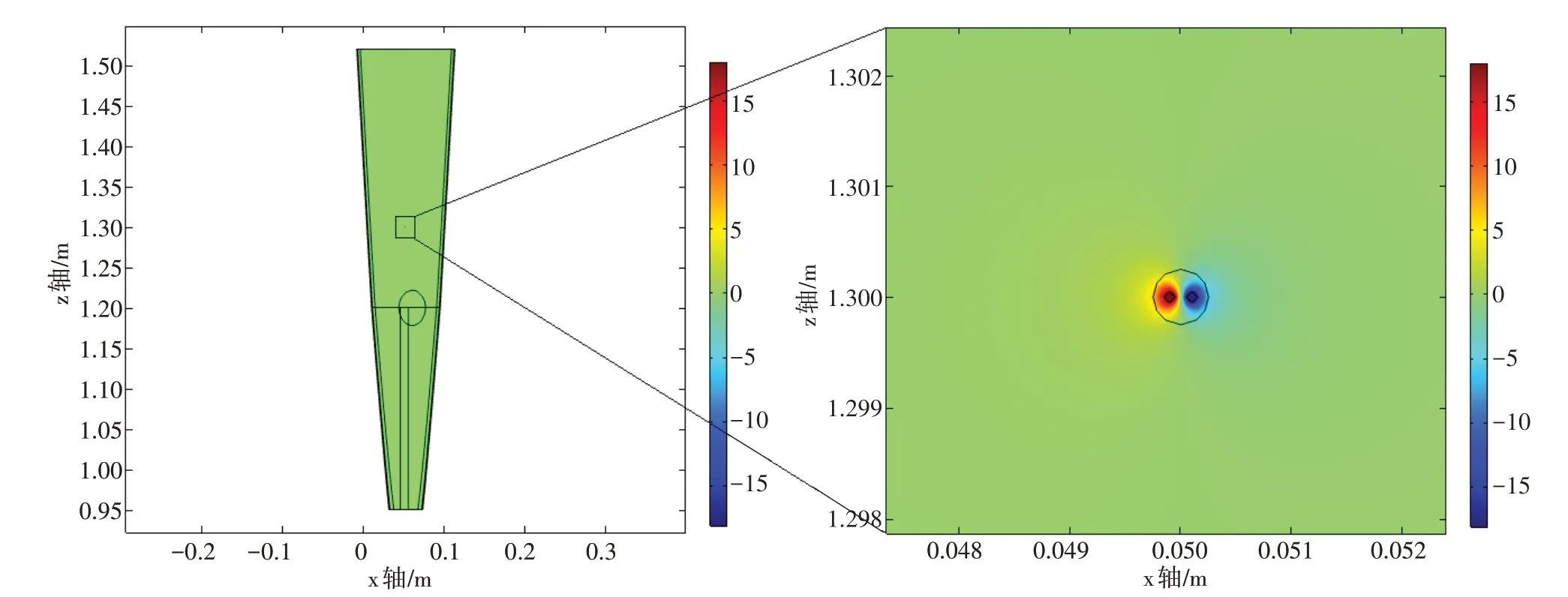
图6 电针中心剖面xz截面电势、电流密度分布图Figure 6 Distributions of potential and current density in xz section of central section of electroacupuncture
从图7b 充分证明电针信号主要集中在电针头所在区域,图7d 表示与正负电极所在连线间隔10 cm处透过表面的感应电势取值,虽然z 轴方向距离仅移动了10 cm,但是感应电势最大值从18 V 衰减到了5×10-5V,衰减了2.8×106倍,达111 dB(11 dB/cm)。这与前期研究植入式体导通信所给出的结论几乎是一致的[13]。

图7 内部感应电势分布Figure 7 Internal induced potential distribution
为了分析针刺电流在手臂组织(主要研究肌肉组织)内部电流信号分布情况,以电针头所在轴线y方向与z方向进行提取,从图8中研究发现,电流主要分布在裸露针头周围,由于裸露针头直径仅为0.1 mm,因此信号主要集中在针头0.3 mm 的范围,0.3 mm 以外电流密度分布几乎为0。这为较远距离电子设备不受干扰提供了理论依据。
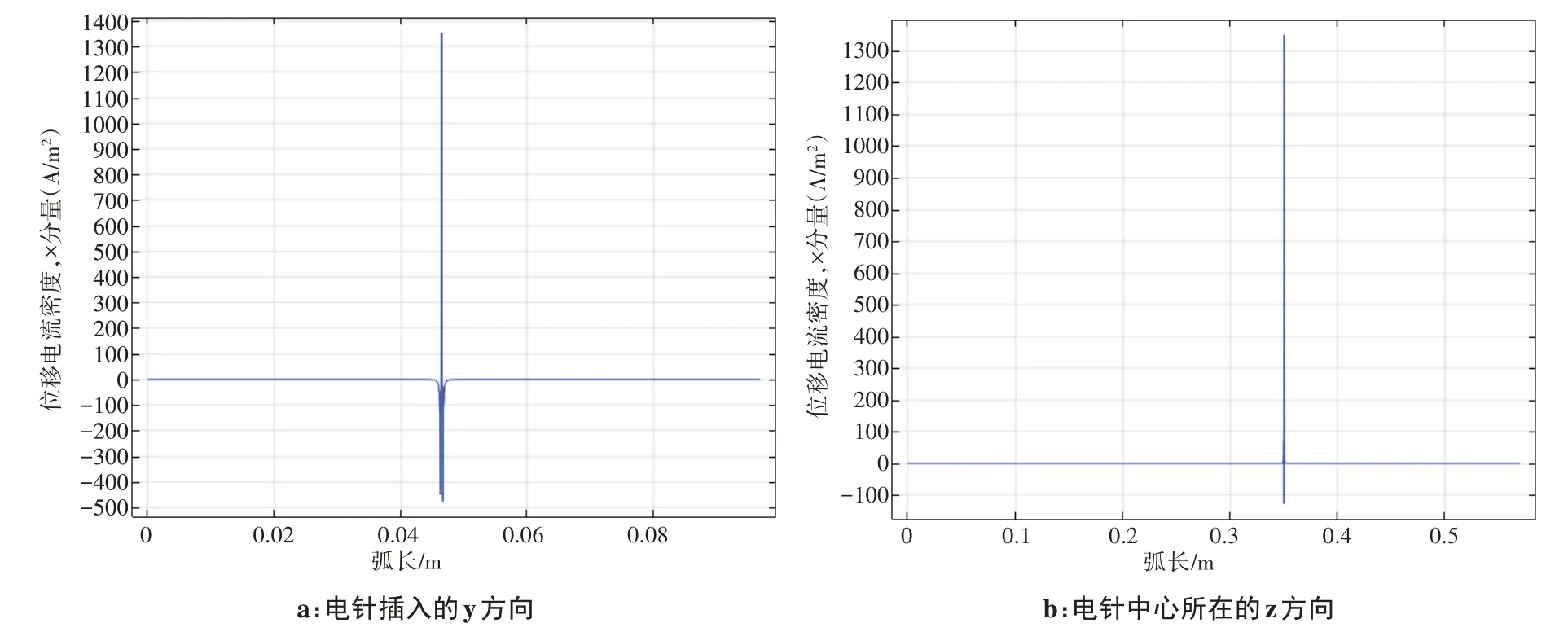
图8 电流密度分布图Figure 8 Current density distribution
4 讨论
本文以人体手臂作为研究对象,通过一系列简化将人体手臂简化成圆柱来进行研究,虽然兼顾了组织分布特性,但是该研究仍然存在一定的局限性,主要存在以下问题:(1)为了后期实验方便,在有限元模型建立过程中,对部分组织结构进行了一系列的简化,可能会影响部分计算结果[15-17],在模型验证中计划通过参数校准的方式来消除部分误差;(2)通过文献得知,电针电化疗过程中,除了电效应外还有热效应及化学效应。在下一步模型修正中,计划通过电场+热场+电化学多物理场混合建模的方式构建多物理场,以求更加准确地分析电针电化疗效应[18-21]。
5 结论
本研究以电针治疗前臂肌肉内血管瘤为研究对象,结合生物解剖学、组织结构学;同时兼顾后期实验模体设计方便,建立具有手臂组织结构特性的简化模型。通过设计双极尖端裸露电针的方式、在电针正负极分别注入载波频率为100 kHz、±20 mA的电流信号分析电针电信号在人体肌肉组织内的弥散情况。通过仿真分析发现,0.1 mm 直径电针、间隔距离为0.1 mm 时,信号扩散主要集中在0.3 mm 的球状空间内,且最大电势能产生18 V,当远离电针裸露头部中心时,以11 dB/cm 的衰减系数减弱。当距离足够远时,电针信号将将衰减到无法检测到,因此它对其他电子设备的影响是几乎可以忽略的。接下来本课题组将结合仿真结果开展实验研究以及交流电电化疗研究,分析信号在手臂内部的传导机制研究,得出模型结果与实验结果之间的误差,并加以校准。
