钆塞酸二钠增强MRI T1 mapping定量参数与肝细胞癌Ki-67表达的相关性研究
2022-10-08刘子蔚杨少民陈海雄郭保亮张榕周翠铷李晓虹胡秋根
刘子蔚,杨少民,陈海雄,郭保亮,张榕,周翠铷,李晓虹,胡秋根*
肝细胞癌(hepatocellular carcinoma, HCC)是肝脏最常见的原发性恶性肿瘤,发病率逐年上升,是导致全球癌症主要死亡的原因之一。目前HCC在我国常见的恶性肿瘤中居于第4位,在癌症导致死亡病因中居于第2位[1]。手术切除是HCC国内外公认的早期根治性的治疗方式,但手术切除术后5年的复发率高达60%~70%,术后高复发率是影响HCC患者术后远期生存状况的重要因素[2-3]。Ki-67是一种与细胞增殖活性有关的核抗原,它是反映细胞增殖水平的常用指标,一些学者认为Ki-67是评估HCC患者术后复发及不良预后的重要生物学标志物[4-5]。目前Ki-67检测依赖于病理学检查,穿刺活检是获取病理组织的常用方法,但它是一种侵入性的检查,具有一定的局限性[6-7]。术前使用无创的定量方法来评估Ki-67的表达对术前临床治疗方案的制订具有积极作用。肝脏特异性对比剂钆塞酸二钠(gadolinium-ethoxybenzyl-diethylenetriamine pentaacetic acid, Gd-EOB-DTPA)能被正常肝细胞摄取,越来越被应用于肝脏疾病的诊断及评估。既往研究表明信号强度(signal intensity, SI)可以定量评估HCC 的肿瘤特性[8-10],然而SI 常受到扫描参数的影响且与Gd-EOB-DTPA 浓度不成比例[11-12]。T1 mapping 技术是一种无创的定量分析组织T1 值的方法,它能够与Gd-EOB-DTPA良好结合,更准确、客观地提供携带功能信息的MRI定量图像。两者结合能够定量反映HCC 摄取有机阴离子转运蛋白多肽(organic anion transporting polypeptide, OATP)的能力,从而反映HCC的肿瘤特征。既往研究在评估HCC的病理分化[13]、微血管侵犯[14]、切除复发[15]等方面取得了一定的研究成果。这为术前精准无创地评估Ki-67表达提供了依据。迄今,国内利用Gd-EOB-DTPA 增强MRI T1 mapping 定量参数评估HCC Ki-67 表达相关性的研究报道少见。本研究旨在探讨Gd-EOB-DTPA增强MRI T1 mapping定量参数与HCC Ki-67表达的相关性。
1 材料与方法
1.1 临床资料
本研究属于回顾性研究,经南方医科大学顺德医院(佛山市顺德区第一人民医院)伦理委员会批准,免除受试者知情同意,批准文号:科研伦审20201124。本研究回顾性分析2019年7月至2020年12 月南方医科大学顺德医院(佛山市顺德区第一人民医院)因单发HCC行根治性手术的患者资料。纳入标准:(1)术后病理诊断为单发HCC并行根治性手术;(2)术前2 周内行Gd-EOB-DTPA 增强MRI T1 mapping检查;(3)病理标本均行Ki-67 免疫组化染色。排除标准:(1)术后病理诊断为其他肝脏肿瘤或多发性(>2 个)HCC;(2)各种原因导致的MRI 图像存在严重伪影不适合诊断;(3)术前接受任何肿瘤治疗。
1.2 MRI检查方法
所有患者均使用3.0 T MRI(西门子,Skyra 3.0 T MR)扫描仪、腹部专用线圈(体部相控阵线圈,18 通道),采用膈肌导航技术进行扫描,检查范围自肝脏上缘至肝脏下缘。先行轴位T1WI容积内插法体部检查(volume interpolated body examination, VIBE)序列及轴位T1 mapping平扫,接着采用Gd-EOB-DTPA进行轴位增强扫描,注射对比剂后20~30 s行动脉期扫描,60 s、150 s分别行门脉期、平衡期扫描,再行轴位T2WI 刀锋(BLADE)序列扫描,20 min 后行轴位肝胆期成像及轴位T1 mapping 扫描。增强扫描使用Gd-EOB-DTPA(Primo-vist; Bayer Schering Pharma AG, Berlin, Germany)对比剂,采用高压注射器自肘静脉注入,剂量0.1 mL/kg,流速1.0 mL/s,然后以相同速率注射30 mL 生理盐水冲管。T1 mapping采用T1Map-双翻转角VIBE 序列,并进行B1 mapping 匀场校正,序列扫描完后自动生成mapping 图像,主要参数:TR 5.01 ms,TE 2.3 ms,层厚4 mm,双翻转角3°、15°,视野(field of view, FOV)380 mm×285 mm,矩阵224×168;T1WI-VIBE 序列主要参数:TR 4.00 ms,TE 1.29、2.52 ms,层厚3 mm,FOV 380 mm×380 mm,矩阵320×240。
1.3 图像分析与数据测量
将患者的影像数据从PACS 中以DICOM 格式导出,应用RadiAnt DICOM Viewer 2020.2(https://www.radiantviewer.com)软件进行阅片。由2名分别有12年和15年腹部专业诊断经验的放射科副主任医师在不知晓患者临床资料的前提下测量数据,测量前先进行培训。感兴趣区(region of interest, ROI)勾画尽可能选取最大层面,尽可能保持各序列同一层面,ROI应尽可能放置在病变动脉期强化区域,如果肿瘤较大(>5 cm),则采用多个ROI取平均值的方法,避开出血、坏死液化、血管,采用复制、粘贴方法确保各序列ROI面积的一致性。设定测量正常肝组织及病灶选取的ROI面积范围约为0.5~2.0 cm2,每个ROI测量3次后取平均值,用2名医师测量结果的平均值作为最终测量值。测量以下数据:(1)平扫(pre-enhancement, pre)、动脉期(arterial phase, AP)、门脉期(the portal venous phase, PP)、平衡期(equilibrium phase, EP)及肝胆期(hepatobiliary phases, HBP)的肿瘤与同一肝段的正常肝组织的SI,计算肿瘤-正常肝实质信号强度比[16-17](tumor to liver contrast ratio, TLR)及对比强化比(contrast enhancement ratio, CER),TLR=SI肿瘤/SI肝脏,CER=(TLR增强后-TLR平扫)/TLR平扫。(2)在T1 mapping 测量病灶平扫T1 弛豫时间(T1 relaxation time, T1rt-Pre)、肝胆期T1弛豫时间(T1 relaxation time, T1rt-20min),计算T1 弛豫时间减低率(reduction rate of T1 relaxation time, rrT1rt),rrT1rt-20min=[(T1rt-Pre)-(T1rt-20min)]/T1rt-Pre。
1.4 病理分析
所有组织标本均在我院病理科进行切片、苏木精-伊红染色(hematoxylin-eosin staining, HE)以及免疫组化Ki-67 特殊染色。在不知道影像学征象的情况下,由两名高年资病理科医师独立观察,病理结果有异议时协商达成一致意见。对Ki-67的判定:在高倍显微镜(×400)下取5 个FOV,每个FOV 计数100 个细胞,并计数肿瘤内的热点区域[细胞核出现棕褐(黄)色颗粒],Ki-67 认定为阳性细胞占总细胞的百分比,取其平均值。由于Ki-67的表达多为同质性,故以阳性染色细胞的百分比进行评分[18-19],并分为两组:≤25%为Ki-67 低表达组、>25%为Ki-67 高表达组。
1.5 统计学分析
使用Windows 的SPSS 22.0 版进行统计学分析,采用Kolmogorov-Smirnov 方法检测样本是否符合正态分布。符合正态分布的计量资料以(xˉ±s)表示,不符合正态分布的计量资料用中位数(四分位间距)表示。采用组内相关系数(inter-class correlation coefficient, ICC)评价2 名医师测量结果的一致性(ICC>0.75认为具有良好的一致性,0.65~0.75认为一致性一般,ICC<0.65则认为一致性差)。MRI各定量参数与Ki-67 之间相关性比较采用Spearman 相关系数。Ki-67高、低表达组间比较采用独立样本t检验或Mann-WhitneyU检验。根据受试者工作特征(receiver operating characteristic, ROC)曲线下面积(area under the curve, AUC),敏感度、特异度、Youden指数(特异度+敏感度-1)、临界值(cut-off值)评估各参数在Ki-67高、低表达组间的诊断效能。采用DeLong 检验比较各参数曲线下面积AUC 值的差异。P<0.05为差异有统计学意义。
2 结果
2.1 病例入组及分组
最终纳入74 例患者病例,男65 例、女9 例,年龄30~84(59.69±10.57)岁。Ki-67≤25%组男33 例,女7 例,年龄(60.9±11.2)岁,肝功能Child-Pugh 评分A 级36 例、B 级4 例;Ki-67>25%组男32 例,女2例,年龄(58.2±9.7)岁,肝功能Child-Pugh评分中A 级32 例,B 级2 例。本研究中性别、年龄、肝功能Child-Pugh评分在两组间的差异无统计学意义(P值分别为0.166、0.278、0.518)。
2.2 2名医师测量结果的一致性
2 名 医 师 测 量T1rt-Pre、T1rt-20min、TLR-Pre、TLR-AP、TLR-PP、TLR-EP、TLR-HBP 的ICC 分别为0.839(95%CI:0.717~0.912)、0.849(95%CI:0.732~0.917)、0.817(95%CI:0.681~0.899)、0.781(95%CI:0.623~0.878)、0.796(95%CI:0.647~0.887)、0.831(95%CI:0.702~0.907)、0.807(95%CI:0.662~0.887)。2名医师测量间的一致性较好。
2.3 Gd-EOB-DTPA 增强MRI 定量参数与Ki-67 的相关性分析
T1rt-Pre、T1rt-20min 与Ki-67 呈 强 正 相 关[r=0.668(95%CI:0.515~0.780),r=0.659(95%CI:0.494~0.784),P均<0.001](图1);TLR-Pre、TLR-HBP与Ki-67呈中等程度负相关[r=-0.495(95%CI:-0.647~-0.300),r=-0.497(95%CI:-0.670~-0.288),P均<0.001];TLR-PP、TLR-EP与Ki-67呈弱负相关[r=-0.272(95%CI:-0.483~-0.035),P=0.019;r=-0.362(95%CI:-0.568~-0.142),P=0.002]。其余参数差异无统计学意义(P>0.05)(表1)。
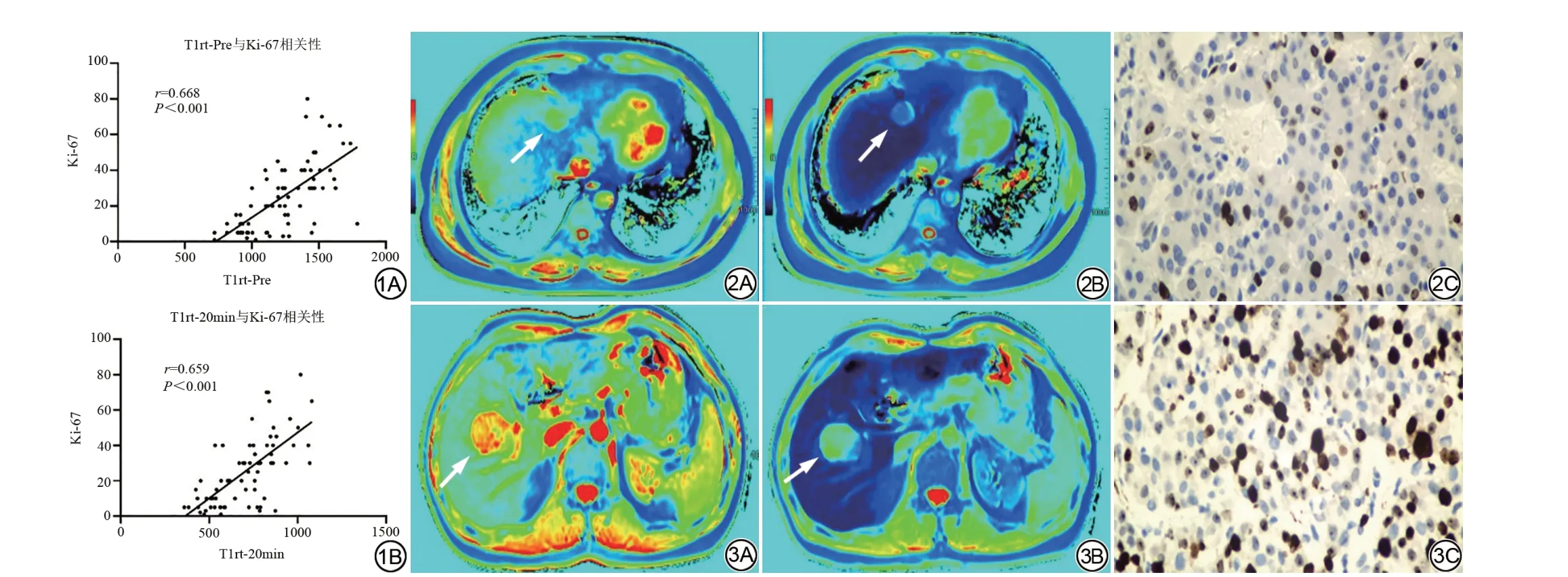
图1 T1 弛豫时间(T1rt-Pre、T1rt-20min)与Ki-67 相关性散点图。 图2 男,48 岁,肝细胞癌(2 级),Ki-67 低表达。2A:T1rt-Pre 横断面,T1rt-Pre=(958.0±43.5)ms;2B:T1rt-20min 横断面,T1rt-20min=(513.3±21.4)ms;2C:Ki-67 免疫组化染色(×400),Ki-67 约为10%。 图3 男,47 岁,肝细胞癌(3 级),Ki-67 高表达。3A:T1rt-Pre 横断面,T1rt-Pre=(1504.6±90.5)ms;3B:T1rt-20min 横断面,T1rt-20min=(854.9±36.6)ms;3C:Ki-67 免疫组化染色(×400),Ki-67约为50%。T1rt-Pre:MRI T1 mapping平扫T1弛豫时间;T1rt-20min:钆塞酸二钠增强MRI T1 mapping肝胆期T1弛豫时间。Fig. 1 Scatter plot of correlation between T1 relaxation time (T1rt-Pre, T1rt-20min) and Ki-67. Fig. 2 Male, 48-year-old, hepatocellular carcinoma grade 2, low expression of Ki-67. 2A: Cross section of T1rt-Pre, T1rt-Pre=(958.0±43.5) ms; 2B: Cross section of T1rt-20min, T1rt-20min=(513.3±21.4) ms; 2C: Pathological immunohistochemical Ki-67 (×400), Ki-67 was about 10%. Fig. 3 Male, 47-year-old, hepatocellular carcinoma grade 3, high expression of Ki-67. 3A: Cross section of T1rt-Pre,T1rt-Pre=(1504.6±90.5)ms;3B:Cross section of T1rt-20min,T1rt-20min=(854.9±36.6)ms;3C:Pathological immunohistochemical Ki-67(×400), Ki-67 was about 50%. T1rt-Pre: T1 relaxation time of unenhanced MRI T1 mapping; T1rt-20min: T1 relaxation time in the hepatobiliary phase with Gd-EOB-DTPA enhanced MRI T1 mapping.

表1 钆塞酸二钠增强MRI定量参数与Ki-67相关性Tab.1 Correlation between quantitative parameters of Gd-EOB-DTPA MRI and Ki-67
2.4 Ki-67低、高表达组间比较及诊断效能分析
本研究中Ki-67 低、高表达组间T1rt-Pre、T1rt-20min、TLR-Pre、TLR-AP、TLR-EP、TLR-HBP 差异均具有统计学意义(P均<0.05),其他参数差异无统计学意义(P均>0.05)(表2)。研究所示Ki-67低表达组表现为较小的T1rt-Pre、T1rt-20min(图2),Ki-67 高表达组表现为较大的T1rt-Pre、T1rt-20min(图3)。T1rt-Pre、T1rt-20min、TLR-Pre、TLR-AP、TLR-EP、TLR-HBP的AUC值分别为0.868(95%CI:0.769~0.936)、0.890(95%CI:0.795~0.951)、0.717(95%CI:0.670~0.869)、0.646(95%CI:0.527~0.754)、0.680(95%CI:0.561~0.784)、0.782(95%CI:0.670~0.869)(P均<0.05)(表3)。结果表明T1rt-Pre、T1rt-20min具有较高的诊断效能,临界值分别为1278.73、724.5 ms(图4),利用DeLong检验两两比较结果表明T1rt-Pre、T1rt-20min 分别与TLR-Pre、TLR-AP、TLR-EP的AUC值差异具有统计学意义(P均<0.05),而与TLR-HBP 差异无统计学意义(P>0.05)(表4)。
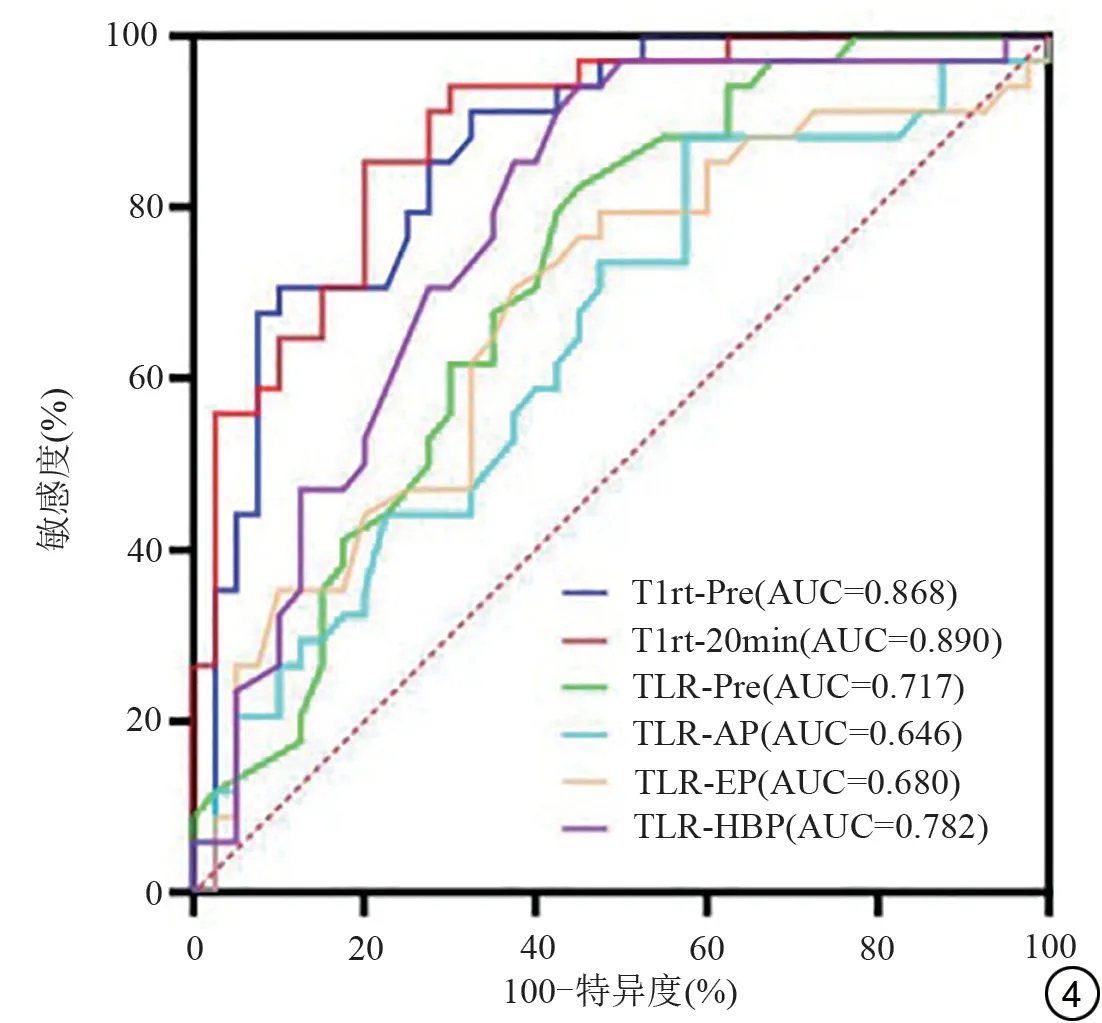
图4 T1rt-Pre、T1rt-20min、TLR-Pre、TLR-AP、TLR-EP、TLR-HBP 的ROC曲线。T1rt-Pre:MRI T1 mapping平扫T1弛豫时间;T1rt-20min:钆塞酸二钠增强MRI T1 mapping肝胆期T1弛豫时间;TLR:肿瘤-正常肝实质信号强度比;Pre:平扫;AP:动脉期;EP:平衡期;HBP:肝胆期。Fig.4 ROC curves of T1rt-Pre,T1rt-20min,TLR-Pre,TLR-AP,TLR-EP,TLR-HBP. T1rt-Pre: T1 relaxation time of unenhanced MRI T1 mapping;T1rt-20min: T1 relaxation time in the hepatobiliary phase with Gd-EOB-DTPA enhanced MRI T1 mapping; TLR: tumor to liver contrast ratio; Pre: pre-enhancement; AP: arterial phase; EP: equilibrium phase;HBP:hepatobiliary phases.

表2 两组间定量参数比较分析Tab.2 Comparative analysis of quantitative parameters between two groups
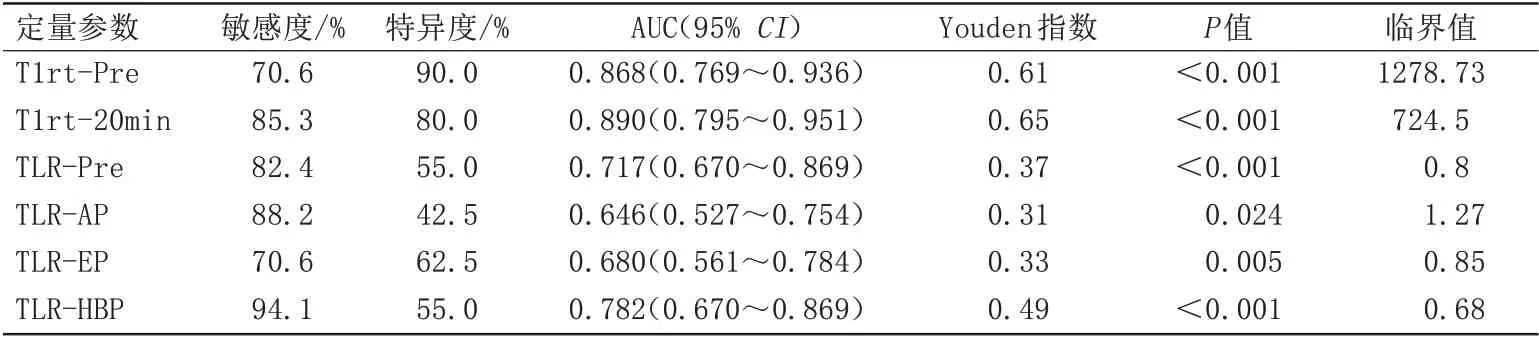
表3 两组间定量参数诊断效能分析Tab.3 Analysis of diagnostic efficacy of quantitative parameters between two groups
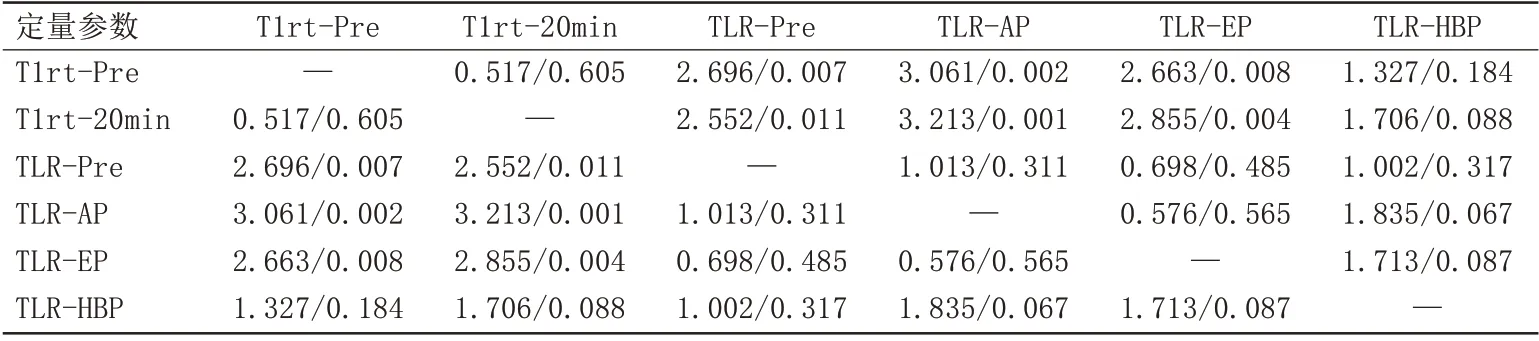
表4 各参数间AUC值两两比较(Z/P值)Tab.4 Pairwise comparison of AUC values between parameters(Z/P value)
3 讨论
本研究探讨了Gd-EOB-DTPA T1 mapping 定量参数与Ki-67的相关性,并将Ki-67为分高、低表达组进行组间比较,分析各参数的诊断效能及曲线下面积的差异。研究表明Gd-EOB-DTPA 增强MRI T1 mapping所测的T1rt-Pre、T1rt-20min与HCC Ki-67表达具有较强的正相关性,且T1rt-Pre、T1rt-20min 对HCC Ki-67 表达具有较高的评估价值,要优于基于信号强度比的定量参数。本研究结果证明T1 mapping具有术前无创地预测Ki-67表达的潜在价值,能为HCC患者术前手术方案的制订起到积极的作用。
3.1 各定量参数与Ki-67的相关性
本研究结果表明T1rt-Pre、T1rt-20min与Ki-67具有较强的正相关性,TLR-Pre、TLR-HBP 与Ki-67 呈中等程度负相关,TLR-PP、TLR-EP 与Ki-67 呈弱负相关,而CER 参数差异无统计学意义。Chen等[20]研究结果中的T1rt-Pre、T1rt-20min与Ki-67相关性与本研究结果相一致,但其研究结果中的SI-Pre、SI-HBP与Ki-67相关性高于本研究的TLR-Pre、TLR-HBP。为了使所测数值相对准确,本研究采用TLR=SI肿瘤/SI肝脏的方法测量,该方法可以降低肝脏背景的干扰,因此,本研究结果更具可靠性。而且,T1 mpping反映的是组织的固定特征,不受扫描序列参数限制,且与组织中的钆对比剂的浓度成正性相关[21-22]。而SI 是相对数值,机器与扫描参数的不同均会影响SI的大小,且与对比剂浓度不呈线性关系。因此,T1 mapping 值比信号强度比值更加准确[23-24]。
3.2 Ki-67高、低表达组间比较及诊断效能分析
本研究多期增强扫描得出的TLR-Pre、TLR-AP、TLR-EP组间比较差异具有统计学意义,但诊断效能偏低,而肝胆期TLR-HBP诊断效能相对较高。该结果与既往相关研究结果相一致。姜虹等[25]研究表明基于动脉期得出的SI的诊断效能偏低,而肝胆期得出的信号强度增强比诊断效能较高。同样,Ye等[16]研究也表明肝胆期的TLR具有较高的诊断效能。胡梦洁等[26]的研究也得出肝胆期的信号强度比是Ki-67高表达的独立预测因子。导致这一现象的可能原因在于Gd-EOB-DTPA是一种肝胆特异性MRI对比剂,可通过OATP途径被肝细胞吸收,具有双重的细胞外和肝胆特性,可以提供功能性和结构性的肝胆期信息[27-29]。不同于上述研究,本研究还发现,Gd-EOB-DTPA 结合T1 mapping(T1rt-Pre、T1rt-20min)具有更高的诊断价值,其AUC值与TLR-Pre、TLR-AP、TLR-EP差异具有统计学意义,其中T1rt-20min诊断效能最高,AUC 值与TLR-HBP 差异虽然无统计学意义,但其特异度有明显的提高。T1rt-Pre 的诊断效能与T1rt-20min 相仿,同样具有较高的敏感度及特异度,可见Ki-67 高表达的HCC 组织中具有更长的T1弛豫时间[16,20]。导致这一结果的可能原因在于:其一,当肿瘤细胞增殖越活跃,其单位体积内肿瘤细胞排列更紧密,从而导致T1rt-Pre 值越大;其二,当肿瘤细胞增殖越活跃,肿瘤中含有的正常肝细胞比例越低,那么Gd-EOB-DTPA 吸收也随之减少,从而导致T1rt-20min值越大。
3.3 本研究的局限性
本研究具有一些局限性。(1)本研究为回顾性研究且样本量相对较少,可能存在选择性偏倚;(2)目前Ki-67 分组仍未有统一标准,各研究存在差异,故需要多中心大样本研究不同分组的差异,比较不同分组的诊断效能;(3)ROI 为手动勾画,可能存在测量误差;(4)本研究未考虑肝内多发病灶的影像图像与病理图像一一对应,而多发性肝癌临床并不少见,因此,在后续前瞻性研究中,我们将联合肝胆外科、病理科进一步精准匹配病理影像结果。
综上所述,本研究表明Gd-EOB-DTPA 增强MRI T1 mapping 所测的T1rt-Pre、T1rt-20min 与HCC Ki-67 表达具有较强的正相关性,且T1rt-Pre、T1rt-20min 在Ki-67高、低表达组间的诊断效能较高,对HCC Ki-67表达具有较好的评估能力。
作者利益冲突声明:全部作者均声明无利益冲突。
