偏侧咀嚼者的脂质组学研究*
2022-10-08翟孝庭胡园黄东宗史悦怡李鸿波胡敏刘洪臣姜华
翟孝庭 胡园 黄东宗 史悦怡 李鸿波 胡敏 刘洪臣 姜华
咀嚼是一种节奏性运动,需要外周器官、感官输入和中枢神经系统共同协调[1]。近年来,咀嚼对学习记忆功能的影响受到了广泛关注。流行病学研究表明,缺牙、咀嚼效率低下和义齿功能不良等是造成学习记忆能力降低和痴呆症发生的危险因素[2-5]。而良好的咀嚼功能可以改善记忆表现,其机制可能包括减轻焦虑和压力[6]、增加脑血流量[1]、外周神经刺激传入激活脑区[7]等。动物实验表明,缺牙或咬合紊乱等咀嚼能力降低后,脑内海马区出现神经元细胞密度降低、突触减少等病理改变[8];同时也出现神经递质和激素水平的改变,如糖皮质激素水平上升[9]、乙酰胆碱释放量减少[10]、脑源性神经营养 因 子(brain-derived neurotrophic factor,BDNF)水平降低[11]等改变。上述神经功能衰退的表现说明咀嚼功能不良可能参与海马的调控,与机体学习记忆能力减退有关[12]。
偏侧咀嚼(chewing-side preference,CSP)是指偏爱使用一侧牙列进行咀嚼的不良咀嚼习惯[13]。本课题组前期研究发现,拔除单侧下颌牙的小鼠在短时间内即出现学习记忆能力下降的表现,同时伴有偏侧咀嚼小鼠海马CA1区5-羟色胺受体水平降低及CREB-BDNF通路的改变,提示单侧的咀嚼功能障碍可引起神经递质的水平改变,参与海马的调节[14,15]。偏侧咀嚼可能也参与认知功能减退的进程,但其具体机制尚不清楚[16,17],需要进一步深入研究。
中枢神经系统的脂质浓度仅次于脂肪组织,脂质代谢在中枢神经系统中起着重要作用。研究表明,咀嚼活动减少后,大鼠的海马内星形胶质细胞数量和形态发生改变[18,19],而星形胶质细胞主要通过胆固醇的合成与代谢参与突触功能的调控及神经细胞的成熟[20],进而影响认知功能[21]。神经干细胞的活性也与脂质代谢密切相关[22],提示脂质代谢紊乱是海马功能异常的因素之一,可能影响学习与记忆功能。
脂质组学(lipid metabolism)是应用高通量分析化学及数据统计分析的方法,全面系统地研究生物体受到内、外因素刺激后而改变的脂质产物,进而认识生物体的生理和病理状态,在探索未知且复杂的机制中具有高效性[23],可用于疾病的机制研究、早期诊断和探寻靶标[24]。已有研究发现外周血中某些脂质代谢产物与认知功能的评分密切相关,可作为轻度认知障碍及阿尔兹海默病的预测标志物[25]。认知功能的研究涉及复杂的细胞代谢网络,而脂质组学作为高通量分析方法为揭示发病机理提供了极好的手段。
因此,本实验将通过收集偏侧咀嚼患者血液样本,利用组学技术研究偏侧咀嚼受试者的脂质代谢特征,筛选出具有显著性差异的代谢物及其相关通路,旨在为咀嚼功能与认知功能的相关研究提供参考。
1.材料和方法
1.1 研究对象及分组 纳入2020年9月至2021年3月在解放军总医院口腔科就诊的患者为受试者,分为左侧偏侧咀嚼组(left chewing side preference,LCSP)6例、右侧偏侧咀嚼组(right chewing side preference,R-CSP)6例和无偏侧咀嚼对照组(heathy control,HC)6例。本研究经解放军总医院医学伦理委员会批准(S2020-327-01),所有受试者自愿参与实验。
(1)纳入标准:①通过病史调查和视觉观察法确认偏侧咀嚼及其侧别[26];②就诊前无针对偏侧咀嚼的治疗史;③患者牙列相对完整,无根尖周炎、牙周炎和牙列缺损等长期影响咀嚼功能的疾病。
(2)排除标准:①严重影响咀嚼功能的相关疾病,如颌面部感染、外伤、类风湿性疾病、中重度牙周病及单侧牙列多牙缺失(除第三磨牙外,失牙数多于1)等。②精神及神经病史、脑器质性病变等脑部疾病,以及糖尿病、高脂血症、心血管疾病等全身性疾病。③妊娠期妇女或近期服用代谢调理相关药物的患者。
(3)偏侧咀嚼的判断:①主诉偏侧咀嚼史长达3年及以上;②偏侧咀嚼者牙周卫生情况存在双侧不对称,且咀嚼偏好侧的磨牙面可能有轻到重度磨耗而对侧牙磨耗较轻或无磨耗(图1);③让受试者咀嚼口香糖2 min,每隔15 s打断,连续记录7次,观察第1、3、5、7次口香糖所在的侧别,如果观察口香糖3次以上位于同一侧则记录为偏侧咀嚼[26]。
1.2 研究方法 采集患者血样后2 h内离心(2000 rpm,10 min,4℃),提取血浆并储存于-80℃低温冰箱,每位患者取3次平行样品,进行分析。根据脂质提取步骤,取10 μL血浆加入480 μL提取液(MTBE:MeOH=5:1),匀浆后离心(3000 rpm,15 min,4℃),取250 μL上清液。重新加入250 μL提取液,匀浆后离心(3000 rpm,15 min,4℃),取250 μL上清液,重复步骤1次。最后合并以上3次的上清液,在37℃下真空干燥。向干燥后的代谢物中加入100 μL的溶液(DCM:MeOH:H2O=60:30:4.5)进行复溶,混匀后离心(12000 rpm,15 min,4℃),取30 μL上清液于进样瓶中上机检测。最后取每个样本的10 μL上清液混合成质控样本(Quality Control,QC)进行校验。
使用SCIEX ExionLC超高效液相色谱仪,通过ACQUITY UPLC HSS T3色谱柱(2.1×100 mm,1.8 µm,Waters)对目标化合物进行色谱分离。流速0.3 mL/min,自动进样器温度4℃。流动相A为40%水和60%乙腈溶液,流动相B为10%乙腈和90%异丙醇溶液。以多反应监测(multiple reaction monitoring,MRM)模式进行质谱分析。
1.3 数据处理 将获得的原始数据通过skyline 20.1软件进行处理,通过模式识别对原始数据进行峰解卷积,积分,峰对齐,具有相应峰强度的质荷比(m/z)和保留时间的列表。与质控样本QC的原始总离子流(Total Ion Current,TIC)色谱图叠加对比,观察仪器的稳定性及重现性。
在样品识别分析之前对数据进行标准化预处理,以消除由样品之间的体积质量或稀释等造成的差异。将标准化后的数据导入SIMCA软件进行多元统计分析。首先采用无监督主成分分析方法(Principal Component Analysis,PCA),获得主成分数目和总体的差异。随后采用正交偏最小二乘法判别分析(Orthogonal Projections to Latent Structures-Discriminant Analysis,OPLS-DA),获得两组间显著差异的相关代谢物信息。为避免过度拟合,采用7次交叉验证法对模型的质量进行检验,并用分析得到的R2X、R2Y和Q(2前两者代表可解释性,后者代表模型的可预测度)对结果进行评价。对OPLS-DA中主成分的变量投影重要度(Variable Importance in the Projection,VIP)进行排序,VIP>1表明变量间存在组间差异。采用SPSS20.0软件进行两独立样本t检验,P<0.05的变量具有统计学意义。同时用实验物质定量的比值(Fold change,FC)筛选出显著差别的脂质代谢物,FC>1.5或FC<0.7则认为代谢物具有较大的改变。
通过以上分析得到差异性代谢物,并对其定量值用欧式距离矩阵(Euclidean distance matrix)分析,通过ggcorrplot和dplyr工具包以完全连锁方法对差异代谢物进行聚类,通过pheatmap、dplyr和openxlsx工具包绘制热图进行展示。分析各代谢物之间的联系相关性,最后通过KEGG数据库进行代谢通路的富集分析。
2.结果
2.1 受试者一般资料及血脂情况 三组受试者的年龄、性别及血脂情况差异均无统计学意义(P>0.05)。(表1)。
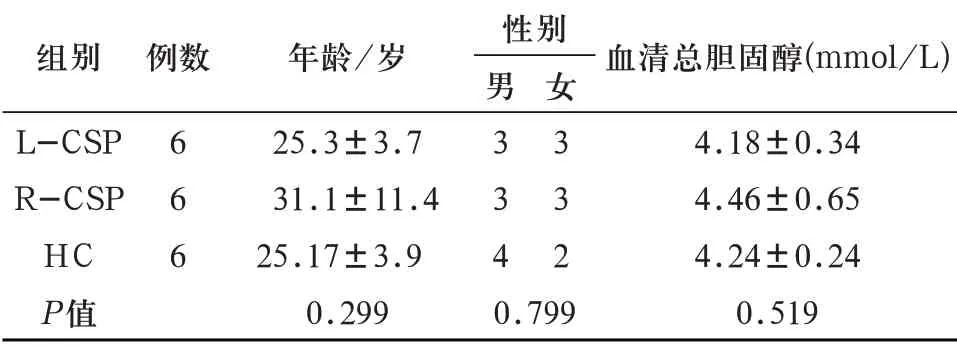
表1 受试者基本信息及血脂情况
2.2 数据分析结果 将三个QC的正离子检测模式和负离子检测模式的TIC色谱图分别进行叠加比对(图2)。色谱峰值保留时间和峰面积基本重合,表明实验过程中仪器稳定性好。
将LC-MS原始数据进行过滤,提取各代谢物的离子峰,取得的峰数量为652。经过交叉验证后建立PCA和OPLS-DA模型以观察偏侧咀嚼组和对照组代谢产物的分布情况。所有模型的R2值大于0.4,模型的拟合度良好,检测结果未出现过拟合现象(表2)。而L-CSP与R-CSP组对比时,Q2为负数,代表两样本差异不明显。OPLS-DA评分图显示L-CSP与HC之间有明显的区别(R2X=0.571,R2Y=0.830,Q2=0.384),同时R-CSP与HC也存在明显区别(R2X=0.443,R2Y=0.838,Q2=0.417),提示偏侧咀嚼可引起脂质代谢轮廓变化(图3)。

表2 OPLS-DA模型的参数
2.2显著性差异代谢物的筛选 建立OPLS-DA模型后,以VIP>1,P<0.05以及FC值作为标准,筛选出显著差异代谢物(表3、4)。多变量统计分析共鉴定出L-CSP组与对照组有41个差异血浆脂质代谢物,R-CSP组与对照组有28个差异血浆脂质代谢物,而左右偏侧咀嚼组内比较有7个差异血浆脂质代谢物。通过筛选得到了9种显著性差异代谢物,其中包括磷脂酰胆碱(Phosphatidylcholines,PC),磷脂酰乙醇胺(Phosphatidylethanolamines,PE),溶血磷脂酰乙醇胺(Lysophosphatidylethanolamines,LPE),神经酰胺(Ceramides,CER),鞘磷脂(Sphingomyelines,SM),甘油二酯(Diacylglycerols,DAG),甘油三酯(Triacylglycerols,TAG),游离脂肪酸(Free Fatty Acids,FFA),胆固醇酯(cholinesterase,CE)。
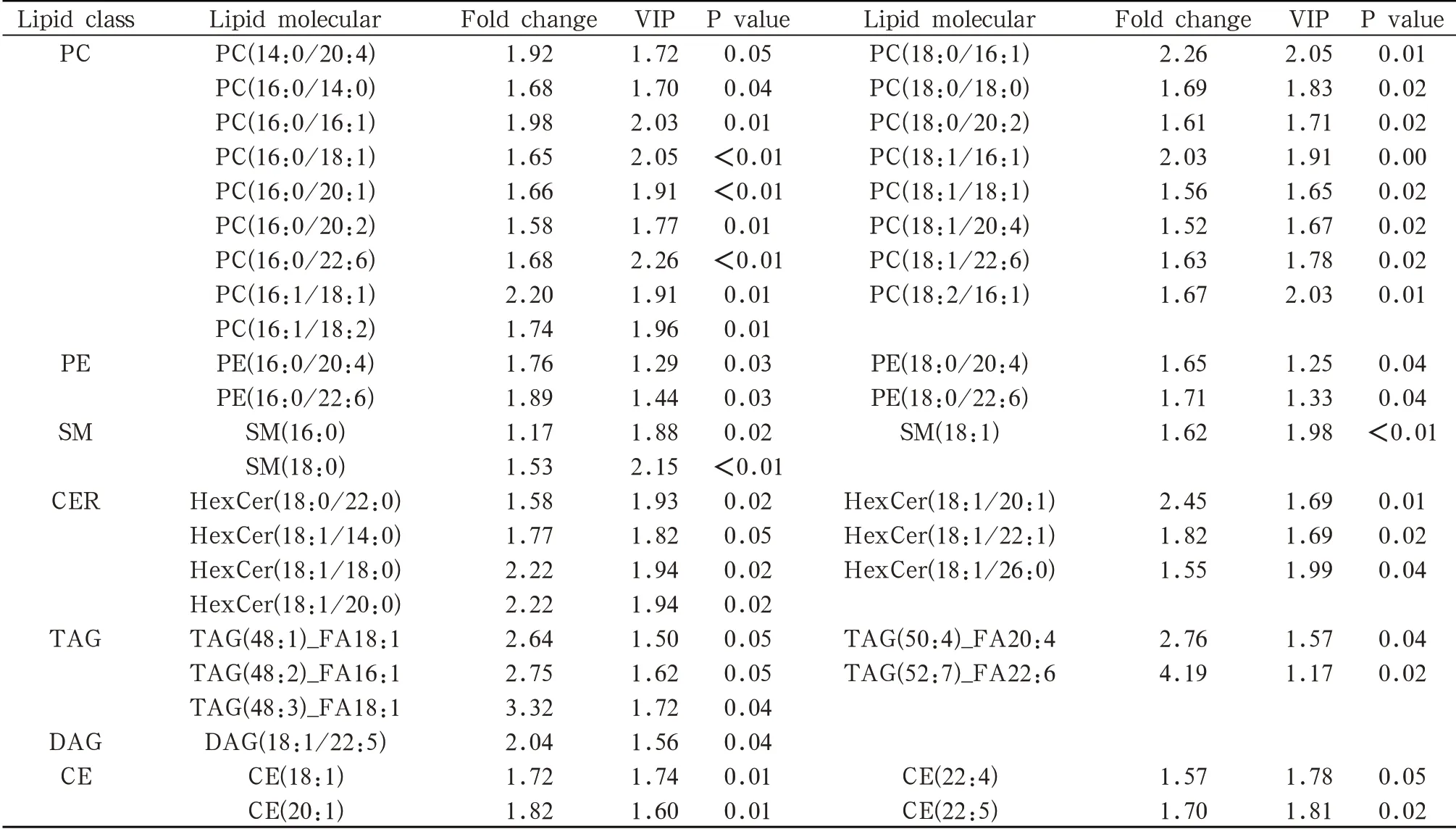
表3 L-CSP组与HC组血脂差异的统计学分析
2.3 生物信息学分析 将筛选出的显著性差异代谢物分别进行层次聚类分析(图4)。L-CSP与HC对比发现,PC、PE、CER、SM、TAG、CE升高。在DAG的各类同分异构分子中,DAG(18:1/22:5)较HC组高,而DAG(16:0/20:5)较HC组低。R-CSP与HC对比发现,PC、LPA、CER、SM、TAG、FFA升高。在DAG和PE的各类同分异构分子中,DAG(18:1/22:5)无明显差异,PE(16:0/18:1)、PE(16:0/20:3)、PE(18:0/20:4)、PE(18:0/22:5)较对照组高,而DAG(16:0/20:5)以及PE(P-16:0/20:3)较HC组低。

表4 R-CSP组与HC组血脂差异的统计学分析
2.4 代谢相关通路分析 将CSP组和HC组的差异性代谢物数据通过MetaboAnalyst 5.0进行KEGG的相关通路富集分析,发现改变的通路主要涉及胆固醇代谢,甘油磷脂的代谢,脂肪酸代谢以及类固醇合成等通路(表5)。

表5 部分代谢通路富集分析
3.讨论
本研究首次利用脂质代谢组学对偏侧咀嚼者的血浆进行研究,发现左侧与右侧偏侧咀嚼者的脂质代谢产物对比没有明显差异,表明咀嚼偏好的侧别对脂质代谢的影响较小。偏侧咀嚼者与对照组的血浆对比,差异代谢物共有9种,提示偏侧咀嚼可能与脂质代谢存在一定的关联。
目前咀嚼功能与脑认知功能的关系受到了广泛的关注,但是大部分临床研究集中于问卷调查、咬合检测以及影像学检测等观察性研究,较少涉及疾病机理的研究[27,28],而脂质组学作为一种高通量的分析检测方法,为微创条件下研究疾病的机制机理提供了新手段[29]。Mapstone等[30]招募了525名参与者,利用脂质组学技术检测,发现血浆中PC(36:6)、PC(38:0)、PC(40:6)、LPC(18:2)等脂质代谢产物的水平与脑认知功能表现相关,可作为认知功能降低的相关预测指标,并且进一步联合蛋白质组学进行网络分析,发现神经退行性疾病与脂质代谢和免疫功能密切相关[31]。此外也有文献发现PC、CE、TAG等十种代谢产物可作为轻度认知障碍(MCI)向阿尔茨海默病(AD)转变的预测性指标,在认知障碍或者AD发生前,这些生物标志物就已经出现改变,可以根据这些生物标志物来评估认知功能减退的进展[25,32]。本研究发现CSP受试者可能发生胆固醇代谢、甘油磷脂代谢、脂肪酸代谢以及类固醇合成等通路改变(图5),与认知能力的预测指标存在部分重叠,提示CSP可能与认知功能有关的代谢途径改变有关。
磷脂(Phospholipids)、胆固醇(Cholesterol)和脂肪酸(Fatty Acids)具有多种生理功能,包括组装细胞膜、储存能量以及作为信号分子等[33,34]。越来越多的研究表明脂质代谢异常是认知功能减退的特征,了解代谢产物的改变有助于探寻其作用机制。
磷脂可分为甘油磷脂与鞘磷脂两大类,分别由甘油和鞘氨醇构成。甘油磷脂是机体含量最多的一类磷脂,参与细胞膜对蛋白质的识别和信号传导[35]。有研究表明甘油磷脂家族中的磷脂酰胆碱水平与处理认知的大脑区域的静息态血流量相关,可作为AD发生的生物标志分子,准确率达到83%[31]。Sophie等[36]通过体外实验发现,发现包括磷脂酰胆碱和胆固醇在内的11类脂质与生成Aβ蛋白的关键酶γ分泌酶活性呈正相关。Aβ蛋白在AD的发病机制中起到了关键作用[25],Aβ蛋白可激活PLA2家族酶进而分解磷脂酰胆碱,释放次级信号分子如花生四烯酸,引起神经细胞内的氧化应激[37],是认知障碍发生的早期事件[38]。本研究中偏侧咀嚼者的PC水平升高,考虑可能与CSP者脑内磷脂代谢有关。
鞘磷脂(sphingolipid,SM)由PC代谢分解后产生[33],维持神经元功能的基本结构和功能[39]。SM在神经细胞信号传递中起着关键作用,包括tau蛋白磷酸化、Aβ代谢、钙稳态、乙酰胆碱生物合成和细胞凋亡等[34]。而神经酰胺(Ceramide,CER)参与细胞凋亡、脂筏形成和线粒体呼吸链的调控。CER的累积可引发一系列导致神经元死亡的事件,包括PI3K/AKT和ERK通路的早期失活以及过氧化物ROS的产生[40]。同时,脂筏的重塑,尤其是相关酶活性的增强,可导致神经酰胺/鞘磷脂(CER/SM)比值的增加,促进了Aβ的产生[41]。本研究中SM、CER的水平升高,且CER/SM的比值增加,提示CSP人群可能发生细胞脂阀的稳定以及细胞凋亡信号的传递等改变。
胆固醇(Cholesterol)参与了神经元分化和重塑、突触的发生、神经递质的分泌等过程[31]。因血脑屏障的存在,脑内的胆固醇主要由星形胶质细胞合成,星形胶质细胞的形态及功能改变将对胆固醇代谢产生较大的影响[20]。研究表明,咀嚼功能与星形胶质细胞的形态及功能改变密切相关[18],可能影响应激状态[42]。本研究中CSP组的胆固醇酯较对照组高,提示偏侧咀嚼可能参与脑内应激状态的激活,影响星形胶质细胞,进而对胆固醇代谢产生影响。
脂肪酸代谢在认知能力衰退方面的研究广泛,主要包括饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)、多不饱和脂肪酸(PUFA)在脑内的作用。脂肪酸是磷脂与鞘磷脂合成中的关键分子,为脂质代谢提供脂肪酰基,也可以协助载脂蛋白参与胆固醇的运输以及Aβ蛋白的清除[34,38]。此外脂肪酸代谢产物可能参与脑内的过氧化,导致神经细胞的生理功能下降和细胞死亡[39]。本研究中,与对照组对比,CSP组的脂肪酸代谢产物含量呈上升趋势,提示偏侧咀嚼可能影响了复杂脂质的合成。
本研究运用脂质组学初步探究偏侧咀嚼与脂代谢之间的关系,为偏侧咀嚼与脑功能的研究提供新思路。为了深入探究其潜在的作用机制,可以考虑扩大样本量对其中的部分通路进行靶向代谢组学研究,同时可以探讨偏侧咀嚼在纠正后是否有类似通路的改变。由于伦理问题本研究选取血浆样本进行研究,但血脑屏障的存在可能对研究的准确性产生一定的影响,为此需要进行动物的脑内研究,对磷脂代谢、胆固醇代谢以及脂肪酸的代谢具体作用机制进行系统的验证,以探讨偏侧咀嚼与脂代谢之间的关系。
4.小结
本研究利用偏侧咀嚼者的血浆进行脂质代谢组学研究,通过分析发现偏侧咀嚼可能发生脂质代谢通路的改变,而咀嚼偏好侧的侧别对脂质代谢的影响较小。偏侧咀嚼者与对照组比较,共有9种差异性代谢产物水平发生改变,通过分析发现通路富集于磷脂代谢、胆固醇代谢以及脂肪酸代谢等代谢通路。提示偏侧咀嚼可能与脂质代谢存在一定的关联,具体的影响机制有待进行靶向代谢组学以及动物实验进行验证。
