淹水胁迫对福建山樱花幼苗生长和光合特性的影响
2022-10-08陆日惠徐力兴周晓星盛世红
陆日惠,徐力兴,周晓星,盛世红,冯 晨,陈 钏,唐 丽
(1.中南林业科技大学 林学院,湖南 长沙 410004;2.岳阳市林业科学研究所,湖南 岳阳 414000;3.农业农村部规划设计研究院,北京 100125;4.中国科学院 庐山植物园,江西 九江 330000)
【研究意义】水分是限制植物分布及影响植物生长发育最重要的非生物因子之一,土壤环境中的水分亏缺和水分过多均对植物产生胁迫,分为干旱胁迫和水淹(或水涝)胁迫。随着全球变化引起降雨呈现区域分布不均,城市面临的强降雨等风险尤为严峻[1],这也必将导致城市行道树或公园里的树木不时遭受水淹胁迫。土壤中的水分长时间处于饱和的状态,将导致土壤缺氧,从而使植物能量代谢及离子吸收受到抑制,产生乙烯等信号物质传递到地上器官,进而影响植物的形态特征,最直接的表现是叶片黄化、衰老和脱落[2-3]。福建山樱花(Cerasus campanulata)是蔷薇科(Rosaceae)樱属(Cerasus)的一种落叶乔木,自然分布于亚热带海拔100~600 m 的山谷林中及林缘,原产于福建、浙江、广东、广西、台湾等地[4]。在我国,福建山樱花是最耐热的一个樱花树种[5],因其花多色艳而具有重要的观赏价值,是早春时节重要的观赏树种。【前人研究进展】目前,针对福建山樱花的繁殖技术[6-7]和基因[8-10]方面的研究已有报道,其生物学特性[11]和抗低温胁迫[12]也开展了研究,而针对福建山樱花的水分生理研究鲜有报道。在抗旱方面,李书平等[13]和江登辉等[14]对福建山樱花和日本樱花(Cerasus yedoensis)实生幼苗进行了干旱胁迫研究,均认为日本樱花比福建山樱花更加抗旱;在水湿胁迫研究中,陈锁良等[5]报道福建山樱花抗水湿能力大于樱桃(Cerasus pseudocerasus),测定了淹水胁迫对福建山樱花相对电导率、叶绿素含量、可溶性蛋白、脯氨酸、超氧化物歧化酶和丙二醛等生理指标的影响。【本研究切入点】本研究组在湖南省岳阳市林业科学研究所科研基地种植的福建山樱花,近年来在雨季都出现了水淹导致其长势不良甚至死亡的状况。因此,本文对福建山樱花幼苗的生长和光合响应开展研究。【拟解决的关键问题】将对福建山樱花幼苗进行不同淹水时间和不同淹水梯度的处理,通过测其生长和光合反应的变化,探明其对淹水胁迫的响应,为确定福建山樱花栽植在适合生长的环境及推广工作提供理论依据。
1 材料与方法
1.1 试验材料
福建山樱花种子由浙江省林业科学研究院提供。2020 年10 月下旬选破壳一致的福建山樱花种子,播于32孔穴盘中,采用泥炭土和珍珠石混合的基质,置于湖南省岳阳市林业科学研究所科研苗圃(113°10'N,29°18'E)进行养护。
2021年1月上旬,幼苗长至10~13 cm左右,将幼苗移栽到无纺布袋(口径8 cm,高15 cm)中,基质为v(泥炭土)∶v(河沙)∶v(蛭石)=2∶2∶1(体积比),基质体积约为无纺布袋容积的90%,将移栽后的幼苗放置于人工气候室(ZH-180912-QHS)(113°8'N,29°21'E)中养护,设置人工气候室温度为20~22 ℃,相对湿度为60%~65%,日照时间为08:00—17:00。2021年4月中旬,待幼苗长至50~60 cm且叶片数达20~25片时,选择长势一致、健康的幼苗放置于塑料瓶(口径12 cm,高20 cm)中,在人工气候室采用套盆法开展淹水试验。
1.2 试验设计
设置4个处理,即1)对照组(CK,正常养护不进行淹水胁迫);2)轻度胁迫(T1,水位处于基质1/2处);3)中度胁迫(T2,水位与基质表面平齐);4)重度胁迫(T3,水位高于基质2 cm)。每个处理30 盆,试验期间,每天对照淹水梯度及时补充水分。每隔3 d,在08:00—09:00 期间取幼苗中上部着生位置基本相同的成熟健康叶片,用于相关指标测定,每个处理3株,3次生物学重复。
1.3 指标测定方法
1.3.1 生长指标、生物量和根系的测定 淹水胁迫前后,每个处理选择4 株幼苗测量苗高、地径(分别精确至0.1 cm 和0.01 mm),每株测3 次,取平均值;用以计算胁迫后的增长量。淹水结束后整株取样,将其解剖分成根、茎、叶3 部分,茎、叶放入烘箱(WHL-125B,天津)中烘至恒重并称量(精确至0.1 mg);洗净根系后用MICROTEK 扫描仪(MRS-9600TFU2L,上海)对根系进行扫描,生成的图片用LA-S根系分析软件计算,得到总根长度等根系形态数据,扫描后的根系装进牛皮纸袋(长9 cm,宽5.5 cm,高10 cm)放入烘箱烘干。

式(1)中:H1、D1分别为淹水开始时苗高、地径;H2、D2为淹水结束时苗高、地径。

1.3.2 叶片相对含水量和比叶重的测定 叶片相对含水量用浸泡烘干法测定。比叶重:把叶片放入MICROTEK 扫描仪内结合标准尺进行扫描,输出形成图片,用ImageJ v1.8.0软件测量得到单叶叶片面积,把叶片烘至恒重,后称干重。比叶重(g/m2)=叶片干重(g)/叶片面积(m²)。
1.3.3 叶片SPAD值和叶片光合气体交换参数的测定 用SPAD-502便捷式叶绿素测定仪(KONICA MINOLTA,Japan)测福建山樱花叶片SPAD值,在每片叶基部开始20%~80%区域主脉两侧共读取6个读数,取平均值。在测定SPAD 值的同时,进行原位测定叶片光合气体交换参数。用Li-6400 便捷式光合作用测定仪(Li-cor,USA)于09:00—11:30 测植株叶片的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr),每片叶片记录3 个瞬时光合值,设置光强为1 200µmol/(m2·s),相对湿度为60%~65%。瞬时水分利用效率WUEinst=Pn/Tr;气孔限制值Ls=1-Ci/Ca,Ca为环境中CO2浓度。
1.4 数据处理与分析
测完所有指标后,用Excel 2010 软件进行数据录入、整理以及图表的制作,用SPSS 22.0 软件进行单因素方差,并用Duncan检验法进行多重比较。图表中的数据以平均值±标准差表示。
2 结果与分析
2.1 幼苗生长和生物量分配的变化
2.1.1 幼苗生长 从表1可知,淹水胁迫下福建山樱花苗高增长量和地径增长量均小于CK,且苗高增长量与CK 差异显著(P<0.05),而地径增长量未达显著水平(P>0.05)。苗高增长量由大到小依次为CK,T1,T2,T3;T1、T2和T3的地径增长量较CK分别降低3.70%,11.11%,22.22%。说明淹水胁迫抑制福建山樱花幼苗的生长时还对其造成了萎蔫。
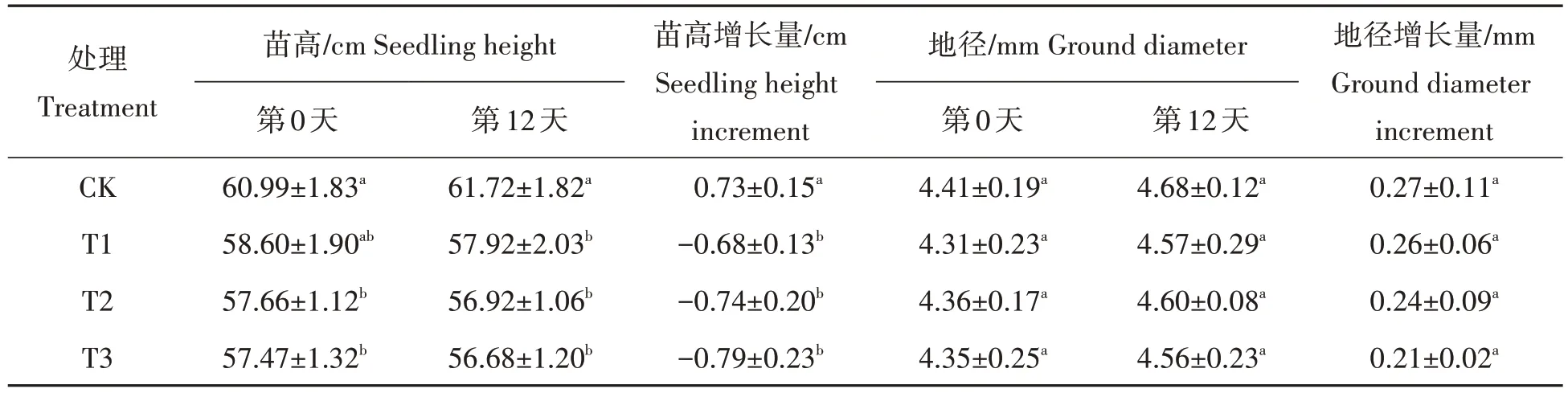
表1 福建山樱花幼苗淹水胁迫下苗高和地径的变化Tab.1 Comparison of height and ground diameter of the C.campanulata seedlings under different flooding stress
2.1.2 生物量积累和分配 从图1I 可知,随着淹水程度增加,福建山樱花幼苗地下生物量和总生物量逐渐下降;值得注意的是,T1、T2 和T3 组地上生物量均比CK 组大,且它们的大小依次为T1,T2,T3,CK。
植物不同器官生物量的分配比率可以作为判断植物对胁迫适应性的指标[15]。由图1Ⅱ可知,淹水胁迫对根重比产生了显著影响(P<0.05),而对叶重比和茎重比影响不显著(P>0.05),表明不同器官对淹水胁迫的敏感程度不同。CK 组根重比最大(48.22%),生物量分配大小表现为根,茎,叶;而胁迫组茎重比占总生物量的比值较大,即T1、T2、T3 的生物量主要分配在茎上。且T1、T2、T3 组的地上器官生物分配比率较CK 均增加,而地下生物分配比则下降,说明福建山樱花在淹水胁迫下减少了对根生物量的投资,增加对地上器官的投资。T1、T2 和T3 组的根冠比均显著低于CK(P<0.05)(图1Ш),与CK相比分别降低了27.57%、27.29%、37.56%,表明根的生物量向茎、叶转移,更少的营养物质分配到地下器官。
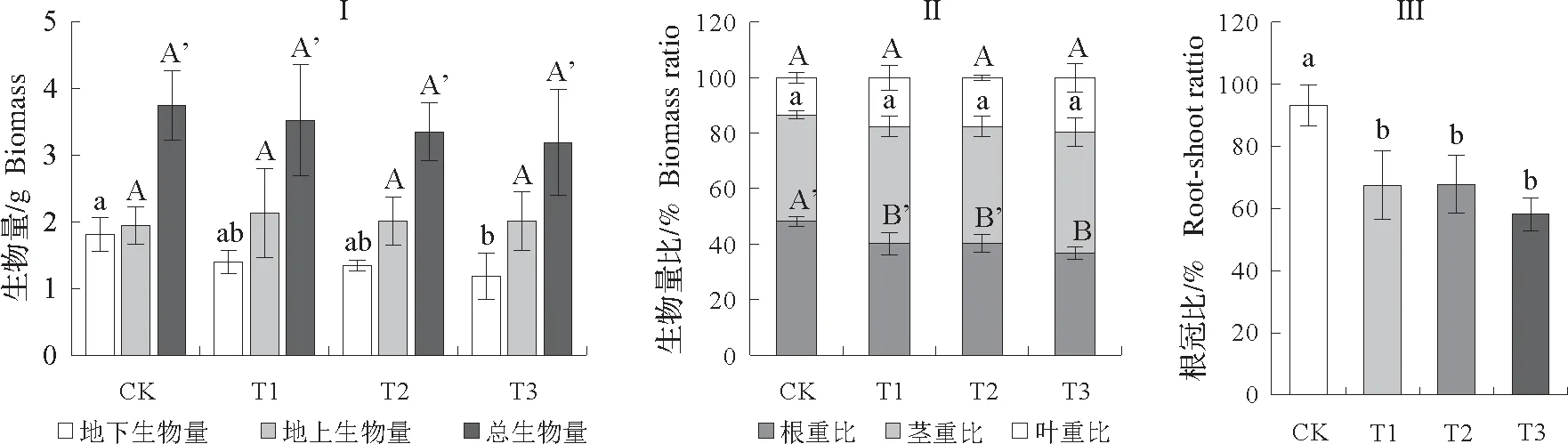
图1 福建山樱花幼苗淹水胁迫下生物量(Ⅰ)、生物量比(Ⅱ)和根冠比(Ш)的变化。Fig.1 Comparison of biomass(Ⅰ),biomass distribution(Ⅱ)and root-shoot ratio of biomass(Ш)for C.campanulata seedlings under different flooding stress
2.2 根系形态的变化
淹水胁迫下福建山樱花幼苗根体积与CK 无显著差异(P>0.05),但总根长、根表面积、根平均直径和根尖数与CK差异显著(P<0.05)(表2),淹水胁迫下的总根长、根表面积、根体积、根平均直径和根尖数均小于CK,其中总根长较CK 下降了11.68%,27.47%,40.16%。表明淹水胁迫对福建山樱花幼苗根系生长有抑制作用。
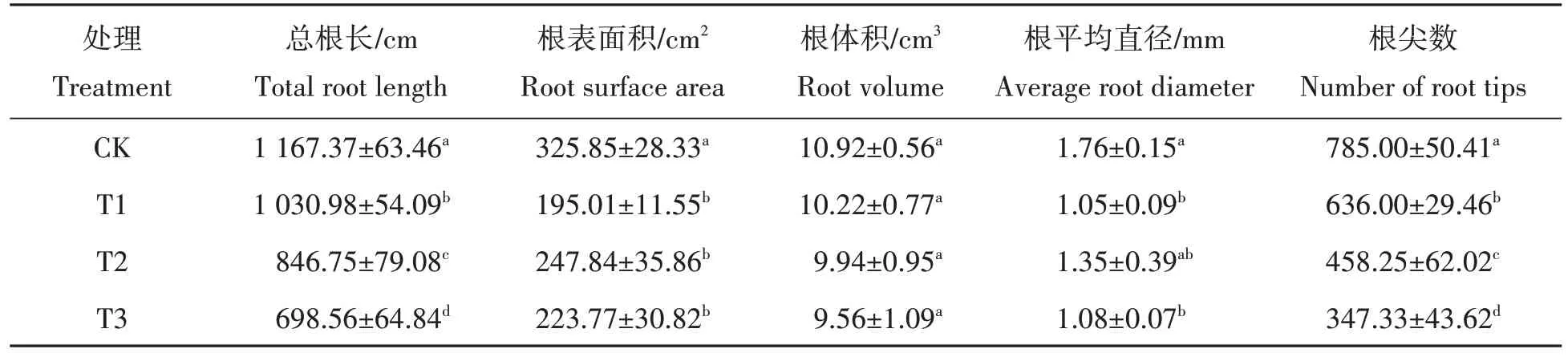
表2 福建山樱花幼苗淹水胁迫下根系形态的变化Tab.2 Comparison of root morphology of the C.campanulata seedlings under different flooding stress
2.3 叶片相对含水量的变化
由图2I可知,淹水3 d叶片相对含水量变化不大,但随着时间延长叶片相对含水量逐渐下降;第12天时,T1、T2、T3组分别比CK下降3.22%,12.86%,23.33%。说明短时间的胁迫对福建山樱花幼苗叶片相对含水量影响不大,而长时间的胁迫会降低植物活力和水分运输能力,导致叶片含水量降低。

图2 福建山樱花幼苗淹水胁迫下叶片相对含水量(I)和比叶重(II)的变化Fig.2 Comparison of relative water content(I)and specific leaf weight(II)of the C.campanulata seedlings under different flooding stress
2.4 比叶重的变化
比叶重是单位叶面积的叶片干重,在一定程度上反映叶片截获光的能力[16-17]。由图2II可知,在正常管理下(CK),比叶重几乎不变,但在各个处理阶段均低于胁迫组(P<0.05),由大到小依次为:T3、T2、T1、CK。淹水3 d,T1、T2 和T3 较CK 分别上升了8.14%,13.46%,17.23%;当淹水时长到12 d 时,T1、T2 和T3的比叶重达到最大值,较CK 分别上升了22.30%,22.33%,31.57%。说明淹水时长越长、水位梯度越高,比叶重受到的影响越大。
2.5 叶片SPAD值的变化
SPAD 值常被用来代表植物相对叶绿素含量[18]。图3可知,在正常管理下(CK 组),SPAD 值呈上升趋势;而T1组SPAD值呈先上升后下降的趋势;T2和T3表现为逐渐降低的趋势。第12天时,T1、T2和T3组SPAD值与CK相比分别降低了6.14%,11.74%,18.86%。

图3 福建山樱花幼苗淹水胁迫下SPAD值的变化Fig.3 Comparison of SPAD value of the C.campanulata seedlings under different flooding stress
2.6 叶片光合气体交换参数和瞬时水分利用效率的变化
2.6.1 净光合速率(Pn)的变化 由图4I可知,从胁迫开始,Pn随着淹水程度的加重及时间的延长不断降低,胁迫组Pn始终低于CK 组(P<0.05),淹水胁迫显著地抑制了福建山樱花幼苗叶片的Pn。淹水结束时,T1、T2和T3组的Pn与CK相比分别下降了64.21%,86.34%,91.53%。
2.6.2 气孔导度(Gs)的变化 气孔导度的大小反映植株光合作用中CO2的吸收和蒸腾过程中水分的流失。由图4II 可知,Gs的变化趋势与Pn的变化趋势相似。淹水第3 天时,与CK 相比,胁迫组的Gs明显下降,胁迫程度越大,下降幅度越大。第12 天时,T1、T2 和T3 的Gs比CK 组分别降低77.78%,87.65%,88.89%,其中T2和T3组Gs趋近于0。
2.6.3 胞间CO2浓度(Ci)的变化 胞间CO2浓度的大小可判断植株光合作用的强弱。由图4III 可知,在淹水胁迫下,Ci呈先减小后增大的趋势,CK 组无显著差异。第3 天时,T1、T2、T3 分别较CK 组下降了20.47%,22.38%,22.92%;胁迫至第6 天出现转折,Ci呈现上升趋势;第12 天时,T2 和T3 组Ci显著高于CK,上升到整个淹水过程中的最大值,分别为371.48和401.54µmol/mol。
2.6.4 蒸腾速率(Tr)的变化 蒸腾速率的大小反映植株生命活动的强弱。从图4IV可知,淹水过程中,福建山樱花幼苗Tr逐渐下降;而CK 组的Tr则较为稳定,保持在0.94~1.19µmol/(m2·s)。T3组Tr下降幅度最大,T1组Tr下降幅度最小。第12天时,T1、T2和T3组的Tr与CK相比分别下降了76.79%,84.82%,86.61%。
2.6.5 气孔限制值(Ls)和瞬时水分利用效率(WUEinst)的变化 由图4 V可知,随着淹水时间的延长,T1、T2 和T3 组气孔限制值(Ls)存在先上升后下降的趋势。淹水6 dLs 达到最大值,但当淹水时长继续增加时Ls逐渐下降,其中T3处理下降幅度最大,淹水12 d时Ls较CK下降了30.24%。
瞬时水分利用效率(WUEinst)是判断碳同化能力与水分消耗之间的关系。由图4VI可知,淹水胁迫下WUEinst总体呈先上升后下降的趋势,在不同淹水处理下均与CK差异显著(P<0.05)。第3天时,淹水越严重WUEinst值越大,随后开始逐渐下降,试验结束后,T1较CK 上升了51.34%,T2和T3相比CK 分别下降了12.62%和39.66%。
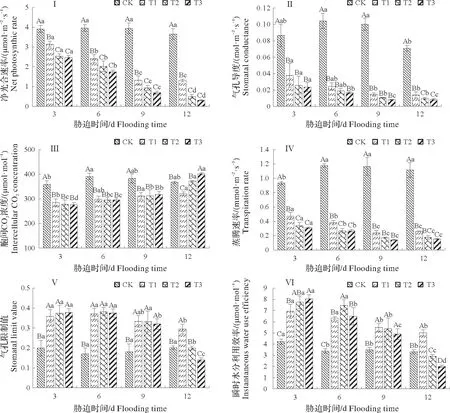
图4 福建山樱花幼苗淹水胁迫下叶片的净光合速率(I)、气孔导度(II)、胞间CO2浓度(III)、蒸腾速率(IV)、气孔限制值(V)和瞬时水分利用效率(VI)的变化Fig.4 Variations of net photosynthetic rate(I),stomatal conductance(II),intercellular CO2 concentration(III),transpiration rate(IV),stomatal limit value(V)and instantaneous water use efficiency(VI)of the C.campanulata seedlings under different flooding stress
3 讨论与结论
3.1 淹水胁迫对福建山樱花幼苗生长和生物量分配以及根系形态的影响
判断植物抗逆能力最直接的方法是测量植物的生长指标(苗高、地径等)。在试验中,不同淹水处理对苗高增长量有显著影响,对地径增长量影响差异不显著,淹水胁迫抑制了植株的生长,这种现象在美洲黑杨(Populus deltoides)[19]和桐花树(Aegiceras corniculatum)[20]也有类似的报道。
植物生物量在各器官间的分配反映了不同的生存策略,当植物处于不良环境时可以通过不断调整地上和地下生物量的分配关系来适应环境的变化,以应对逆境对其造成的伤害或将伤害降到最低[21-22]。在本试验中,淹水胁迫抑制福建山樱花幼苗地上和地下器官的生长,且对地下器官抑制更显著(图1I),这与淹水胁迫下乌桕(Sapium sebiferum)[23]的研究结果是一致的。总生物量下降表现为降低地下生物量,在一定程度上增加了地上生物量的积累(图1II),这与Kleyer等[24]的说法基本一致,植物处在逆境时会增加对某一器官的生物量投入,同时会减少对其他器官的投入。福建山樱花将生物量向地上器官转移正是以牺牲根的生物量来实现的,这可能是福建山樱花应对胁迫环境的一种策略。此外,不能排除地下生物量分配比率的降低是地下相对地上部分生长较慢导致的可能。
淹水阻碍了植物根系与氧气的接触,有氧呼吸转变为无氧呼吸,产生乙醇、乙酸等有害物质[25],使根系生长受抑,从而引起根变短、细或死亡[26-27]。淹水过程中福建山樱花根长度变短,根直径变细,根体积和表面积减小(表2),这与玉米(zea mavs)[28]和荞麦(Fagopyrum esculentum)[29]在淹水胁迫下的反应相似。土壤中含氧量越低,根系受到的抑制作用更显著。
3.2 淹水胁迫对福建山樱花幼苗叶片水分比重的影响
植物叶片相对含水量反映植物叶片水分平衡[30]。随着淹水时间的增加,福建山樱花叶片相对含水量持续下降,且胁迫程度加重,下降幅度加大(图2I)。相似的淹水胁迫也会造成其他植物叶片相对含水量下降,如华北紫丁香(Syringa oblata)[31]。
比叶重表示植物叶片构建中对资源的投入程度,植物具有较高的比叶重说明在逆境中具有较强的适应能力,反之比叶重较低,适应性则较弱[32-33]。由此可见,增加比叶重是植物对逆境的一种响应机制。本试验中,淹水胁迫程度(包括淹水时间和水位)越严重,比叶重上升越多(图2II),说明福建山樱花在淹水胁迫中,也有相同的应对机制。Poorter 等[34]认为比叶重高的植物具有高的叶片密度,而且高比叶重的植物含有较多的结构性物质,内含物较少。植物可能通过这种策略将能量用于维持生命,而减缓其他代谢过程。
3.3 淹水胁迫下福建山樱花幼苗光合作用的变化
淹水胁迫会打破植物叶绿素的合成与分解动态平衡,使植物体中叶绿体合成叶绿素的能力降低[35]。本试验中,SPAD 值在淹水初期(淹水3 d)出现小幅上升,说明在胁迫初期植株启动了应激反应,而这种应激反应在植物界可能具有普遍性,这种现象在桐花树A.corniculatum[20]也出现过。然而,随着胁迫时间的延长,SPAD 值随之降低,可能是无氧呼吸使大量自由基积累而破坏了叶绿体结构[36];有可能是合成叶绿素相关的酶活性降低而导致SPAD值降低[37]。
导致光合作用下降的因素有非气孔限制和气孔限制[38]。在多数情况下植物受到单一外界胁迫时,随着胁迫程度加剧,影响光合作用的因子由气孔限制逐渐转变为非气孔限制[39]。Farquhar 等[38]认为判断Pn下降的指标有:Ci和Ls。如果Pn和Ci同时下降时,而Ls上升,说明Pn的减少是由气孔限制引起的;如果Pn下降,Ci上升,Ls下降,说明非气孔限制是Pn减少的主导因素。在本试验中,淹水胁迫下福建山樱花幼苗Pn、Gs、Tr值逐渐降低,Ci先下降后升高,而Ls先上升后下降,这可以说明福建山樱花在淹水初期Pn下降是气孔限制导致的,细胞呼吸产生的CO2因气孔开度变小无处排放而在胞间积累;淹水6 d后Pn下降则是由非气孔限制所致。这与滇楸(Catalpa fargesiiBur.f.duclouxii)[40]、湿地松(Pinus elliottii)[41]和风箱果(Physocarpus amurensis)[42]等在淹水胁迫下的表现相似。
植物的光合作用和蒸腾作用之间的平衡关系影响着WUEinst,而这种平衡关系受Gs的影响。在本试验中,WUEinst达到最大值(淹水3 d),而此时Tr的下降幅度大于Pn,表明此时是因为气孔开度变小,降低蒸腾速率来提高WUEinst,以适应淹水环境,对水竹(Phyllostachys heteroclada)[43]的研究也有类似的规律。然而随着淹水胁迫加剧,WUEinst不断下降,这是由于非气孔限制的出现,光合速率明显下降。
综合分析本试验结果得知,在生长和叶片水分比重方面,福建山樱花幼苗可以通过采取相应的策略来抵抗逆境,如根系生长缓慢,增大地上器官的生物量,增加比叶重。在光合响应上,福建山樱花在应对短时间的淹水胁迫首先采取“应激反应”,应激反应促使光合色素含量上升,从而快速降低Ci;在淹水胁迫强度增加到一定程度时,“应激反应”消失,受非气孔限制Pn逐渐下降。
致谢:湖南省林业科技创新专项项目(XLK201947)同时对本研究给予了资助,谨致谢意!
