FTO通过m6A调节c-MYC/CD47/PD-L1通路调控胃癌免疫微环境及预后预测①
2022-10-07鹏孙洋三亚市人民医院肿瘤外科三亚572000
杨 曦 高 鹏孙洋(三亚市人民医院肿瘤外科,三亚 572000)
胃癌是世界上最常见恶性肿瘤之一,其病死率在所有恶性肿瘤中位居第三,仅次于肺癌和肝癌[1-2]。中国的胃癌发病率和病死率在所有恶性肿瘤中位居第二[3]。由于早期缺乏特异性症状和胃镜检查,多数患者在初诊时已处于晚期[4]。近60%手术患者会出现复发或远处转移,其中位总生存期(overall survival,OS)不超过12个月[4]。胃癌患者预后较差的另一个原因是缺乏靶向药物且现有靶向药物均存在一定局限。虽然曲妥珠单抗联合化疗可提高患者OS,但仅有约20%患者过表达HER2,限制了曲妥珠单抗的应用范围[5-7]。贝伐珠单抗也仅能提高无进展生存期和非亚裔患者OS[8]。雷莫芦单抗联合紫杉醇仅能用于二线治疗[9]。非小细胞肺癌等其他肿瘤中取得突破性进展的免疫治疗对胃癌疗效仍然欠佳,帕博利珠单抗在二线治疗中单药并不优于紫杉醇,纳武单抗也仅可用于三线及后期治疗[10-11]。因此,阐明胃癌发生、发展的分子机制对早期诊断、开发新的治疗靶点,更好改善胃癌患者的生存时间和质量具有重要意义。
N6-甲基腺苷(N6-methyladenosine,m6A)是真核生物最常见RNA修饰方式之一,广泛存在于mRNA、长链非编码RNA、环状RNA[12-14]。参与m6A修饰调控的蛋白大致可分为三类:m6A甲基化酶,包括METTL3、METTL14、WTAP等[15-17];m6A去甲基化酶,包括FTO、ALKBH5等[18-19];m6A识别蛋白,包括YTHDC1/2、YTHDF1/2/3等[20-24]。m6A修饰在包括胃癌在内的多种实体瘤中具有重要调控作用[25-27]。FTO在急性髓系白血病、乳腺癌、黑色素瘤、肺癌等恶性肿瘤中具有重要调节作用[28-31]。FTO在胃癌中的作用仅有少量报道,其具体作用机制尚未明确[32]。因此,本研究拟分析FTO在胃癌中的表达及其表达与预后、临床病理学特征的关系,进一步证实FTO表达对肿瘤微环境中免疫细胞浸润的调节机制。
1 材料与方法
1.1 材料BGC和SGC细胞系(上海中科院细胞库);m6A检 测 试 剂 盒(ab185912)、FTO一 抗(ab126605,Abcam公司);靶向人源FTO的siRNA、siRNA转染相关试剂(Santa Cruz);蛋白提取试剂盒(P0013,碧云天);抗FTO、c-MYC、CD47、PD-L1、GAPDH一抗抗体(Cell Signaling Technology);对应抗兔、鼠二抗(Affinity)。
1.2 方法
1.2.1 FTO在胃癌及癌旁组织中的差异表达分析采用TCGA在线分析工具GEPIA(http://gepia.cancer-pku.cn/)分析FTO在胃癌及癌旁组织中的差异表达。
1.2.2 TCGA及GEO数据库分析采用cbioportal下载TCGA胃癌数据库,根据FTO mRNA表达,等于或高于中位值为高表达,低于中位值为低表达。在R Studio中采用“survival”和“survminer”程序包绘制生存曲线,Log-Rankt检验分析两组生存期有无差异。采用TCGA胃癌数据分析FTO表达与临床病理学特征的关系,分组方法同上,方差分析或Fisher确切概率法分析差异有无统计学意义。采用GEO在线工具K-M Plotter(http://kmplot.com/analysis/)分析FTO表达与PFS、OS的关系,根据FTO mRNA表达,等于或高于中位值为高表达,低于中位值为低表达。在TCGA-STAD队列应用基因富集分析FTO下游调节通路,采用SPSS19.0软件进行差异分析。
1.2.3 胃癌患者数据分析收集2011年至2016年进行胃癌手术且经病理证实为胃癌的87例患者临床资料并进行随访,统计无病生存期(disease free survival,DFS)和OS。胃癌患者石蜡包埋的手术标本切片,脱蜡,EDTA抗原修复,加入FTO一抗孵育,免疫组织化学染色阴性(-)或弱阳性(+)为低表达组,中阳性(++)或强阳性(+++)为高表达组。Log-Rank检验分析两组生存期有无差异,方差分析或Fisher确切概率法分析差异有无统计学意义。
1.2.4 细胞培养及转染采用RPMI1640培养基+10%胎牛血清培养BGC和SGC细胞系。按照靶向人源FTO的siRNA及转染相关试剂说明书进行转染。
1.2.5 总RNA m6A水平检测SGC细胞转染FTO siRNA或对照siRNA后,采用TRIzol提取总RNA,根据m6A检测试剂盒说明书,利用分光光度法检测总RNA m6A水平。
1.2.6 Transwell迁移实验将转染48 h的细胞用无血清培养基重悬至1×105个/100µl,接种至含24孔板的Transwell小室上室,下室加入600µl含10%胎牛血清的培养基,48 h后取出Transwell小室,甲醇固定30 min,0.1%结晶紫染色,PBS洗净后显微镜下拍照计数。
1.2.7 克隆形成实验将转染48 h的细胞用无血清培养基重悬至50个/ml,在6孔板中加入100个细胞。14 d后甲醇固定30 min,0.1%结晶紫染色,PBS洗净后计算克隆数。
1.2.8 Western blot BGC细胞转染siRNA 48 h后,加入RIPA裂解液裂解,离心,BCA测定蛋白浓度,取35µg蛋白,凝胶电泳分离,转膜,5%BSA封闭2 h,加入抗FTO、c-MYC、CD47、PD-L1、GAPDH 4℃孵育过夜,工作液浓度均为1∶1 000稀释,洗膜,加入二抗室温孵育2 h,洗膜3次后与发光液ECL反应,以β-actin为内参,分析目的蛋白条带相对表达。
2 结果
2.1 胃癌及癌旁组织中FTO表达采用TCGA数据库分析工具GEPIA对比胃癌及癌旁组织中FTO表达,结果显示FTO在胃癌组织中呈高表达(P<0.05,图1)。
2.2 TCGA胃癌数据库中FTO表达与预后的关系为进一步探讨FTO表达与胃癌患者预后的关系,课题组在TCGA胃癌数据库中将所有胃癌患者按FTO mRNA表达分为高、低两组,分别绘制了DFS和OS的K-M生存曲线,结果发现:FTO高表达患者中位DFS更短(HR=1.75,95%CI:1.14~2.70,P=0.011 2,图2A),中位OS也更短(HR=1.7,95%CI:1.19~2.42,P=0.003 5,图2B)。
2.3 GEO数据库中FTO表达与胃癌患者预后的关系在GEO数据库中进一步验证FTO表达和预后的关系,下载GEO数据库GSE14210、GSE15459、GSE22377、GSE29272、GSE51105、GSE62254等数据集,按FTO mRNA表达分为FTO高表达和FTO低表达组,分别计算中位无进展生存期(progression free survivals,PFS)和中位OS并绘制K-M生存曲线,结果显示:FTO mRNA高表达胃癌患者中位PFS更短(HR=1.59,95%CI:1.30~1.95,P<0.000 1,图3A),中位OS也更短(HR=1.51,95%CI:1.27~1.79,P<0.000 1,图3B)。
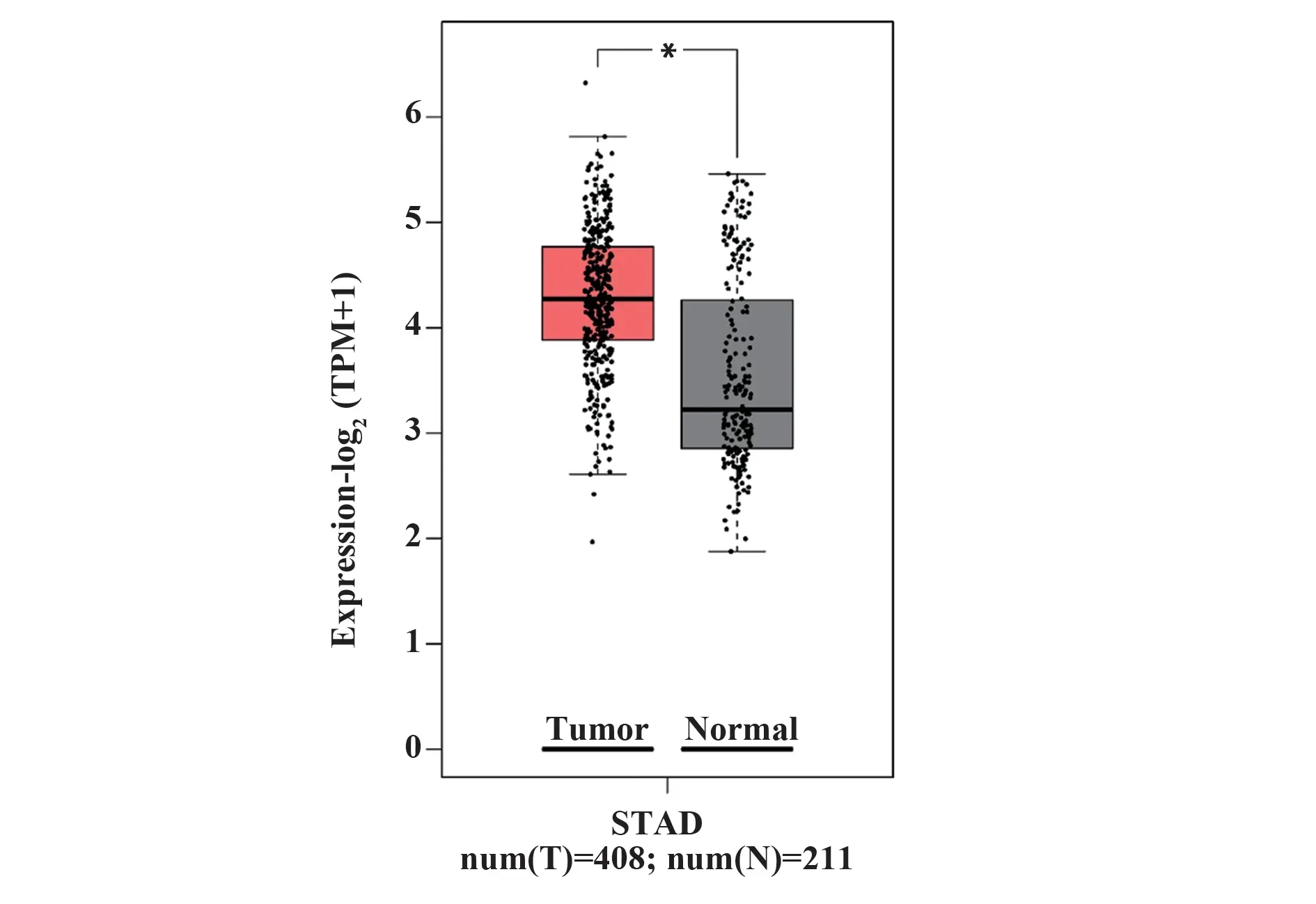
图1 TCGA STAD队列中肿瘤组织FTO表达高于正常组Fig.1 Tumor FTO expression was higher than normal in TCGA STAD cohort

图2 TCGA中胃癌患者DFS/OS与FTO表达的关系Fig.2 Associations of DFS/OS and FTO expression of gastric cancer patients in TCGA
2.4 FTO表达与胃癌患者预后的关系临床研究收集87例胃癌患者手术标本进行免疫组化染色,按免疫组化染色强度分为FTO高表达(++或+++)和低表达(-或+)组,计算两组中位DFS和中位OS并绘制K-M生存曲线,结果显示:FTO高表达组患者中位DFS更短(HR=3.18,95%CI:1.76~5.75,P=0.000 1,图4A),中位OS也更短(HR=1.72,95%CI:1.03~2.87,P=0.037 1,图4B)。
2.5 TCGA数据库中FTO表达与病理学特征的关系TCGA数据库中FTO表达与临床病理学特征的关系分析发现,胃癌中FTO高表达和性别、M分期无关,与年龄(P=0.001 0)、T分期(P=0.000 5)有关,与N分期无关(P=0.051 7,表1)。
2.6 FTO表达与病理学特征的关系临床研究进一步分析87例胃癌患者FTO表达与临床病理学特征的关系,发现胃癌中FTO高表达和性别、年龄、M分期、分化无关,与T分期(P=0.005 6)、脉管侵袭(P=0.034 6)相关,与N分期无关(P=0.063 9,表2)。
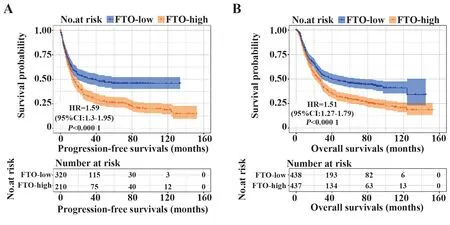
图3 GEO中胃癌患者PFS/OS与FTO表达的关系Fig.3 Associations of PFS/OS and FTO expression of gastric cancer patients in GEO
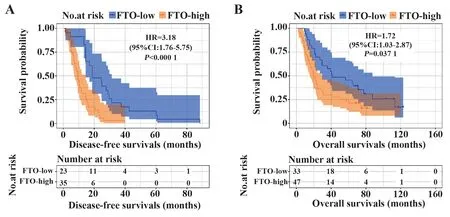
图4 87例胃癌患者DFS/OS与FTO表达的关系Fig.4 Associations between DFS/OS and FTO expression in 87 gastric cancer patients
2.7 FTO在胃癌中的调节作用为寻找FTO在胃癌中的具体调节作用,在TCGA-STAD队列中采用GSEA寻找FTO下游调节通路,结果显示,多个肿瘤相关通路在FTO高表达的通路中富集,包括E2F通路、氧化磷酸化通路、MYC通路等(图5A)。鉴于两个MYC相的基因集均被富集,课题组选择MYC作为FTO潜在调节靶标进行后续实验。在BGC细胞系中用siRNA敲低FTO表达后检测总RNA m6A水平变化,结果显示:相较于对照组,siRNA组总RNA m6A水平明显降低(P=0.006 6,图5B)。Transwell迁移实验中,敲低FTO表达显著抑制了BGC细胞和SGC细胞迁移(P<0.01,图5C)。克隆形成实验中,FTO siRNA组较si-control组克隆形成数明显减少(P<0.01和P<0.001,图5D)。Western blot实验表明,敲低FTO表达后,c-MYC表达降低,CD47和PD-L1表达也降低(图5E)。
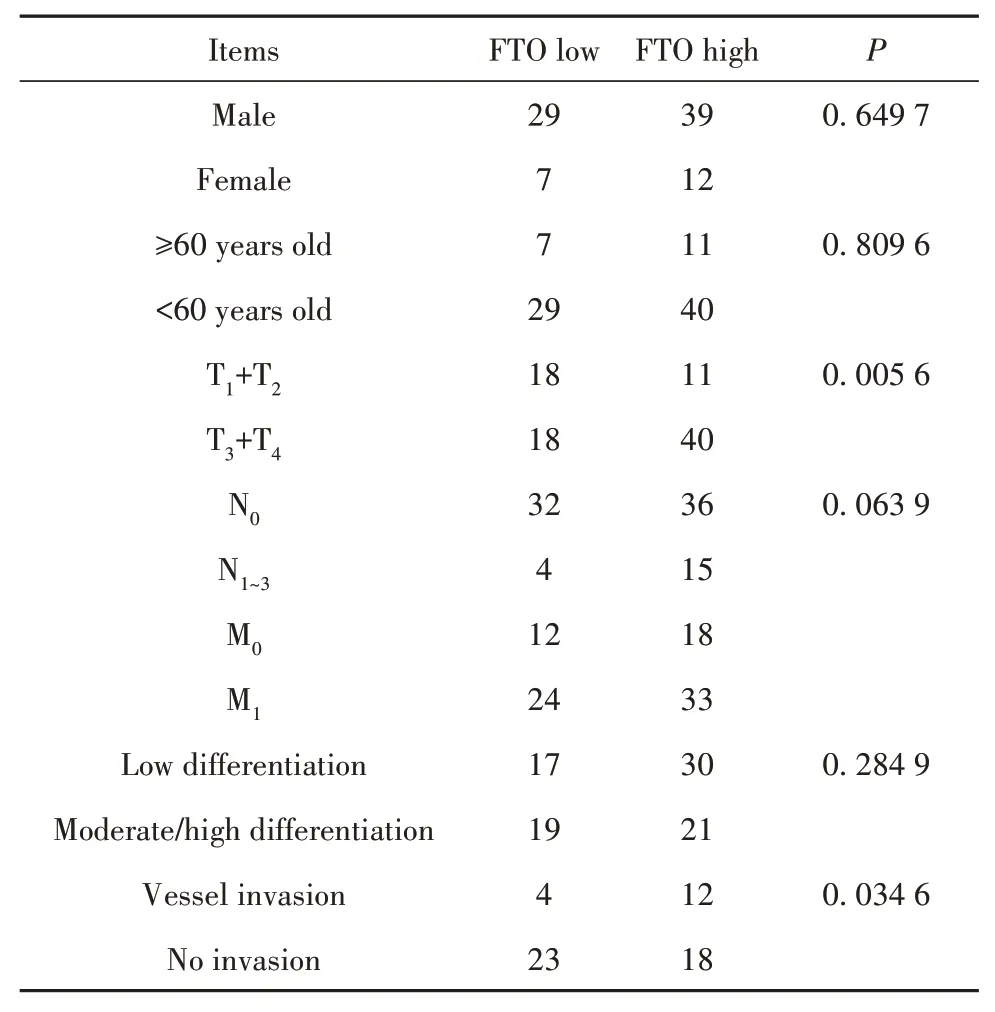
表2 FTO表达与临床病理特征的关系Tab.2 Relationships between FTO expression and clinical pathological features
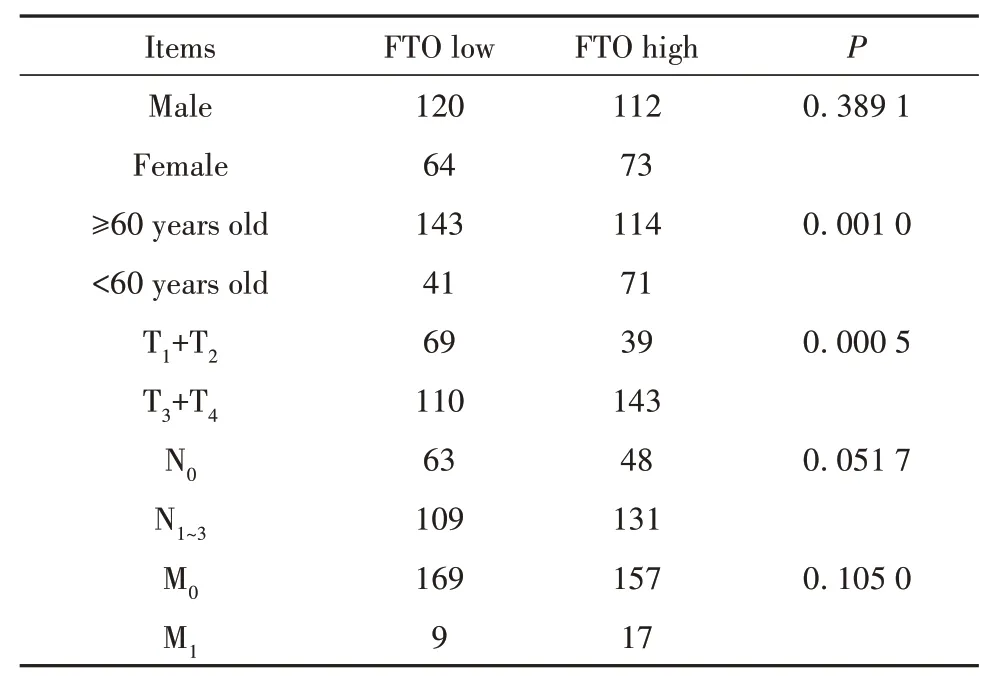
表1 FTO表达与临床病理特征的关系Tab.1 Relationships between FTO expression and clinical pathological features
2.8 FTO表达和免疫微环境的关系采用CIBERSORTx算法对TCGA中胃癌样本进行免疫细胞浸润估算,并按FTO mRNA表达分为FTO高表达和FTO低表达组,对比两组免疫细胞浸润发现,FTO高表达组naïve B细胞、记忆性B细胞、单核细胞、M2型巨噬细胞、非活化的肥大细胞更多(P<0.05),FTO低表达组活化的肥大细胞、活化的NK细胞、调节性T细胞、滤泡辅助性T细胞更多(P<0.05,图6)。
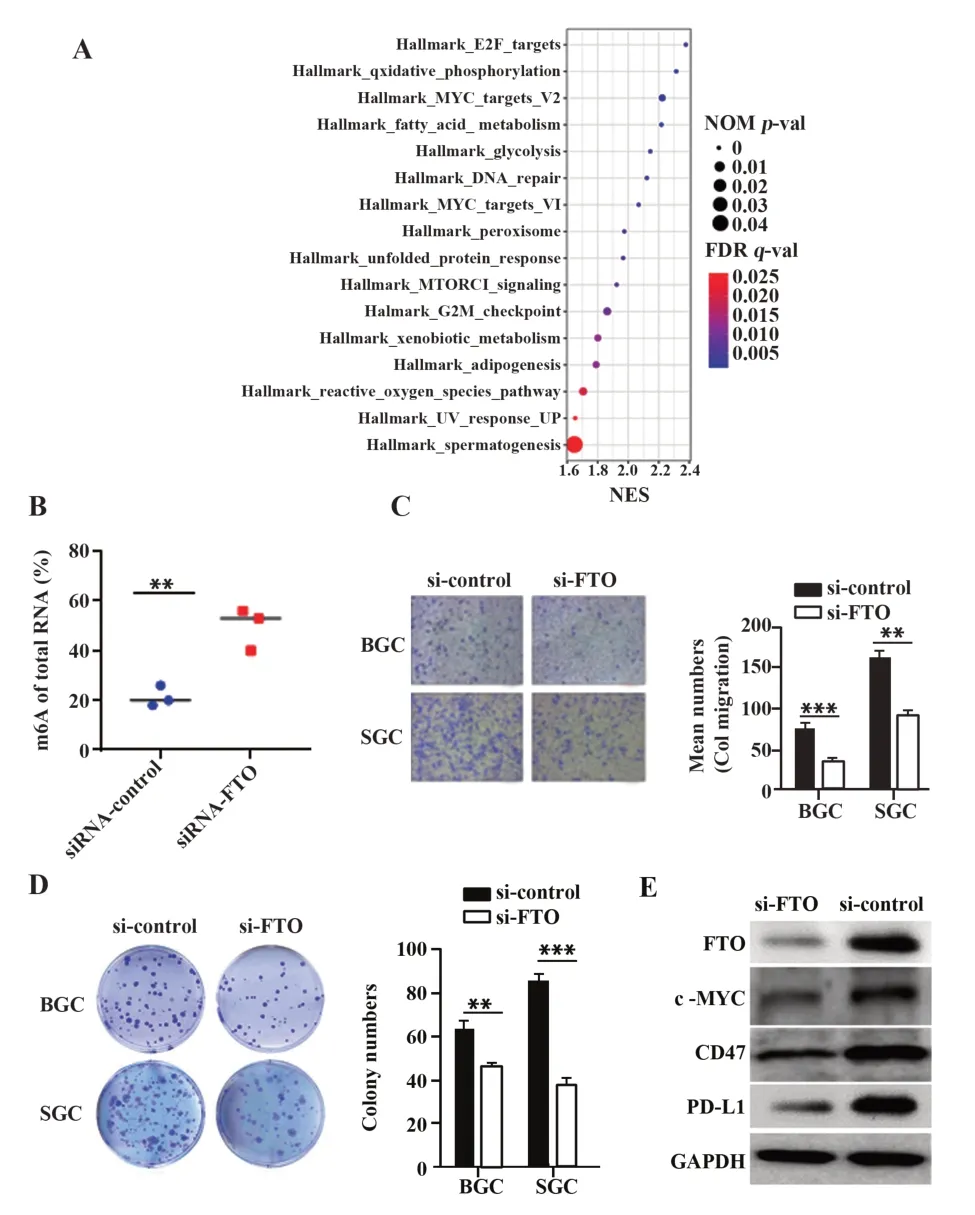
图5 FTO通过调节m6A修饰调节MYC-CD47/PD-L1通路Fig.5 FTO regulates MYC-CD47/PD-L1 pathway by regulating m6A modification

图6 FTO表达与免疫细胞浸润的关系Fig.6 Relationship between FTO expression and immune cell infiltration
3 讨论
本研究表明,FTO在胃癌中高表达,且FTO高表达与更差的DFS、PFS、OS相关,说明FTO可促进胃癌发生发展。FTO表达与临床病理学特征的关系表明,FTO表达与T分期相关,无论是在TCGA数据库中还是本研究队列中,FTO表达与N分期相关性的P均>0.05,但非常接近0.05(分别为0.051 7和0.063 9),说明FTO表达和淋巴结转移可能相关。另外,本研究队列中FTO表达与脉管侵袭相关,也表明FTO表达可能与转移有关。
GSEA表 明,c-MYC是FTO的 潜 在 调 节 靶 标。本研究表明,FTO可通过m6A的方式调节c-MYC表达。研究表明,c-MYC可通过结合肿瘤细胞中的CD47/PD-L1启动子区促进其表达,进而调节肿瘤免疫微环境和抗肿瘤反应[33]。本研究表明,FTO可通过c-MYC调节CD47/PD-L1表达,进而调节免疫微环境。
肿瘤免疫微环境在肿瘤发生发展过程中起关键作用,肿瘤中浸润的免疫细胞与肿瘤细胞作用直接决定肿瘤发生发展及各种治疗措施(尤其是免疫治疗)的疗效。因此,研究肿瘤细胞对肿瘤免疫微环境的影响对进一步研究肿瘤发生发展的机制和开发新的治疗靶点具有重要意义。本研究通过CIBERSORTx算法进一步验证FTO与肿瘤免疫微环境的关系,结果表明,FTO表达与多种免疫细胞浸润相关,表明FTO通过调节c-MYC/CD47/PD-L1表达调控肿瘤免疫微环境。
综上,本研究表明FTO在胃癌中表达升高且与更差的DFS、PFS、OS、T分期、脉管侵袭等相关。FTO通过其RNA去甲基化酶功能调节c-MYC/CD47/PD-L1表达,进而调控肿瘤免疫微环境。因此,FTO具有成为筛查诊断、判断预后的生物标志物及新的候选靶点研发胃癌治疗药物的潜在价值。
