沉默miR-8063促进结直肠癌细胞获得多药耐药性及机制研究①
2022-10-07陈正权文坤明遵义医科大学附属医院普通外科遵义563003
袁 涛 王 林 陈正权 文坤明(遵义医科大学附属医院普通外科,遵义 563003)
结直肠癌(colorectal cancer,CRC)是世界第三大恶性肿瘤,也是导致癌症相关死亡的第二大原因[1]。以化疗为主的综合治疗是复发及转移性结直肠癌的主要治疗手段。随着化疗方案逐渐完善,越来越多化疗药物在临床上被广泛使用,而化疗过程中对这些化疗药物产生的多药耐药(multidrug resistance,MDR)成为化疗失败的主要原因之一[2]。因此,深入研究产生耐药性的潜在机制并寻求针对性治疗靶点,对提高CRC生存率及改善预后具有重要意义。本课题组前期研究已证实Oct4B1作为一种癌基因能够促进CRC细胞对奥沙利铂的耐药性[3]。为研究Oct4B1调控CRC耐药性的分子机制,课题组采用miRNA芯片筛选出与Oct4B1表达趋势相反的miRNA,并从中找到表达差异最为显著的miR-8063,推测miR-8063可能作为一种抑癌基因在调节CRC耐药性中发挥重要作用。本研究采用慢病毒介导的RNA干扰(RNAi)技术在CRC细胞SW480、HT29中沉默miRNA-8063基因,观察沉默miRNA-8063是否能够促进CRC细胞获得MDR,并探讨其分子机制是否与激活WNT/β-catenin信号通路有关。
1 材料与方法
1.1 材料人结CRC细胞系SW480、HT29购自上海中科院细胞库;沉默miR-8063慢病毒载体(miR-8063-inhibitor-GFP-PURO)及阴性对照病毒(NCGFP-PURO)委托上海汉恒生物科技有限公司构建;培养SW480细胞的L-15培养基、培养HT29细胞的5A培养基及胎牛血清(FBS)购自美国HyClone公司;2.5%胰酶、细胞全蛋白提取试剂盒和BCA蛋白浓度测定试剂盒购自上海碧云天生物技术公司;RT-qPCR试剂盒和逆转录试剂盒购自大连宝生物工程有限公司;CCK-8试剂购自美国MedChemexpress(MCE)公司;奥沙利铂(OXA)和5-氟尿嘧啶(5-FU)购自美国Sigma公司;兔抗人P-gp、ABCG2、WNT3A、WNT5A、β-catenin一抗购自美国Proteintech公司;鼠抗人GAPDH和β-tubulin一抗和辣根过氧化物酶(HRP)标记的羊抗兔/鼠IgG二抗购自北京中杉金桥生物公司。
1.2 方法
1.2.1 慢病毒转染SW480、HT29细胞分别转染沉默miR-8063基因的慢病毒(miR-8063-inhibitor-GFP-PURO)和阴性对照病毒(NC-GFP-PURO)。沉默miR-8063基因慢病毒序列为:5"-UUCGGGGCUGAGGACUAAAACU-3"。转染前1 d将两种细胞用0.25%胰酶消化并按1×105个/孔接种于24孔板;采用阴性对照病毒确定各组细胞转染条件,确定MOI值,根据MOI值计算每孔所需病毒量,病毒体积=(MOI×细胞数目)/病毒滴度,病毒滴度=2×108TU/ml,2.5µl/孔加入Polybrene(2 mg/ml),最后加入对应培养基补充体积至500µl/孔,48 h后更换新鲜培养基,72 h后倒置显微镜下观察荧光并拍照,收集细胞,RT-qPCR鉴定转染病毒后miR-8063基因的沉默效果。
1.2.2 miR-8063基因沉默效果检测转染72 h后,采用RT-qPCR检测两组细胞miR-8063相对表达(以U6为内参,具体步骤见1.2.4),引物由大连宝生物有限公司设计合成,引物序列见表1。
1.2.3 CCK-8检测5-FU和OXA对细胞增殖的影响SW480和HT29细胞消化并计数,以每孔1×104个/100µl接种于96孔板培养24 h,加入0、2、4、8、16、32、64、128µg/ml梯度浓度的5-FU和OXA,室温作用72 h,10µl/孔加入CCK-8溶液,37℃孵育3 h,酶标仪读取每孔450 nm处吸光度(OD)值,计算出药物作用72 h时半数抑制浓度(IC50)。将实验组和对照组细胞按照上述方法接种于96孔板,加入5-FU和OXA(根据上述计算出的IC50加入),设置24 h、48 h和72 h 3个检测点,检测前3 h 10µl/孔加入CCK-8溶液在37℃培养箱内孵育,酶标仪测定450 nm处OD值,每组设3个复孔,实验重复3次,细胞增殖抑制率(%)=(对照组OD值-实验组OD值)/对照组OD值×100%。
1.2.4 RT-qPCR检测耐药基因P-gp、ABCG2 mRNA表达按照说明书采用Trizol试剂提取总RNA,酶标仪测量其浓度。取0.8µg总RNA按照PrimeScript RT reagent Kit试剂盒说明将RNA逆转录为cDNA,SYBR Green染料法进行实时PCR,总反应体积为20µl。反应条件:95℃30 s,95℃5 s,60℃34 s,40个循环;95℃15 s,60℃60 s,90℃15 s。每次检测设3个复孔,实验重复3次。以GAPDH为 内 参,2-ΔΔCt法确定目的基因mRNA表达(引物序列见表1)。
1.2.5 Western blot检测蛋白表达收集细胞,按照蛋白提取试剂盒明书和BCA蛋白浓度测定试剂盒步骤提取蛋白,测定蛋白浓度;取待测样品中40µg总蛋白,根据目的蛋白分子量在相应浓度的凝胶上分离目的蛋白,转至PVDF膜,5%脱脂牛奶室温封闭1 h,将膜与对应一抗稀释液(1∶2 000)4℃孵育过夜,第2天用1×TBST洗涤3次,加入对应的HRP标记羊抗兔/鼠IgG二抗(1∶10 000)室温孵育1 h,1×TBST洗 涤 膜3次,将 膜 置 于ECL发光 液2 min,X射线胶片曝光显现蛋白条带,扫描,Quantity-One软件分析,目的蛋白相对表达=目的蛋白灰度值/内参GAPDH蛋白条带灰度值。
1.3 统计学分析采用SPSS17.0及GraphPad Prism 5.0软件进行统计分析和制图。数据以±s表示,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 慢病毒转染SW480、HT29细胞效果SW480、HT29细胞分别感染miR-8063-inhibitor-GFP-PURO和NC-GFP-PURO,转染72 h后荧光倒置相差显微镜下可见绿色荧光(图1),表明病毒转染成功。
2.2 RT-qPCR检测两组细胞miR-8063表达RTqPCR结果显示,SW480-sh-NC和SW480-sh-miR-8063两组细胞miR-8063表达分别为1.05±0.06和0.40±0.03;而HT29-sh-NC和HT29-sh-miR-8063两组miR-8063表达分别为1.04±0.08和0.23±0.03,与阴性对照组相比,实验组miR-8063表达显著降低(P<0.01,图2)。表明miR-8063在SW480和HT29中被成功沉默。
2.3 CCK-8法检测两组细胞对化疗药物5-FU和OXA的敏感性GraphPad Prism 5.0软件计算出5-FU和OXA两种化疗药物对SW480细胞72 h的IC50分别为52.09和16.20µg/ml,两种药物对HT29细胞72 h的IC50分别为57.59和22.63µg/ml(图3)。24 h、48 h、72 h时5-FU对SW480-sh-NC、SW480-shmiR-8063、HT29-sh-NC、HT29-sh-miR-8063细胞的增殖抑制率分别为(15.86±1.15)%、(13.73±1.53)%、(13.54±0.88)%、(11.23±1.12)%;(29.52±1.79)%、(18.71±2.43)%、(23.44±2.73)%、(15.94±2.06)%;(71.93±5.22)%、(41.53±3.67)%、(50.38±3.91)%、(32.16±2.58)%。OXA在24 h、48 h、72 h对上述细胞的增殖抑制率分别为(11.24±1.77)%、(10.24±1.03)%、(10.75±0.98)%、(7.54±1.52)%;(26.49±3.54)%、(14.87±2.66)%、(27.58±2.32)%、(11.04±3.14)%;(80.76±4.02)%、(54.66±3.21)%、(64.38±3.31)%、(42.48±2.69)%。提示沉默miR-8063后SW480和HT29细胞对5-FU和OXA两种化疗药物的敏感性均随着药物作用时间延长而降低,相较于对照组,实验组48 h和72 h的增殖抑制率显著降低(P<0.01,图4),表明48 h和72 h两时间段实验组细胞对5-FU和OXA均产生了耐药性,提示实验组细胞获得MDR。
2.4 RT-qPCR检测两组细胞中耐药基因P-gp、ABCG2 mRNA表达RT-qPCR结果显示,SW480-sh-NC、SW480-sh-miR-8063、HT29-sh-NC和HT29-sh-miR-8063细胞P-gp mRNA表达分别为1.05±0.05、1.81±0.05、1.02±0.11和2.50±0.09;ABCG2 mRNA在上述四组细胞相对表达分别为0.98±0.06、1.58±0.06、0.98±0.04和2.01±0.07。与对照组相比,实验组中p-gp mRNA表达分别提高1.8倍和2.5倍;ABCG2 mRNA表达则分别提高1.6倍和2.0倍(P<0.01,图5)。
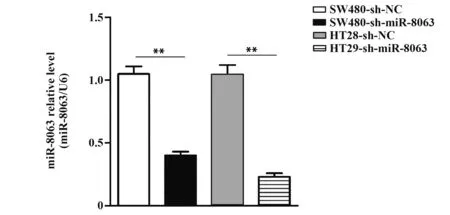
图2 RT-qPCR检测miR-8063表达Fig.2 Expression of miR-8063 detected by RT-qPCR
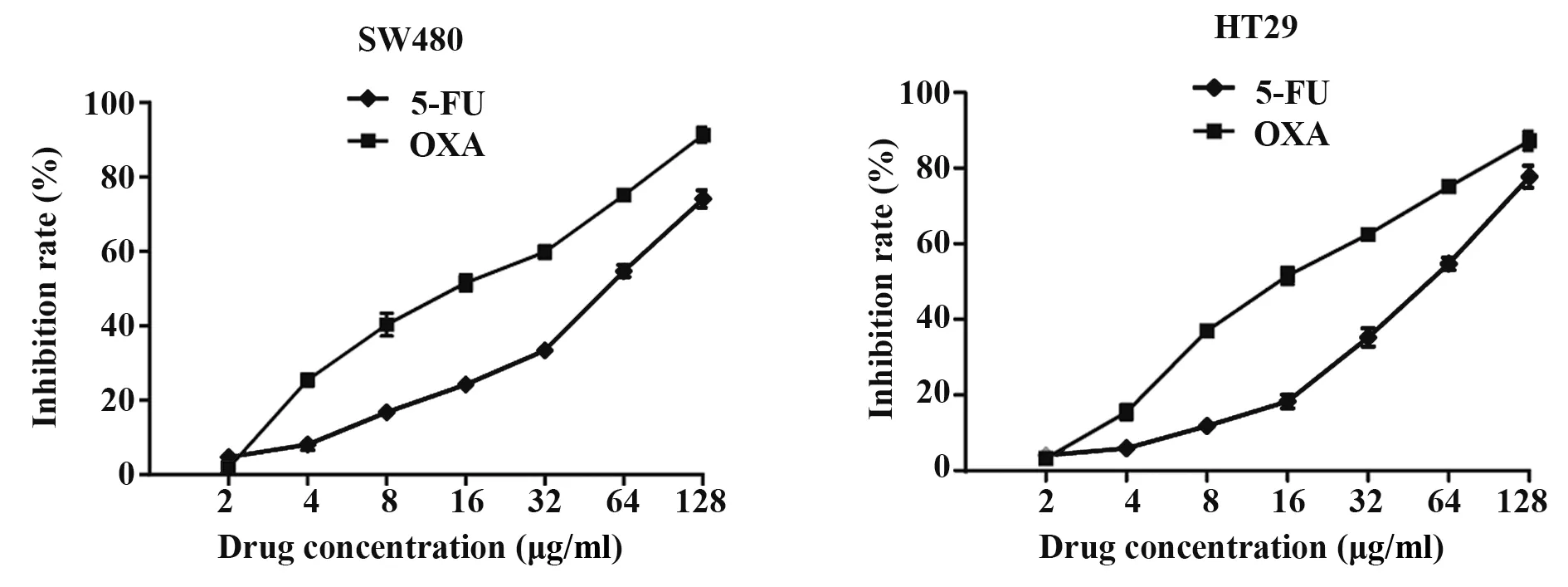
图3 不同药物浓度作用于SW480、HT29细胞的增殖抑制率(72 h)Fig.3 Cytotoxic effects of different drug concentration on SW480 and HT29 cells(72 h)
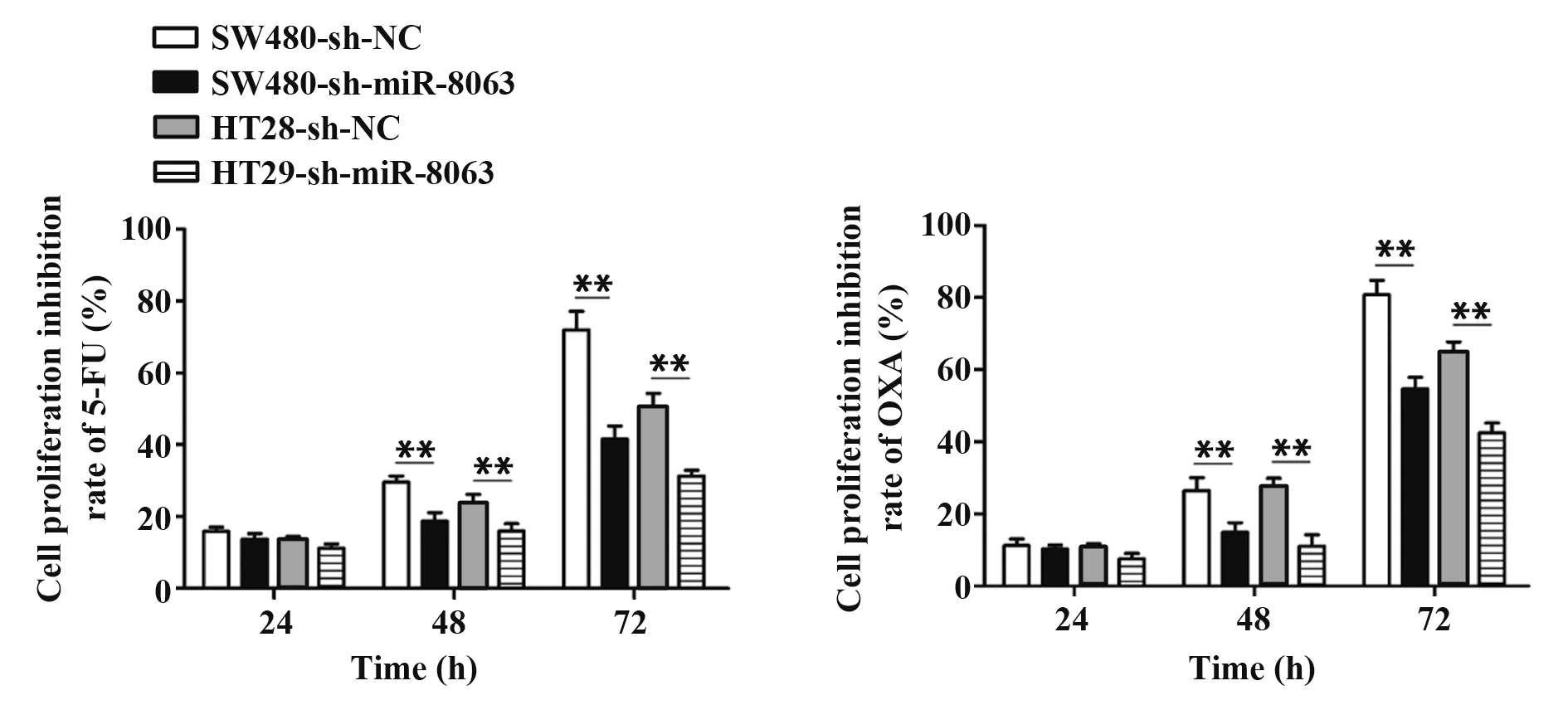
图4 不同时间点(24 h、48 h、72 h)5-FU和OXA在两组细胞中的增殖抑制率Fig.4 Cell proliferation inhibition rates of 5-FU and OXA at different time points(24 h,48 h and 72 h)in experimental group and control group
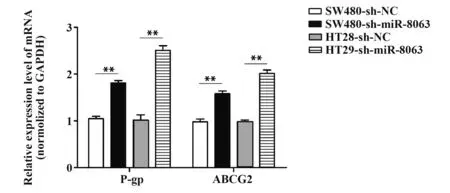
图5 RT-qPCR检测P-gp和ABCG2 mRNA表达Fig.5 mRNA levels of P-gp and ABCG2 detected by RTqPCR
2.5 Western blot检测两组细胞耐药基因P-gp、ABCG2蛋白表达Western blot结果显示,SW480-sh-NC、SW480-sh-miR-8063、HT29-sh-NC和HT29-sh-miR-8063细胞P-gp蛋白表达分别为0.29±0.04、0.53±0.05、0.33±0.05和0.55±0.04;ABCG2蛋白上述四组细胞中相对表达分别为0.20±0.06、0.69±0.03、0.26±0.05和0.71±0.04。实验组P-gp和ABCG2蛋白相对表达均显著高于对照组(P<0.01,图6)。
2.6 Western blot检测两组细胞WNT3A、WNT5A和β-catenin蛋白表达Western blot结果显示,SW480-sh-NC、SW480-sh-miR-8063、HT29-sh-NC和HT29-sh-miR-8063组细胞WNT3A表达分别为0.08±0.01、0.18±0.01、0.12±0.02和0.23±0.03;WNT5A在以上四组细胞的相对表达分别为0.13±0.03、0.32±0.03、0.20±0.01和0.39±0.02;β-catenin在以上四组细胞的相对表达量分别为0.14±0.03、0.25±0.02、0.18±0.02和0.31±0.04。与对照组相比,实验组WNT3A、WNT5A和β-catenin蛋白表达显著升高(P<0.01,图7)。
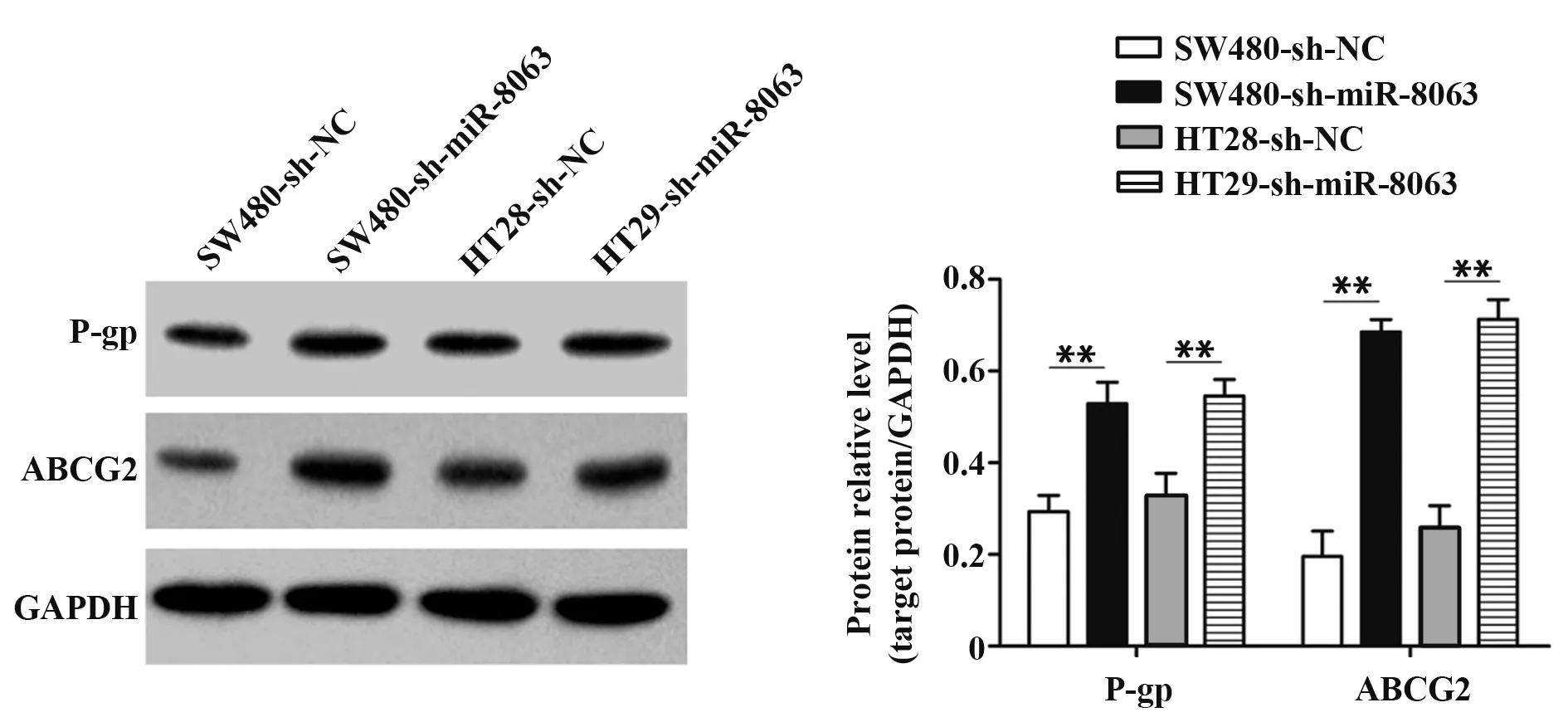
图6 Western blot检测P-gp和ABCG2蛋白表达Fig.6 Protein levels of P-gp and ABCG2 detected by Western blot
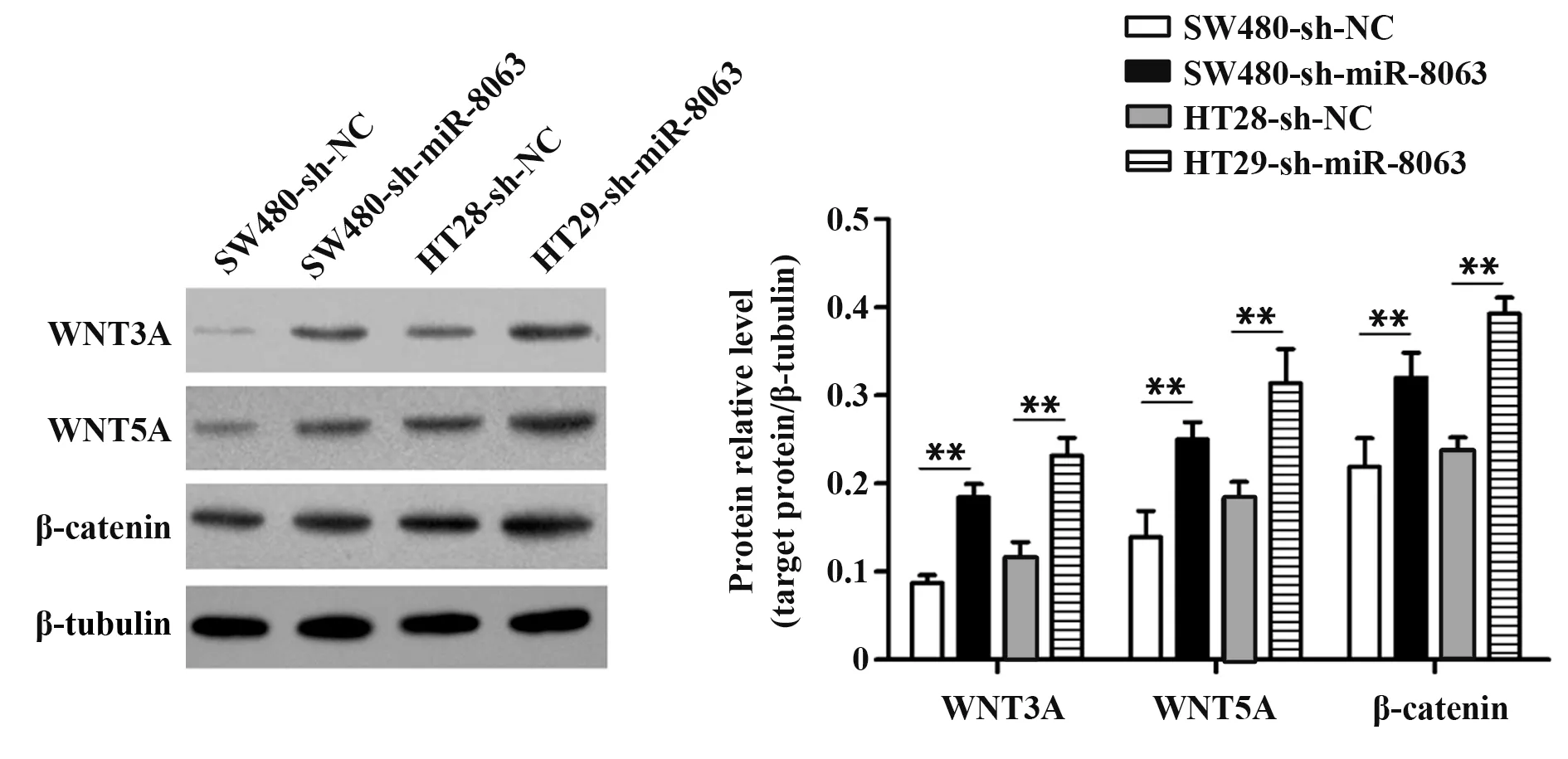
图7 Western blot检测WNT3A、WNT5A和β-catenin蛋白表达Fig.7 Protein levels of WNT3A,WNT5A,β-catenin detected by Western blot
3 讨论
CRC是发病率和病死率均较高的恶性肿瘤,对化疗药物MDR已成为CRC化疗成功的主要障碍。MDR的产生是一个多因素共同参与的复杂过程,与减少药物摄取并增强药物外排、限制肿瘤细胞内药物蓄积、阻断细胞凋亡、DNA损伤修复及细胞周期和检查点调节改变等密切相关[4]。尽管关于MDR的研究取得了一定进展,但对恶性肿瘤中MDR产生的具体分子机制仍知之甚少,因此,深入研究MDR的机制、寻求克服MDR的方法、提高化疗药物疗效已成为目前肿瘤治疗亟待解决的问题。microRNAs是一类长度约为18~25个核苷酸的内源性非编码小分子单链RNA,通过结合不完全的3"UTR非翻译区靶基因mRNA导致mRNA降解或翻译抑制,从而在转录后对靶基因表达实施调控[5-6]。研究表明,microRNAs异常表达在多种恶性肿瘤MDR调控中发挥重要作用[7-9]。本研究利用前期基因芯片筛选结果,以CRC细胞SW480、HT29为研究对象,采用慢病毒介导的RNAi技术沉默其miR-8063基因,探究是否能够促进SW480、HT29细胞获得MDR,及其机制是否与激活WNT/β-catenin信号通路有关。
5-FU和OXA是目前转移性CRC一线化疗方案的常用药物[10]。本研究中,实验组在48 h和72 h的增殖抑制率较对照组明显降低(P<0.01),表明48 h和72 h两个时间段实验组细胞对5-FU和OXA均产生了耐药,提示沉默miR-8063基因促进SW480、HT29细胞获得了MDR。研究证实肿瘤细胞获得MDR与细胞膜表面ATP结合盒转运蛋白(ATPbinding cassette transporter,ABC转运蛋白)介导的药物转运系统改变密切相关,其中P-糖蛋白(P-glycoprotein,P-gp)和ATP结合盒式转运蛋白亚家族成员G2(ATP binding cassette transporter,subfamily G member 2,ABCG2)在MDR中起关键作用[11-13]。这些蛋白能够依赖ATP产生的能量将进入细胞内的药物反泵出细胞,导致细胞内药物浓度降低,从而保护细胞免受细胞毒性药物损伤[14]。与对照组相比,实验组P-gp mRNA相对表达分别提高了1.8倍和2.5倍,ABCG2 mRNA相对表达则分别提高了1.6倍和2.0倍(P<0.01)。同时,实验组P-gp和ABCG2蛋白表达也较对照组显著增高(P<0.01),提示沉默miR-8063基因后细胞获得MDR,与其增强耐药基因P-gp和ABCG2表达有关。
WNT/β-catenin信号通路(也称为经典WNT通路)是由WNT家族分泌蛋白、包膜受体Frizzled家族、低密度脂蛋白受体相关蛋白(low density lipoprotein receptor-related protein,LRP)家族、Disheveled蛋白、糖原合成激酶3β(GSK-3β)、腺瘤性息肉病(adenomatous polyposis coli,APC)蛋白、支架蛋白(Axin)、酪蛋白激酶(CK1)、β-catenin及TCF/LEF家族转录调节因子等构成[15]。当WNT/β-catenin信号通路被激活时,WNT分泌蛋白与Frizzled受体和LRP5/6蛋白结合,活化Disheveled蛋白,从而使β-catenin降解复合体向质膜募集,导致β-catenin不能被磷酸化并在细胞质中积累,进而易位至细胞核结合转录因子TCF/LEF家族从而诱导靶基因转录[16]。大量研究已证实WNT/β-catenin信号通路异常激活与包括CRC在内多种恶性肿瘤复发、转移、MDR等恶性生物学行为密切相关[17-21]。据报道WNT/β-catenin信号通路在约80%CRC患者中发生突变,提示其作为CRC治疗靶点具有巨大潜力[22]。
microRNAs通过调节WNT/β-catenin信号通路相关蛋白表达在肿瘤中发挥促癌或抑癌作用:JIANG等[23]研究发现miR-30-5p抑制CRC CSCs干性和耐药性,其机制为通过靶向泛素特异性肽酶22(Ubiquitin-specific peptidase 22,USP22)并通过WNT/β-catenin信号 通路实现的。YOU等[24]研究 发 现miR-766-3p在肝细胞癌(HCC)组织中表达下调,且miR-766-3p低表达与HCC TNM分期、转移和不良预后显著相关,过表达miR-766-3p促进了HCC增殖、迁移和侵袭,其机制与miR-766-3p靶向WNT3A并抑制其表达有关。LI等[25]研究也证实miR-26a-5p可通过靶向WNT5A抑制胃癌细胞增殖和侵袭。本研究通过Western blot检测了两组细胞WNT3A、WNT5A和β-catenin蛋白表达,结果显示,实验组WNT3A、WNT5A和β-catenin蛋白表达较对照组显著升高(P<0.01),提示沉默miR-8063基因导致了WNT/β-catenin信号通路激活,从而促进SW480、HT29细胞获得MDR。
综上,本研究显示沉默miR-8063基因可促进CRC细胞耐药基因P-gp、ABCG2表达,使CRC细胞SW480和HT29获得MDR,其分子机制可能与激活WNT/β-catenin信号通路有关,为miR-8063在临床上用于CRC分子靶向治疗提供了依据。但本研究仅在体外细胞水平证实miR-8063对CRC细胞MDR的影响,体内功能验证及MDR和WNT/β-catenin信号通路的具体调控机制还需进一步研究。
