3D培养细胞球快速石蜡切片方法建立及应用
2022-10-03冯珊珊金毅娄东晓魏孟超谢泳娇王汝仙李
冯珊珊金 毅娄东晓魏孟超谢泳娇王汝仙李 静*
(1.广东东阳光药业有限公司,广东 东莞 523871;2.深圳市药品检验研究院(深圳市医疗器械检测中心),深圳 518057)
在生物学、基础医学、药理学研究和新药评价中,实验动物具有非常重要的地位,但随着动物福利日益受到重视,3R原则(reduction,replacement,refinement)的广泛接受,实验动物替代技术逐渐被学术界认可[1]。近年来,器官芯片(organ-on-achip)、类器官(organoid)、细胞球(spheroid)等三维(3D)细胞模型技术的发展为实验动物替代提供了便利条件[2-4]。我国最新发布的《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》已明确将3D细胞模型纳入评估药物有效性和安全性的候选模型[5]。研究类器官或细胞球的组织形态特征、组织病理学、基因表达的时空分布通常采用冰冻切片或石蜡切片结合组织化学染色、免疫荧光染色等。冰冻切片虽然具有制片简便快速的优点,但也具有保存时间较短,制片过程中冰晶的形成可能影响抗原定位等缺点[6]。石蜡切片具有组织结构保存良好,贴片牢固、抗原定位准确、可长期保存等优点。但由于类器官或细胞球的培养体系复杂,体积小,组成相对单一,制作病理切片难度较大。传统细胞球或类器官石蜡切片采用琼脂、琼脂糖、蛋清等预包埋,存在制片过程复杂,耗时长,受琼脂糖浓度和熔融状态的影响还可能导致浸蜡不充分,不易切片,在加入琼脂过程中因温度原因极易凝固、脱水时易收缩、琼脂含水量高导致脱水时间过长等问题,这在一定程度上限制了石蜡切片技术在3D细胞模型研究中的应用[7-10]。本研究结合3D细胞模型的特点,通过对经典石蜡包埋切片技术进行改良,旨在建立一种适合于3D细胞培养模型的、快速高效的石蜡切片技术及其染色方法,为3D细胞培养模型形态、功能、及应用研究提供便利的病理技术平台。
1 材料和方法
1.1 细胞系
人肝癌细胞HepG2细胞来自美国菌种保藏中心(货号:HB-8065);人肝星形细胞LX-2细胞购于美国默克公司(货号:SCC064)。
1.2 主要试剂与仪器
DMEM培养基(美国Hyclone公司,货号:SH30809.01B);胎牛血清(美国Gibco公司,货号:10099141C);青霉素-链霉素混合液(美国Hyclone公司,货号:SV30010);10%中性福尔马林(北京索莱宝科技有限公司,货号:G2161);鳞片状切片石蜡(德国Leica公司,货号:39601006);0.5%水溶性伊红染液、苏木素(珠海贝索生物科技有限公司,货号:BA4024、BA4041);抗 荧 光 淬 灭 封 片 液、QuickBlockTM免疫染色封闭液、免疫染色通透液(碧云天生物,货号:P0131、P0260、P0096);抗体(美国Abcam公 司,货 号:ab207327、ab8798、ab150077、ab150120、ab6721)。超 低 吸 附96孔 板(美 国Corning公司,货号:4515);全自动组织脱水机(美国Thermo Scientific公司,型号:Excelsior AS);石蜡包埋机(德国美康公司,型号:EC360);石蜡切片机(德国美康公司,型号:HM340E);自动染色一体机(德国Leica公司,型号:STS020);倒置荧光显微镜(德国Leica公司,型号:DM i8)。
1.3 实验方法
1.3.1 3D细胞球培养
将HepG2细胞或/和LX-2细胞以2000~5000个/孔的密度,不同比例接种至超低吸附96孔培养板中[11],置于CO2培养箱内,5% CO2,37℃静置培养3~5 d,待细胞聚集形成质地较为紧密的,直径为100~500 μm细胞微球时进行收集。在细胞接种至超低吸附96孔培养板后,也可以200 r/min离心1~2 min,能加速细胞聚集成球。
1.3.2 制作石蜡切片
收集培养的3D细胞球至离心管中,待细胞球沉淀或低速离心至离心管底部后,移除上清培养基,加入适量的10%的中性福尔马林,室温固定20~30 min。因细胞球十分微小,可在固定过程中加入几滴水溶性伊红染液对样品染色2 min,使样品标记为红色,便于后续操作中识别样品。移除伊红染液,依次按照75%乙醇5 min,90%乙醇5 min,95%乙醇3 min,无水乙醇连续3次、每次5 min的顺序进行脱水。加入适量的二甲苯,进行透明,连续3次,每次5 min。若样品较多,脱水和透明的过程也可以采用全自动组织脱水机,但因细胞球体积微小,需先将样品用滤纸包好,再放入包埋盒中,以防止丢失。将透明后的细胞球转移至装有液体石蜡的包埋底模中,置于65℃恒温加热台或烘箱10 min,取出后立即置于冷板上使含细胞球的液体石蜡快速凝固。切片厚度设置为3 μm,将切下的一层蜡带置于冷水中,用玻片在冷水中捞起蜡带,将其置于温水中使其展平,再贴于载玻片上于显微镜下初步观察细胞球切割情况。将切好的片子置于42℃烘箱中烘烤30 min,置于4℃冰箱内备用。染色前进行脱蜡复水,将切片于室温二甲苯中浸泡5 min,更换二甲苯,重复3次。100%乙醇浸泡切片3 min,连续2次;95%乙醇浸泡切片2 min;70%乙醇浸泡切片2 min。
1.3.3 HE、免疫组化和免疫荧光染色
(1)HE染色
将切片脱蜡、复水后进行常规HE染色:去离子水冲洗2 min,苏木素染液浸染5 min,自来水冲洗1 min,盐酸-乙醇溶液分化3 s,碳酸锂稀溶液蓝化30 s,自来水浸泡10 min,伊红染液浸染10 min,依次经95%乙醇(2次,每次1 min)、无水乙醇(3次,每次1 min)脱水,二甲苯透明,中性树胶封片。
(2)免疫组化染色
将切片脱蜡、复水后进行免疫组织化学染色:抗原修复,将装有切片的架子放入PBS (0.01 mol/L,pH 7.2~7.4)内清洗,微波炉加热Tris/EDTA抗原修复液(10 mmol/L Tris, 1 mmol/L EDTA,0.05%吐温-20,pH 9.0)到100℃,将装有切片的玻片架放入煮沸的Tris/EDTA修复液中,中火加热20 min,取出容器放置冰水中快速冷却10 min左右。含0.025% Triton X-100的1×TBS(pH 7.6)孵育样品10 min,PBS洗涤3次,每次5 min。用封闭液(含10%山羊血清、1%BSA的1×TBS)在37℃下封闭1 h。灭活过氧化物酶:37℃复温45 min;用含0.025% Triton X-100的TBS漂洗3次;将玻片在含0.3% H2O2TBS中孵育15 min。使用含1% BSA的1×TBS稀释一抗,滴加100~200 μL至组织上,于湿盒内4℃过夜孵育。使用1×TBS稀释二抗,室温下避光孵育1 h。清洗后滴加显色剂DAB,反应1 min。苏木精复染,乙醇脱水、二甲苯透明、中性树胶封片。
(3)免疫荧光染色
将切片脱蜡、复水后进行抗原修复、通透和封闭,方法同免疫组化染色。使用含1% BSA的1×TBS稀释一抗,滴加100~200 μL一抗至组织,于湿盒内4℃过夜孵育。移除一抗,PBS洗3次,每次5 min;滴加100~200 μL 1×TBS稀释的二抗至组织,于湿盒中室温下避光孵育1 h。滴加10~20 μL 含抗荧光淬灭剂的封片液(含DAPI),孵育10 min,PBS洗去多余的封片液。在荧光显微镜下观察采集图像。
2 结果
2.1 3D细胞球包埋流程优化
本研究中3D细胞球石蜡包埋的流程如图1。在细胞聚集形成直径100~500 μm、质地紧密的微球时收集固定。该流程从固定到完成包埋耗时仅80~90 min。在脱水前,先用伊红对细胞球染色标记,可明显提高细胞球的能见度,有利后续操作。

图1 细胞球的培养和石蜡包埋Note. A, Cellular spheroids culture. B, Operation flow chart of embedding. C, Fixed and paraffin-embedded spheroids (unmarked). D, Fixed and paraffin-embedded spheroids (marked with eosin).Figure 1 Culture and embedding of cellular spheroids
2.2 HE染色
本方法制作的切片细胞球结构完整,细胞界限清晰,呈卵圆形,单个分布。HE染色质核分明,细胞形态完整,细胞活力高,核心无坏死;LX-2细胞所形成的细胞球体积较小,结构更为致密,HepG2细胞形成的细胞球体积较大,结构相对松散(图2)。
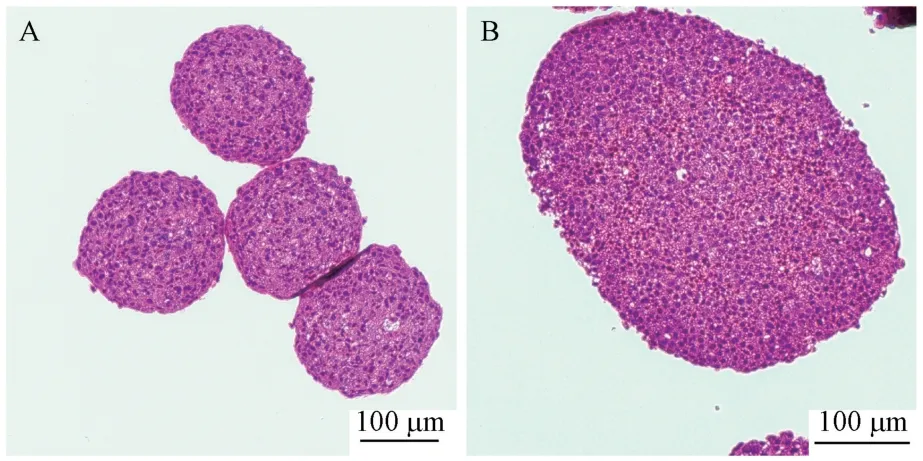
图2 细胞球HE染色Note. A, LX-2 cells. B, HepG2 cells.Figure 2 Hematoxylin and eosin staining of multicellular spheroids
2.3 免疫组化染色
免疫组化标记HepG2细胞表达的白蛋白呈棕色弥漫状主要分布于HepG2和LX-2细胞共培养细胞球的内部,外周较少,细胞核蓝染(图3)。
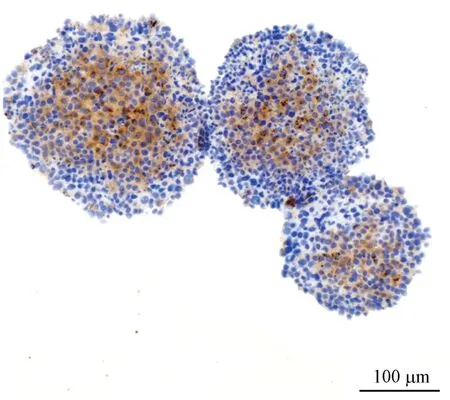
图3 免疫组织化学染色显示白蛋白在HepG2和LX-2细胞共培养细胞球中的表达Figure 3 Albumin was detected by immunohistochemistry in multicellular spheroids of HepG2 cells co-culturing with LX-2 cells
2.4 免疫荧光染色
免疫荧光分别用绿色荧光标记HepG2细胞表达的白蛋白,红色荧光标记LX-2细胞表达的波形蛋白,以及DAPI标记细胞核,可见在HepG2和LX-2共培养细胞球中,白蛋白主要分布于细胞球的内部,波形蛋白主要分布于细胞球的周边,内部数量较少(图4),该结果与免疫组化染色结果一致。这说明在HepG2细胞和LX-2细胞共培养的细胞球中,两种细胞的空间分布特点是不同的,HepG2细胞集中于细胞球内部,LX-2细胞主要在细胞球的周边。

图4 免疫荧光显示白蛋白和波形蛋白在HepG2和LX-2细胞共培养细胞球中表达Note. A, 4’,6-diamidino-2-phenylindole (DAPI). B, Albumin. C, Vimentin. D, Merged.Figure 4 Albumin and vimentin were detected by immunofluorescence in multicellular spheroids of HepG2 cells co-culturing with LX-2 cells
3 讨论
本研究根据3D细胞培养模型的特点,对传统石蜡切片的制备方法进行了改进,从细胞球的收集到蜡块制备完成耗时不到2 h,缩短了制片时间,显著提高实验效率。而以往报道的类器官石蜡切片制备方法完成同样的过程耗时约4~30 h,且成片的组织结构松散,给组织鉴定增加了难度[12-14]。本方法操作简便,无需离心富集,无需琼脂糖、蛋清等预包埋,固定、脱水、透明、浸蜡等步骤都根据样品特点进行了优化。本方法可操作性和实用性强,制作的切片结构完整、细胞界限清楚,制作的切片可行HE染色、免疫组织化学染色和免疫荧光染色,均能取得良好的效果。
本文介绍的方法较一般石蜡切片制备方法的耗时短很多,主要在于缩短了固定、脱水、浸蜡、烤片等步骤的时间,这主要源于细胞球样品体积较小,试剂渗透较快。在我们的实践中,这种快速的蜡块制备方法适用于直径50~1000 μm的细胞球或类器官,若样品体积更大,则应适当延长上述过程的时间。值得注意的是肿瘤球模型在直径超过500 μm左右时,大多数会出现中心区的细胞坏死,所以,在培养细胞球时,应根据细胞的实际生长情况控制其大小[15]。
相较于病理切片中常见的组织,3D细胞球或类器官体积微小、几乎无色透明且细胞成分相对简单,导致样本具有不易收集、易丢失、易损坏等特点,从而增加了样品包埋和切片的难度。本研究在样本固定后脱水前,采用了水溶性伊红进行样本标记,克服了上述操作难点。标记后的细胞球呈红色,在蜡块中清晰可见,便于后续切片和制片,并且该染色在复水过程中可被洗去,不影响对切片进行其他染色的效果。为保证样本的结构完整性,在能保证固定和脱水充分的前提下,应尽量缩短这些过程的时间,且在样本处理时,动作应尽量轻柔。
细胞球和类器官作为不同的3D细胞模型,各有优势,细胞球的培养更为简单,成本适中,易于实现;类器官在组成和功能上与真实器官相似度更高。如3D肿瘤球模型,相比较2D平面培养的细胞,肿瘤球模型结构上非常类似体内无血管的肿瘤小结节,更适合作为肿瘤相关研究的体外模型[16]。本文中所用的肝细胞和星形细胞混合培养的细胞球,可用于构建肝脂肪变性和肝纤维化模型,进行药物筛选[11]。虽然细胞球和类器官在细胞来源、构建难易程度、应用上有一定的差异,但由于二者组成和体积类似,对其形态结构、组织病理的研究手段是相通的,均可借助病理技术手段对其结构和功能进行鉴定。本文所述的快速石蜡切片不仅适用于各种细胞球,也适用于体积相似的类器官模型。
该快速石蜡切片方法虽然缩短了制片时间,但仍使用了甲醛、二甲苯等试剂,对于免疫活性容易被破坏的抗原在进行免疫组化染色或免疫荧光染色前,仍需进行抗原热修复。本文介绍的适用于3D细胞模型的快速石蜡切片技术有助于细胞球、类器官等动物替代模型在研究中的应用,加快研究进程。
