HMGB1/RAGE轴在结直肠癌肥大细胞浸润中的作用机制研究
2022-10-02袁兆林刘娣朱绪锋滕州市中心人民医院检验科滕州277599
袁兆林 刘娣 朱绪锋(滕州市中心人民医院检验科,滕州 277599)
结直肠癌是常见的消化道恶性肿瘤,多发于40~70岁中老年男性,随着病情发展患者会出现便秘、便血及局部腹痛等症状。研究发现,肿瘤组织中肥大细胞浸润情况与肿瘤分化、转移等过程密切相关[1-2]。KOMI等[3]报道,多种肿瘤(尤其是恶性黑色素瘤、乳腺癌和结直肠癌)中均存在肥大细胞浸润,与免疫细胞、肿瘤细胞和细胞外基质相互作用,重塑肿瘤微环境,释放促血管生成因子,诱导新生血管形成,并释放基质金属蛋白酶促进肿瘤侵袭,创造利于肿瘤生长和转移的条件。高迁移率族蛋白B1(high mobility group box 1,HMGB1)是一种非组蛋白染色体结合蛋白,可与相应细胞表面天然受体结合,如晚期糖基化终产物受体(receptor of advanced glycation end products,RAGE),引起炎症反应[4-5]。QIAN等[6]研究报道,HMGB1/RAGE信号在炎症驱动的癌变中起不可或缺作用,HMGB1可促进结直肠癌细胞增殖,介导RAGE激活,而RAGE与淋巴结转移和TNM分期密切相关。本研究拟构建结直肠癌小鼠模型,探究HMGB1/RAGE轴对结直肠癌肥大细胞浸润的作用及机制,为结直肠癌治疗靶点的深入研究奠定基础。
1 材料与方法
1.1材料人结直肠癌细胞SW837(上海ATCC细胞库);雄性BALB/c裸鼠(6~8周龄,广东省医学实验动物中心);人HMGB1 shRNA和NC shRNA慢病毒表达载体(上海吉凯基因化学技术公司);NF-κB抑制剂吡咯烷二硫代氨基甲酸(PDTC,碧云天生物科技有限公司);甲苯胺蓝染色液、苏木素染色液(北京万佳首化生物科技有限公司);兔抗小鼠Tryptase抗体、兔抗小鼠HMGB1抗体、兔抗小鼠RAGE抗体、兔抗小鼠NF-κB p65抗体、羊抗兔IgG(HRP)抗体(上海艾博抗贸易有限公司);全蛋白提取试剂盒(北京索莱宝科技有限公司);小鼠TNF-α测定试剂盒、小鼠IL-1β测定试剂盒(武汉伊莱瑞特生物科技股份有限公司);超净工作台、细胞培养箱、高速冷冻离心机、-80℃冰箱(美国Thermo公司);单通道移液器(德国Eppendorf公司);光学显微镜(德国Carl Zeiss公司);垂直板电泳槽、蛋白转膜仪(美国Bio-Rad公司);酶标仪(美国Dynatech Lab公司)。
1.2方法
1.2.1造模与分组无菌条件下于裸鼠腋窝中部外侧皮下注射1×107个SW837细胞,密切观察肿瘤生长情况,待肿瘤生长至直径约1.5 cm时,无菌条件下处死裸鼠,取出肿瘤组织,并将其分切为直径约2 mm的组织块,再次接种于裸鼠腋窝中部外侧皮下,待瘤块生长至直径4~5 mm时,将裸鼠随机分为模型组、NC shRNA组、HMGB1 shRNA组和PDTC组,每组8只,另取8只裸鼠接种等体积PBS作为正常对照组。HMGB1 shRNA组每3 d瘤内注射1次0.1 ml HMGB1 shRNA慢病毒(滴度为5×108TU/ml),共注射3次[7];NC shRNA组 每3 d瘤 内注射1次0.1 ml NC shRNA慢病毒(滴度为5×108TU/ml),共注射3次;PDTC组每3 d瘤内注射1次0.1 ml PDTC(10 μmol/L),共注射3次,正常对照组和模型组每3 d注射1次等体积无菌PBS,共注射3次。
1.2.2观察肿瘤生长情况对造模成功的裸鼠分组处理后,每2 d进行1次瘤体测量,肿瘤体积=长径×短径2/2。
1.2.3甲苯胺蓝染色所有治疗结束后3 d麻醉并处死裸鼠,剥离肿瘤组织,取部分浸于4%多聚甲醛,其余部分经液氮冻存后-80℃保存备用。对固定好的肿瘤组织进行脱水并包埋石蜡,切片(5 μm),二甲苯脱蜡,随后用各级浓度乙醇处理,蒸馏水洗涤,甲苯胺蓝染色,水洗,冰乙酸分化,水洗,冷风吹干,二甲苯透明处理,中性树胶封固,光镜下观察肥大细胞。每片任取10个视野,计算平均值代表该组织中肥大细胞数。
1.2.4免疫组化取石蜡切片,按1.2.3进行脱蜡、水化,3%过氧化氢灭活内源性过氧化物酶后进行抗原修复(柠檬酸缓冲液),滴加1∶500稀释的一抗(兔抗小鼠Tryptase抗体)溶液37℃孵育1 h,洗涤,滴加1∶1 000稀释的二抗[羊抗兔IgG(HRP)抗体]37℃孵育1 h,洗涤,滴加链霉亲和素-过氧化物酶(SP)37℃孵育1 h,洗涤,DAB显色,显色终止后苏木素染液复染,盐酸乙醇分化处理,水洗,脱水、透明、中性树胶封片。光镜观察(×400),每片任取10个视野,Image Pro Plus 6.0软件分析图像,计算Tryptase阳性表达平均光密度值。
1.2.5Western blot检测HMGB1、RAGE、NF-κB p65蛋白表达取冻存肿瘤组织,剪为组织碎块,裂解后充分研磨,收集组织液于离心管,4℃、12 000 r/min离心15 min,取上清进行蛋白定量。各组取50 μg蛋白,按1∶4比例加入上样缓冲液,混匀后沸水浴10 min,上样凝胶并电泳。结束后取凝胶进行转膜,5%脱脂奶室温封闭1 h,置于1∶1 000稀释的一抗(兔抗小鼠HMGB1抗体、兔抗小鼠RAGE抗体、兔抗小鼠NF-κB p65抗体)室温孵育2 h,洗涤,置于1∶2 000稀释的二抗中室温孵育1 h,洗涤后显色,成像系统中拍照,Image J软件分析结果。
1.2.6ELISA检测TNF-α和IL-1β表达研磨肿瘤组织,离心后取上清,根据ELISA试剂盒说明书测定TNF-α和IL-1β表达。
1.3统计学分析采用SPSS20.0软件进行统计学分析,计量资料以±s表示,多组间比较采用单因素方差分析,进一步两组间比较采用SNK-q检验,P<0.05为差异具有统计学意义。
2 结果
2.1各组肿瘤生长情况随着肿瘤接种天数增加,正常对照组无肿瘤生长,模型组和NC shRNA组裸鼠肿瘤体积基本同步增长,HMGB1 shRNA组与PDTC组裸鼠肿瘤体积相较于模型组增长较慢(图1)。
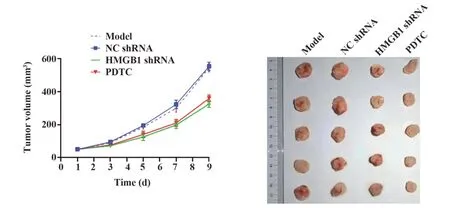
图1 各组肿瘤生长情况Fig.1 Tumor growth in each group
2.2各组肿瘤组织中肥大细胞定量观察模型组和NC shRNA组肿瘤组织中观察到浸润的肥大细胞被甲苯胺蓝染为深蓝色,胞浆内充满紫色颗粒,细胞多处于正脱颗粒或已经脱颗粒状态,细胞膜凹凸不平,胞浆内紫色颗粒外溢,散于细胞周围,HMGB1 shRNA组与PDTC组仅见少量肥大细胞浸润,且胞浆紫色颗粒较少(图2)。模型组和NC shRNA组肥大细胞数差异无统计学意义(P>0.05),HMGB1 shRNA组相较于模型组肥大细胞数显著减少(P<0.05),HMGB1 shRNA组与PDTC组肥大细胞数差异无统计学意义(P>0.05,表1)。
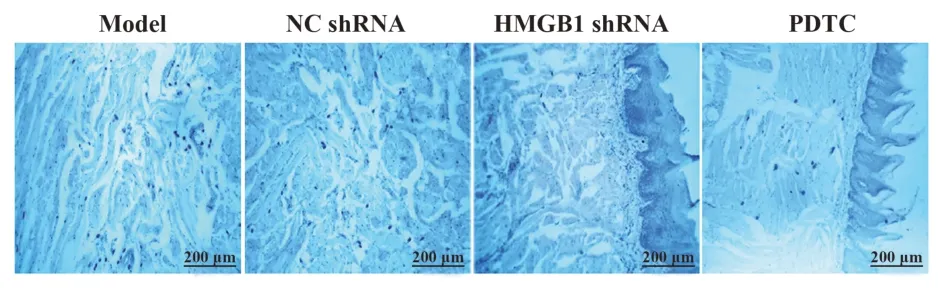
图2 肿瘤组织肥大细胞浸润情况(TB染色)Fig.2 Infiltration of mast cells in tumor tissues(TB staining)
表1 各组肥大细胞数(±s,n=8)Tab.1 Number of mast cells in each group(±s,n=8)

表1 各组肥大细胞数(±s,n=8)Tab.1 Number of mast cells in each group(±s,n=8)
Note:Compared with model group,1)P<0.05.
Groups Model NC shRNA HMGB1 shRNA PDTC Number of mast cells 47.58±8.56 44.21±9.82 22.73±5.341)18.25±6.211)
2.3各组肿瘤组织Tryptase水平模型组和NC shRNA组均观察到大量Tryptase阳性染色颗粒,组间差异无统计学意义(P>0.05),HMGB1 shRNA组与PDTC组相较于模型组Tryptase阳性染色颗粒显著减少(P<0.05);HMGB1 shRNA组与PDTC组间差异无统计学意义(P>0.05,图3、表2)。
表2 各组肿瘤组织Tryptase蛋白表达(±s,n=8)Tab.2 Expression of Tryptase protein in tumor tissues of each group(±s,n=8)
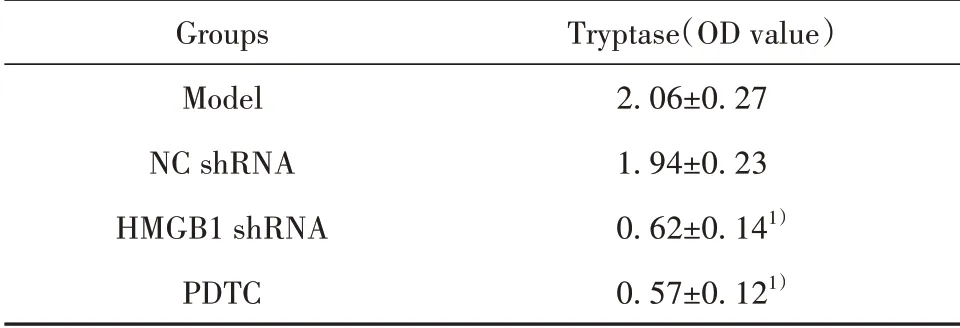
表2 各组肿瘤组织Tryptase蛋白表达(±s,n=8)Tab.2 Expression of Tryptase protein in tumor tissues of each group(±s,n=8)
Note:Compared with model group,1)P<0.05.
Groups Model NC shRNA HMGB1 shRNA PDTC Tryptase(OD value)2.06±0.27 1.94±0.23 0.62±0.141)0.57±0.121)
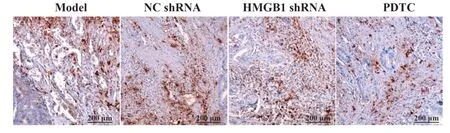
图3 各组肿瘤组织Tryptase蛋白表达(免疫组化)Fig.3 Expression of Tryptase protein in tumor tissues of each group(Immunohistochemistry)
2.4各组肿瘤组织HMGB1、RAGE、NF-κB p65蛋白表达模型组和NC shRNA组肿瘤组织HMGB1、RAGE、NF-κB p65蛋白表达差异无统计学意义(P>0.05),HMGB1 shRNA组与PDTC组相较于模型组肿瘤组织HMGB1、RAGE、NF-κB p65蛋白表达显著降 低(P<0.05),HMGB1 shRNA组 与PDTC组HMGB1、RAGE、NF-κB p65蛋白表达差异无统计学意义(P>0.05,图4、表3)。
表3 各组肿瘤组织HMGB1、RAGE、NF-κB p65蛋白表达(±s,n=8)Tab.3 Expressions of HMGB1,RAGE and NF-κB p65 protein in tumor tissues of each group(±s,n=8)
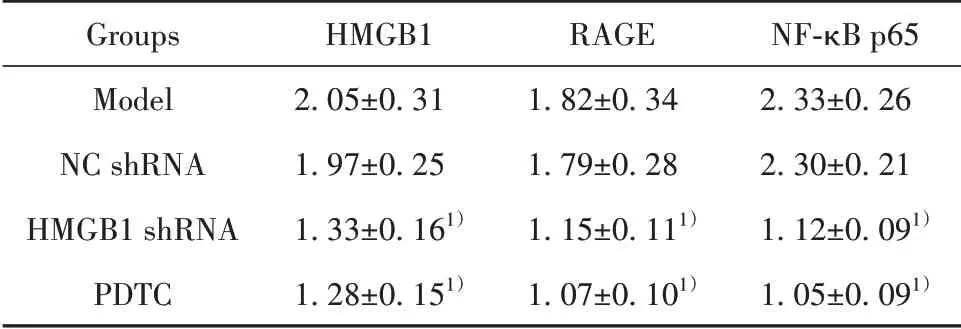
表3 各组肿瘤组织HMGB1、RAGE、NF-κB p65蛋白表达(±s,n=8)Tab.3 Expressions of HMGB1,RAGE and NF-κB p65 protein in tumor tissues of each group(±s,n=8)
Note:Compared with model group,1)P<0.05.
Groups Model NC shRNA HMGB1 shRNA PDTC HMGB1 2.05±0.31 1.97±0.25 1.33±0.161)1.28±0.151)RAGE 1.82±0.34 1.79±0.28 1.15±0.111)1.07±0.101)NF-κB p65 2.33±0.26 2.30±0.21 1.12±0.091)1.05±0.091)
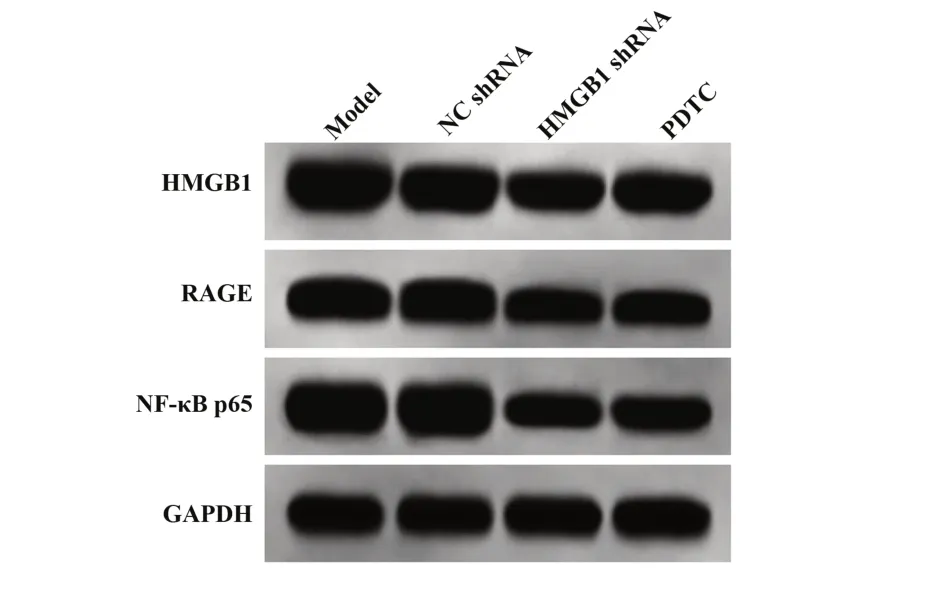
图4 各组肿瘤组织HMGB1、RAGE、NF-κB p65蛋白表达Fig.4 Expressions of HMGB1,RAGE and NF-κB p65 protein in tumor tissues of each group
2.5各组肿瘤组织TNF-α和IL-1β表达模型组和NC shRNA组肿瘤组织TNF-α和IL-1β水平差异无统计学意义(P>0.05),HMGB1 shRNA组与PDTC组相较于模型组肿瘤组织TNF-α和IL-1β水平显著降低(P<0.05),HMGB1 shRNA组与PDTC组TNF-α和IL-1β水平差异无统计学意义(P>0.05,表4)。
表4 各组肿瘤组织TNF-α和IL-1β表达(±s,n=8,pg/ml)Tab.4 Expressions of TNF-α and IL-1β in tumor tissues of each group(±s,n=8,pg/ml)
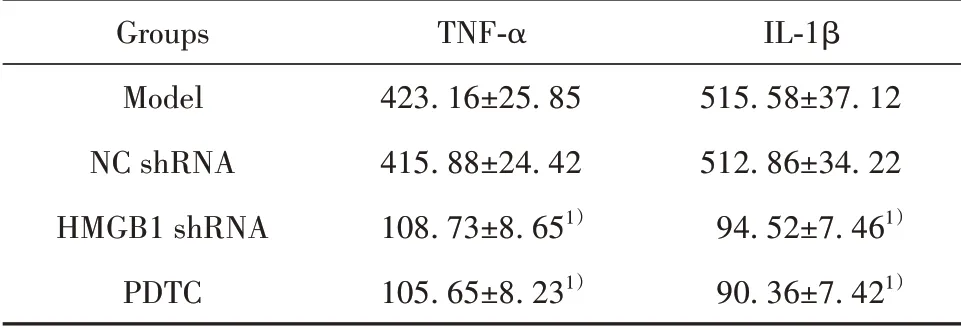
表4 各组肿瘤组织TNF-α和IL-1β表达(±s,n=8,pg/ml)Tab.4 Expressions of TNF-α and IL-1β in tumor tissues of each group(±s,n=8,pg/ml)
Note:Compared with model group,1)P<0.05.
Groups Model NC shRNA HMGB1 shRNA PDTC TNF-α 423.16±25.85 415.88±24.42 108.73±8.651)105.65±8.231)IL-1β 515.58±37.12 512.86±34.22 94.52±7.461)90.36±7.421)
3 讨论
结直肠癌是一种高发病率、高致死率的恶性肿瘤,严重威胁人类健康。研究发现,肥大细胞是一种重要的肿瘤间质组成部分,在肿瘤发生发展中起不可或缺的作用[8]。肥大细胞是一种粒细胞,广泛分布于血管附近,显微镜下可观察到染色后的细胞呈圆形,胞浆中充满均匀分布于细胞核周围的紫色颗粒,这些被染成紫色的分泌颗粒内含多种化学物质和细胞因子,当肥大细胞活化时,以胞吐方式被释放,发挥各自生物学功能[9-10]。XIAO等[11]研究报道,激活肥大细胞会使其脱颗粒并释放类胰蛋白酶,激活相应信号通路加速血管生成。本研究中,结直肠癌裸鼠模型肿瘤组织中可观察到大量正在脱颗粒或已脱颗粒的肥大细胞浸润,以及大量类胰蛋白酶阳性染色颗粒,表明结肠癌肿瘤组织存在大量活化的肥大细胞。ALLER等[12]认为,肥大细胞可调控炎症反应,创造炎症间质微环境,使得癌细胞在机体内达到最大生长和入侵水平。HU等[13]报道瘤内类胰蛋白酶阳性肥大细胞浸润可促进实体瘤淋巴结转移,与非小细胞肺癌、肝癌和结直肠癌五年生存率显著相关,显著降低患者总生存期和无病生存期,导致不良临床结果。因此推测减少肿瘤组织中肥大细胞浸润可能是抑制结直肠癌发展的新思路。
HMGB1是一种非组蛋白染色体结合蛋白,可激活免疫细胞,引发炎症反应。多项研究表明,HMGB1与乳腺癌、结肠癌、非小细胞肺癌等多种恶性肿瘤发生发展密切相关[14-16]。HUANG等[17]研究报道,下调HMGB1表达能够显著增强化疗药物对结肠直肠癌细胞的细胞毒性。HMGB1的超乙酰化形式可通过与RAGE结合调节各种促炎细胞因子转录,RAGE为一种模式识别受体,在众多疾病(如肺炎、糖尿病、阿尔茨海默病、肿瘤等)病理过程中发挥重要作用[18]。已有报道显示,HMGB1/RAGE在炎症反应中发挥作用,其相互作用导致促炎转录激活下游因子NF-κB,NF-κB是受RAGE信号调节的关键蛋白[19]。本研究检测到结直肠癌组织HMGB1、RAGE和NF-κB蛋白及炎症因子TNF-α和IL-1β呈高表达,提示结直肠癌组织中存在炎症因子及NF-κB激活,而干扰HMGB1表达后,HMGB1 shRNA组与PDTC组RAGE和NF-κB蛋白及TNF-α和IL-1β表达亦显著下降,表明干扰HMGB1表达可抑制RAGE、NF-κB表达与炎症因子释放,与PDTC作用类似。提示抑制HMGB1表达可抑制NF-κB信号通路,抑制炎症因子分泌。QIAN等[20]研究报道,HMGB1/RAGE对肥大细胞具有激活作用,阻断HMGB1/RAGE信号通路可减少海马区肥大细胞浸润,抑制血脑屏障破坏。本研究发现,抑制HMGB1表达或采用NF-κB抑制剂PDTC后,不仅RAGE和NF-κB蛋白表达下调,肿瘤组织中肥大细胞浸润、胞浆紫色颗粒显著减少,类胰蛋白酶表达也显著降低,提示抑制HMGB1表达与NF-κB抑制剂PDTC均可抑制结直肠癌组织肥大细胞浸润,进一步证实抑制HMGB1表达可抑制NF-κB信号通路激活。
综上,HMGB1/RAGE轴可促进结直肠癌肥大细胞浸润,可能通过激活NF-κB信号通路发挥作用,但仍需进一步验证。
