天山雪莲口服液对类风湿关节炎的治疗作用及其机制研究①
2022-10-02王灵锐丛珊王钰铭张晨曦罗剑罗莉新疆医科大学第一附属医院乌鲁木齐830000
王灵锐 丛珊 王钰铭 张晨曦 罗剑 罗莉(新疆医科大学第一附属医院,乌鲁木齐 830000)
类风湿关节炎(rheumatoid arthritis,RA)是一种发病机制尚不明确的慢性自身免疫性疾病,主要病理表现为持续性多关节滑膜炎症反应、进行性的软骨和骨骼的破坏甚至关节功能丧失[1]。RA在成年人群中的患病率为0.5%~1%,以女性患者居多[2]。RA的发病机制复杂,其中滑膜组织增生是引起RA软骨和骨骼破坏的最重要因素。最新研究发现,滑膜成纤维细胞自噬紊乱是RA的重要发病机制之一,在胶原诱导性关节炎(collagen-induced arthritis,CIA)大鼠模型中,滑膜成纤维细胞(RA synovial fibroblasts,RASFs)自噬水平升高,进而促进其增殖,最终导致滑膜增生,通过抑制滑膜组织自噬水平可减轻滑膜增生[3]。天山雪莲(sasussured involucrata,SI)是中国新疆天山西部地区的稀有草本植物,多年来常用于RA的治疗[4]。天山雪莲口服液(SI Oral Liquid,SIOL)主要由SI提取物组成,目前已广泛应用于RA的临床治疗,在改善RA患者关节疼痛、晨僵、关节肿胀、关节压痛方面效果明显[5],然而其作用机制尚不明确。本研究通过建立CIA大鼠模型,从调节自噬角度,进一步探讨SI治疗RA的作用机制。
1 材料与方法
1.1材料
1.1.1实验动物SPF级雄性SD大鼠50只,鼠龄6~7周,体质量(200±20)g,购自新疆医科大学动物实验中心。
1.1.2主要试剂与仪器天山雪莲口服液(新疆天山莲药业有限公司,批号:20190901);雷公藤多苷片(黄石飞云制药有限公司,批号:20200901);牛源性Ⅱ型胶原蛋白(bovine typeⅡcollagen,CⅡ,Chondrex,Inc公司,批号:#20022);弗氏完全佐剂(Sigma公司,CFA,批号:#SLCC6223);JNK抗体、p-JNK抗体(Cell Signaling Technology公司,批号:#9252、#4668);Bcl-2抗 体(Abcam公 司,批 号:ab59348);Beclin-1抗体、LC3-Ⅱ抗体、β-actin抗体、辣根酶标记山羊抗兔IgG(Proteintech公司,批号:
11306-1-AP、14600-1-AP、20536-1-AP、SA00001-2);BCA蛋白定量试剂盒(索莱宝公司,批号:No.20210419);TG15高速离心机(四川蜀科仪器有限公司);JY600C电泳仪(北京君意东方电泳设备有限公司)。
1.2方法
1.2.1CIA模型制备大鼠适应性喂养1周后,将CⅡ以2 mg/ml溶解于0.05 mol/L的乙酸中,并在等体积的CFA中乳化,以200 μl乳剂在足趾及尾根部1.5 cm处皮下注射进行初次免疫,初次免疫7 d后再次经皮下注射相同乳剂进行加强免疫,进而诱发CIA大鼠模型[6]。加强免疫后15 d(即初次免疫第21天)开始观察并记录关节病变程度,大鼠出现包括踝关节在内的全部足爪肿胀提示造模成功。
1.2.2分组及给药将50只大鼠平均分为健康对照组、阴性对照组、阳性对照组、SIOL低、高剂量组。除健康对照组外,其余各组采用CⅡ建立CIA模型,造模成功后,空白组和阴性对照组灌胃生理盐水(2 ml/d),阳性对照组灌胃雷公藤多苷片[20 mg/(kg·d)][7],SIOL低、高剂量组灌胃分别灌胃SIOL(0.5 ml/d、2.0 ml/d),共给药28 d。注:SIOL给药剂量根据人等效剂量换算公式得到,其中低剂量组为人等效剂量。
1.2.3观察大鼠一般情况并测量踝关节肿胀度
分别在造模前、给药第0天、第7天、第14天、第21天、第28天用游标卡尺测量大鼠左后踝关节直径,连续测量3次,取其平均值。肿胀度(%)=(dn-dt)/dt×100%,dt、dn分别代表致炎前后踝关节直径。
1.2.4HE染色观察关节滑膜组织病理形态表现
取大鼠踝关节,于4%多聚甲醛溶液中固定24 h后置于10%的EDTA溶液进行关节脱钙,脱钙完成后梯度浓度乙醇脱水,经包埋、切片、烘干、脱蜡、HE染色等步骤后,×100显微镜下观察踝关节病理改变。
1.2.5qPCR测定滑膜组织中JNK、Bcl-2、Beclin-1、LC3mRNA含量取大鼠膝关节内滑膜组织30 mg提取总RNA,逆转录合成cDNA。以cDNA为模板,按照试剂盒说明分别加入引物和SuperReal PreMix Plus等,qPCR反应条件:95℃15 min,95℃20 s,56℃20 s,40个循环。熔解曲线分析:温度62~95℃,引物序列见表1。

表1 引物序列Tab.1 Primer Sequences
1.2.6Western blot检测滑膜组织中JNK、p-JNK、Bcl-2、Beclin-1、LC3-Ⅱ蛋白表达收集各组大鼠的膝关节滑膜组织,称取约20 mg,加入150 μl RIPA蛋白裂解液,匀浆离心后留取蛋白。采用BCA蛋白测定试剂盒测定总蛋白浓度。每个样品取等量蛋白10 μg,采用SDS-PAGE电泳分离蛋白,电泳条件:90 V,20 min;130 V,1 h。随后以130 V、300 mA、2 h将电泳分离后的蛋白转移至PVDF膜,5%脱脂奶粉室温封闭2 h,分别加入不同的兔抗大鼠一抗JNK、p-JNK、Bcl-2、Beclin-1、LC3、β-actin(稀释比例分别为1∶10 000、1∶10 000、1∶1 000、1∶10 000、1∶2 500、1∶5 000)4℃孵育过夜。洗膜后加入二抗(羊抗兔IgG按1∶9 000稀释)室温孵育2 h,TBST洗膜后ECL化学发光法显影检测,采用Image pro plus 6.0软件对条带灰度值进行量化分析。
1.3统计学处理采用SPSS 17.0统计软件进行数据统计,计量资料间较符合正态分布的采用t检验,以±s表示,两组间资料比较采用t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1SIOL对CIA大鼠踝关节肿胀度的影响与健康对照组相比,灌胃后第7、14、21、28天阴性对照组大鼠踝关节肿胀显著升高(P<0.01);与阴性对照组相比,阳性对照组、SIOL低、高剂量组在灌胃后第21、28天可显著抑制CIA大鼠踝关节肿胀,差异具有统计学意义(P<0.01),见图1。

图1 SIOL对CIA大鼠踝关节肿胀度的影响Fig.1 Effect of SIOL on swelling degree of ankle in CIA rats
2.2SIOL对CIA大鼠踝关节病理组织学损伤程度的影响HE染色结果显示,健康对照组大鼠踝关节软骨、骨组织无破坏,关节面光滑,滑膜组织内无炎症细胞浸润;阴性对照组大鼠滑膜组织明显增生嵌入关节腔,有大量炎症细胞浸润;与阴性对照组相比,阳性对照组大鼠滑膜组织增生显著降低,趋于正常,炎症细胞浸润减少;SIOL低剂量组各病变改善不明显;SIOL高剂量组滑膜组织增生显著减轻,关节腔嵌入程度明显改善,炎症细胞明显减少(图2)。
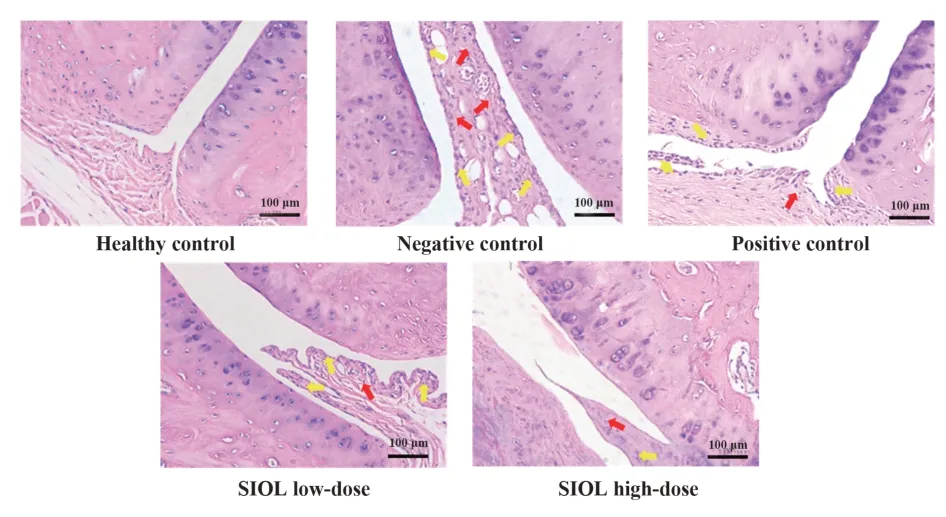
图2 SIOL对CIA大鼠踝关节组织病理学影响(HE,×100)Fig.2 Effect of SIOL on histopathology of ankle in CIA rats(HE,×100)
2.3SIOL对CIA大 鼠JNK、Bcl-2、Beclin-1、LC3mRNA表达的影响与健康对照组相比,阴性对照组JNK、Bcl-2、Beclin-1、LC3mRNA表达均显著升高(P<0.01);与阴性对照组相比,阳性对照组和SIOL低、高剂量组JNK、Bcl-2、Beclin-1、LC3mRNA表达均降低,差异具有统计学意义(P<0.01或P<0.05),见图3。
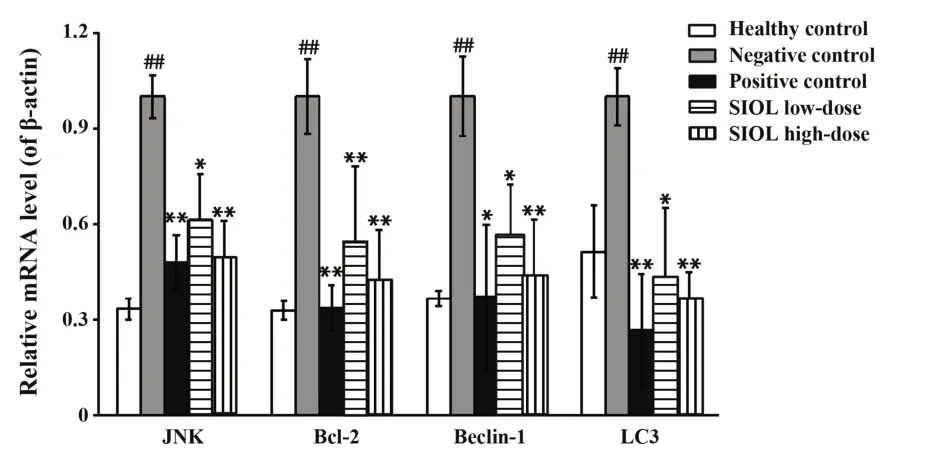
图3 SIOL对CIA大鼠关节滑膜组织JNK、Bcl-2、Beclin-1、LC3 mRNA表达的影响Fig.3 Effects of SIOL on mRNA expressions of JNK,Bcl-2,Beclin-1 and LC3 mRNA in synovial tissues of CIA rats
2.4SIOL对CIA大鼠滑膜组织中JNK、p-JNK、Bcl-2、Beclin-1、LC3-Ⅱ蛋白表达的影响Western blot检测JNK/Bcl-2/Beclin-1通路相关因子JNK、p-JNK、Bcl-2、Beclin-1、LC3-Ⅱ蛋白表达水平,结果表明:与健康对照组相比,阴性对照组p-JNK、Bcl-2、Beclin-1、LC3-Ⅱ相对蛋白表达水平均显著升高(P<0.01);与阴性对照组相比,阳性对照组、SIOL低、高剂量组p-JNK、Bcl-2、Beclin-1、LC3-Ⅱ相对蛋白表达水平均显著降低,差异均有统计学意义(P<0.01或P<0.05),各组JNK水平无明显差异,见图4。
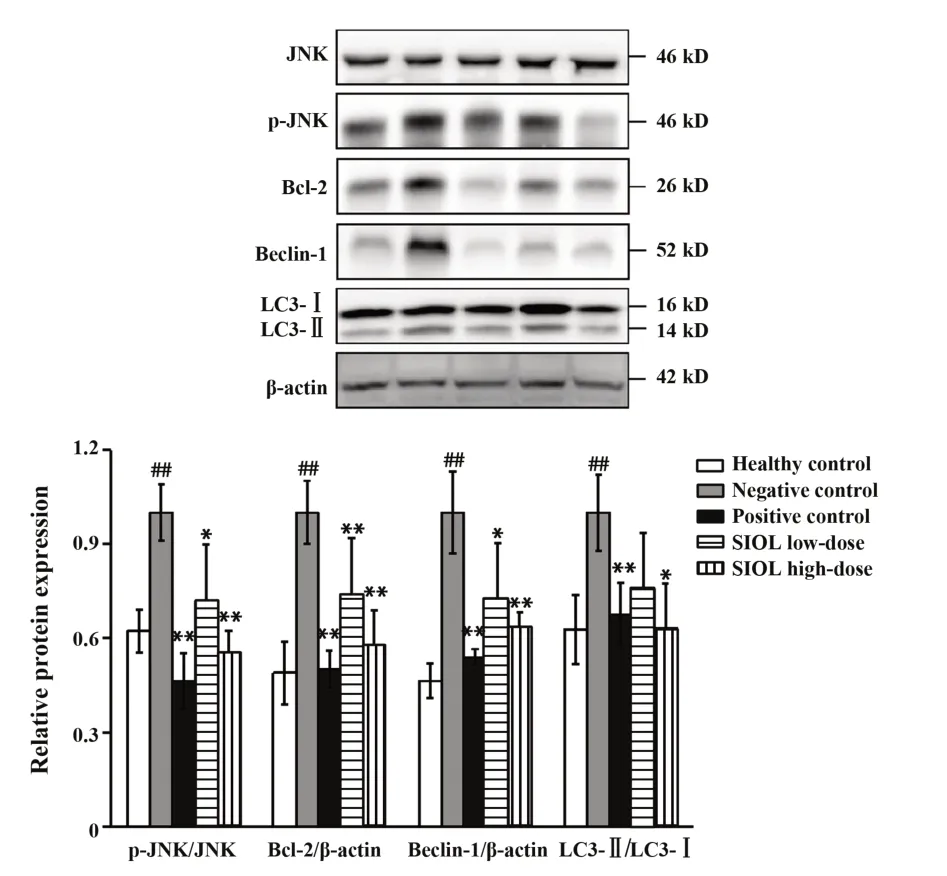
图4 SIOL对CIA大鼠关节滑膜组织JNK、p-JNK、Beclin-1、Bcl-2、LC3-Ⅱ蛋白表达的影响Fig.4 Effects of SIOL on protein expressions of JNK,p-JNK,Beclin-1,Bcl-2,LC3-Ⅱin synovial tissues of CIA rats
3 讨论
CIA大鼠是目前研究RA常用的动物模型,其主要病理表现为滑膜炎症细胞浸润、滑膜增生、软骨破坏和骨侵蚀,这些病理学表现与RA相一致[8]。本研究中大鼠注射CⅡ21 d后,大鼠表现出关节肿胀度增加,HE染色滑膜组织增生,炎症细胞浸润,这些表现与既往研究报道一致[8],提示造模成功。SIOL能减轻炎症细胞浸润和滑膜增生,减缓RA的关节破坏[9]。雷公藤多苷片具有免疫调节、抗炎等作用,是一种常用的RA治疗药物[10]。本研究选取雷公藤多苷片为阳性对照,结果表明SIOL高剂量组与阳性对照组之间JNK、Bcl-2、Beclin-1、LC3的表达水平差异较小,提示SIOL可作为雷公藤多苷片的替代疗法治疗RA。
自噬是一种重要的细胞内机制,通过降解细胞内病原体、受损细胞器和蛋白质聚集体来维持细胞和组织的稳态和完整性[11]。最近的研究表明,自噬与RA滑膜成纤维细胞(RASFs)有关[12]。生理情况下,RASFs自噬处于较低水平,病理情况下,RASFs自噬水平升高进而导致滑膜增生,加重RA病程[13]。JNK/Bcl-2/Beclin-1通路是自噬启动的重要途径,c-Jun氨基末端激酶(C-Jun N-terminal kinase,JNK)是一类丝氨酸/苏氨酸激酶,在内质网上,JNK被磷酸化激活后,导致抗凋亡蛋白Bcl-2活化,使Beclin-1从Bcl-2-Beclin-1复合物解离,游离的Beclin-1可启动自噬过程,使胞质形式的LC3(LC3-Ⅰ)通过与磷脂酰肌醇结合形成膜结合形式的LC3(LC3-Ⅱ),LC3-Ⅱ逐渐聚集并定位于自噬体膜上直到与溶酶体融合[14-15]。RA模型大鼠滑膜组织中自噬通路显著上调,进而导致滑膜增生[3]。本研究发现,阴性对照组关节滑膜组织中p-JNK、Bcl-2、Beclin-1、LC3蛋白表达水平均高于健康对照组,提示RA大鼠JNK/Bcl-2/Beclin-1通路被激活,自噬水平升高。SIOL灌胃28 d后,RA大鼠p-JNK、Bcl-2、Beclin-1、LC3蛋白表达水平均下降,提示SIOL干预后,RA大鼠JNK/Bcl-2/Beclin-1通路被抑制,细胞的自噬活动降低,从而改善RA症状。
综上所述,SIOL对CIA大鼠有一定的治疗作用,其机制可能与抑制JNK/Bcl-2/Beclin-1通路活性,进而抑制滑膜组织自噬有关。
