辣椒CAMTA 基因家族生物信息学分析
2022-10-01蒋宏华李雪峰
蒋宏华 李 丽 李雪峰*
(1 湖南省农业科学院蔬菜研究所,湖南长沙 410125;2 湖南省农业科学院科研基地管理中心,湖南长沙 410125)
植物主要是通过分子机制来优化生长和改善对环境约束的耐受性(Iqbal et al.,2020)。在生物和非生物胁迫下的植物生长发育中,钙离子(Ca)作为第二信使在真核生物中普遍存在(Galon et al.,2010),且发挥重要作用(Kudla et al.,2010;Reddy et al.,2011)。钙信号被认为是许多适应性过程和发育过程的核心调节信号,由钙调素(CaM)等一系列钙结合蛋白进行传输和解析。这些蛋白质通过调节转录因子(TFs)进一步传播信号以产生特定的下游反应(Xiao et al.,2021)。目前,至少有90 种转录因子被鉴定为CaM结合蛋白,如CAMTA、MYB、WRKY、NAC、bZIP 和MADS-box 蛋 白(Reddy et al.,2002;Popescu et al.,2007;Kim et al.,2009;Galon et al.,2010)。在这些转录因子中,钙调素结合转录激活因子(CAMTA)是1 个保守家族,也是与钙调素相关的最具特征的转录因子(Bouché et al.,2005;Finkler et al.,2007;Xiao et al.,2021),在Ca/CaM 驱动的模式中通过调节植物应激反应和整体发育发挥了重要作用(Bouché et al.,2002;Galon et al.,2010;Liu et al.,2015;Shkolnik et al.,2019)。
CAMTA 转录因子家族具有相同的功能结构域CG-1,这是1 个与DNA 结合有关的特异性结构域,可以激活下游基因的转录。Tig(transcription factor immunoglobulin)参与TFs 中的非特异性DNA 相互作用(Aravind &Koonin,1999),也参与蛋白质二聚化(Müller et al.,1995)。ANK 重复序列(ankyrin repeat)是多种真核生物蛋白质中约33 个氨基酸的串联重复模块,与蛋白质间的相互作用有关(Sedgwick &Smerdon,1999;Rubtsov &Lopina,2000)。串联重复的IQ 基序(IQ motif)以不依赖于Ca的方式与CaM 相互作用。在拟南芥()受到低温胁迫时,基因可诱导100 多个基因的表达(Vogel et al.,2005;Maruyama et al.,2010),其 中CAMTA 的CG-1 结构域可以与基因启动子中的CM2 顺式作用元件特异性结合,调控的表达,当和发生功能突变时,会抑制的表达;此 外,、和均可以诱导、和表达,并增强植物的抗冻性(Doherty et al.,2009)。拟南芥中的已被证实与种子萌发早期的钠(Na)稳态有关,突变体积累较少的NaCl,并表现出对盐分和ABA 的耐受性(Shkolnik et al.,2019)。突变体损害了光合作用效率和水分利用效率,植物含水量相对较低,生长迟缓,易受干旱胁迫影响(Pandey et al.,2013)。在其他物种中,也广泛参与了非生物胁迫的反应,在玉米()中,响应低温胁迫、盐胁迫、干旱胁迫(Yue et al.,2015);在小麦()中,响应低温胁迫、高温胁迫、盐胁迫、干旱胁迫(Yang et al.,2020);草莓()在高温、低温、盐胁迫下的表现也受到的调控(Leng et al.,2015)。
在拟南芥、水稻()等模式植物中均有报道,但在辣椒(L.)中还没有进行全面的研究。本试验通过PlantTFDB 数据库的信息获得5 个辣椒CAMTA 家族基因成员,通过分析这5 个CAMTA 家族成员的蛋白理化性质、蛋白保守结构域、基因结构及构建系统进化树,同时分析其在几种非生物胁迫与组织发育过程中表达量的变化等信息,为辣椒CAMTA家族基因在非生物胁迫与组织发育过程中信号转导与调控表达的功能研究提供理论基础,为辣椒抗逆研究提供新思路。
1 材料与方法
1.1 试验材料与基因表达量数据来源
试验材料为辣椒高代自交系6421,由湖南省农业科学院蔬菜研究所提供,对炭疽病、菌斑病和青枯病具有抗性。基因在非生物胁迫与不同组织发育阶段的表达量数据下载于PepperHub(http://pepperhub.hzau.edu.cn/;Liu et al.,2017)。
1.2 试验方法
1.2.1 基因表达量分析 ①激素和非生物胁迫处理。6421 种子用5%次氯酸钠溶液表面消毒15 min,清水洗涤,然后播于装满蛭石的200 孔育苗盘中。将育苗盘放置在30 L 的避光塑料箱上,箱内装满日本花园试验营养液,pH 值6.0。幼苗生长温度为25 ℃/18 ℃(昼/夜),光照/暗周期为16 h/8 h,相对湿度为60%~70%,光照强度为6 000 lx。
对播种40 d 后的幼苗进行激素和胁迫处理,在营养液中添加最终浓度为10 μmol · L茉莉酸甲酯(MeJA)作为激素处理,在营养液中添加最终浓度为200 mmol · L的NaCl 作为盐胁迫,在营养液中添加最终浓度为30 mmol · L的HO作为氧化胁迫,对照植株添加相应量的营养液。低温胁迫处理,将幼苗转移到10 ℃恒温的生长室中,光照/暗周期、相对湿度和光照强度与对照植株相同。采集胁迫处理后0、0.5、1、3、6、12、24 h 和对照植株叶片和根组织。考虑到生物钟对植物基因表达的影响,所有处理和对照植株的样本采集分别从胁迫处理第1 天的8:00、8:30、9:00、11:00、14:00、20:00 和第2 天的8:00 开始。每个样品4 次生物学重复,取样后迅速放入液氮中冷冻,并在-80 ℃下保存,用于RNA 提取。
② 组织不同发育时期。幼苗生长温度为白天25~29 ℃,夜间16~20 ℃。采用盆栽方式,每天通过滴灌系统补充复合肥料(N、P 和K)。为了采集不同发育阶段的果实样品,在开花当天对第4 分杈处的花进行标记。开花后3、7、10、15、20、25、30、35、40、45、50、55、60 d 采集标记花生长的果实。对于在开花后3、7 d 采集的果实,将整个果实研磨以提取RNA;而对于在开花后10 d 及其后采集的果实,将其切割并分为果肉、胎座和种子进行研磨提取RNA。每个样品由10个果实组成。根据花蕾的大小,在花蕾出现后2、5、10、15、20、25、30、40、50 d 收集花蕾,并将花蕾出现后60 d 时完全开放的花分为花瓣、带柱头的子房和雄蕊。在叶片出现后2、5、10、15、20、25、30、40、50、60 d 采集相同叶位的叶片样本。每个样品4 次生物学重复,取样后迅速放入液氮中冷冻,并在-80 ℃下保存,用于RNA 提取。
1.2.2 RNA 测序取样本总RNA 0.5~5.0 μg,用作RNA 样本制备的输入材料。使用NEBNext Ultra Directional RNA Library Prep Kit(Illumina,#E7420L,NEB,USA)生成测序库,并将索引代码添加到每个样本的属性序列中。使用Qubit 3.0中的Qubit DNA 检测试剂盒测定文库浓度,然后将其稀释至1 ng · μL。使用Bioanalyzer 2100 system(Agilent Technologies)评估文库中的插入大小,并使用StepOnePlus Real-Time PCR System(Applied Biosystems,Carlsbad,CA,USA)准确定量具有合格插入大小的文库。使用HiSeq SR Cluster Kit v4 cBot HS(Illumina,San Diego,CA,USA)在cBot 群集生成系统上对索引库进行聚类。聚类生成后,使用150 bp 配对末端模型在Illumina Hiseq 4000 平台上对文库进行测序。
1.2.3 mRNA 序列数据处理质量控制 使用FastQC 软件(Babraham Bioinformatics,http://www.Bioinformatics.Babraham.ac.uk)评估RNA 序列数据的质量。
1.2.4 映射和表达 使用hisat2 程序(Kim et al.,2015)将所有干净读取的片段映射到辣椒的参考基因组(http://peppersequence.genomics.cn;Qin et al.,2014)Zunla 和CM334(http://peppergenome.snu.ac.kr;Kim et al.,2014)中,设置为“max intronlen 15000—dta-cuラinks—rna-strandness RF”(Kim et al.,2015)。就映射到染色体锚定基因组的读取率而言,与基因组Zunla 的比对结果略好于CM334,因此在后续分析中选择Zunla 基因组作为参考。提取所有与Zunla 对齐的唯一映射读取,然后使用samtools 将其转换为排序的bam 文件(Li et al.,2009)。通 过HTSeq(Anders et al.,2015)计算映射到每个基因外显子的片段数量来量化基因表达。使用内部perl 程序将基因长度估计为所有外显子的长度之和,使用每千个碱基每百万个映射片段的片段数(fragments per kilobase million,FPKM)对每个基因的片段计数进行归一化,每个基因的表达水平计算为3 次生物复制的平均值。
1.2.5 邻近法系统进化分析 在PlantTFDB 网站(http://planttfdb.gao-lab.org/)得到辣椒5 个、拟南芥10 个、玉米10 个、水稻7 个、番茄()7 个CAMTA 基因家族的成员,使用MEGA 11 对得到的CAMTA 基因家族成员的氨基酸序列构建系统进化树,方法为邻近法(neighborjoining,NJ)。进行Clustal W 多重序列比对,并采用自展法(Bootstrap)进行检验,其中Bootstra 设置为1 000。
1.2.6 顺式作用元件分析 使用Plant Care 网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对辣椒的5 个CAMTA 家族基因的启动子进行在线预测,并筛选相关的顺式作用元件,使用TBtools 对顺式作用元件进行可视化。
1.2.7 蛋白理化性质与基因结构分析 利用ExPASy Proteomics Sever(https://www.expasy.org/)对获得的辣椒CAMTA 家族蛋白进行理化性质分析。利用GSDS(http://gsds.gao-lab.org/)对基因结构进行分析与可视化。使用MEME 网站(https://meme-suite.org/meme/tools/)对蛋白的保守序列进行分析,并使用TBtools 进行可视化。使用NCBI 网站(https://www.ncbi.nlm.nih.gov/)对蛋白序列进行分析,并使用TBtools 对功能结构域进行可视化。
2 结果与分析
2.1 辣椒CAMTA 基因家族信息及蛋白理化性质分析
辣椒5 个基因通过Protparam 进行定位分析表明(表1):5 个基因分别分布在4 条染色体上,且大小差异明显,基因全长最小,为270 bp;基因全长最大,为13 814 bp。CaCAMTAs 氨基酸数目在89~1 023 个之间;Capana01g002305 氨基酸数目最少,为89 个;Capana00g001755 氨基酸数目最多,为1 023 个。Capana01g002305 相对分子质量最小,为10.686 35 kD;Capana00g001755 相对分子质量最大,为115.200 58 kD。各基因的等电点分布较广,在5.81~9.10 之间,且5 个蛋白的不稳定系数均大于40,表明其编码产物并不稳定。
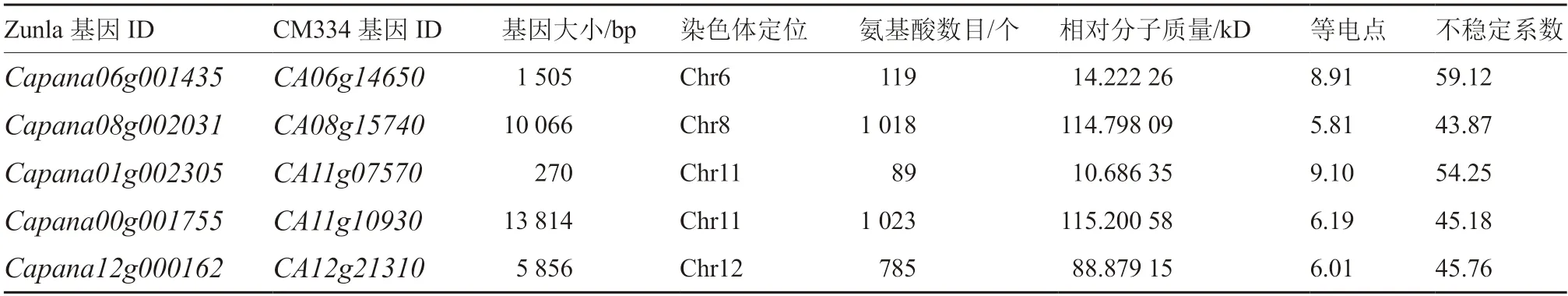
表1 辣椒CAMTA 基因家族信息及蛋白理化性质
2.2 辣椒CAMTA 基因家族基因结构分析
通过在线软件GSDS 对辣椒CAMTAs 基因结构进行可视化分析(图1),辣椒CAMTAs 基因不仅在长度上存在差异,而且在内含子与外显子数目上也存在差异。只有1 个外显子,含有3 个外显子,含有12 个外显子,和均含有13 个外显子。
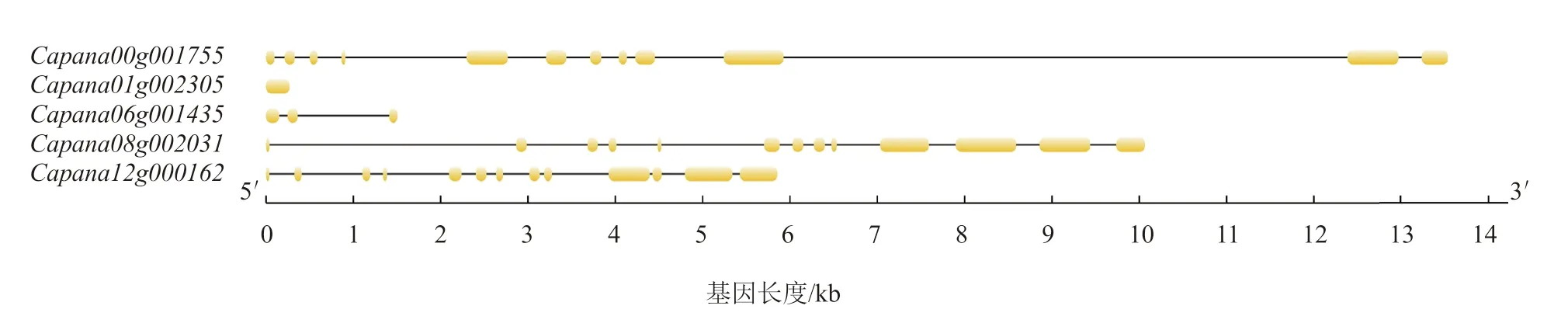
图1 辣椒CAMTA 基因家族基因结构分析结果
2.3 辣椒CAMTA 基因家族系统进化、保守基序和结构域分析
系统进化树分析显示(图2-A),辣椒CAMTA基因家族可以分为3 类,、和为I 类,为Ⅱ类,为Ⅲ类。
辣椒基因的蛋白质序列中共鉴定获 得5 个Motif(Motif1~Motif5),蛋白质序 列相对保守(图2-B),其位置与图2-C 结构域吻合。辣椒CAMTA 蛋白结构域分析结果如图2-C所示,该家族所有蛋白在N 端均含有CG-1 结构域,是与DNA 结合有关的特异性结构域,可以激活下游基因的转录。还有其他不保守的结构 域,如Capana08g002031 和Capana00g001755共有的TIG 结构域,Capana08g002031 独有的CBD 结构域,Capana00g001755 独有的IQ 结构 域,Capana08g002031、Capana00g001755 和Capana12g000162 共有的ANK 结构域。
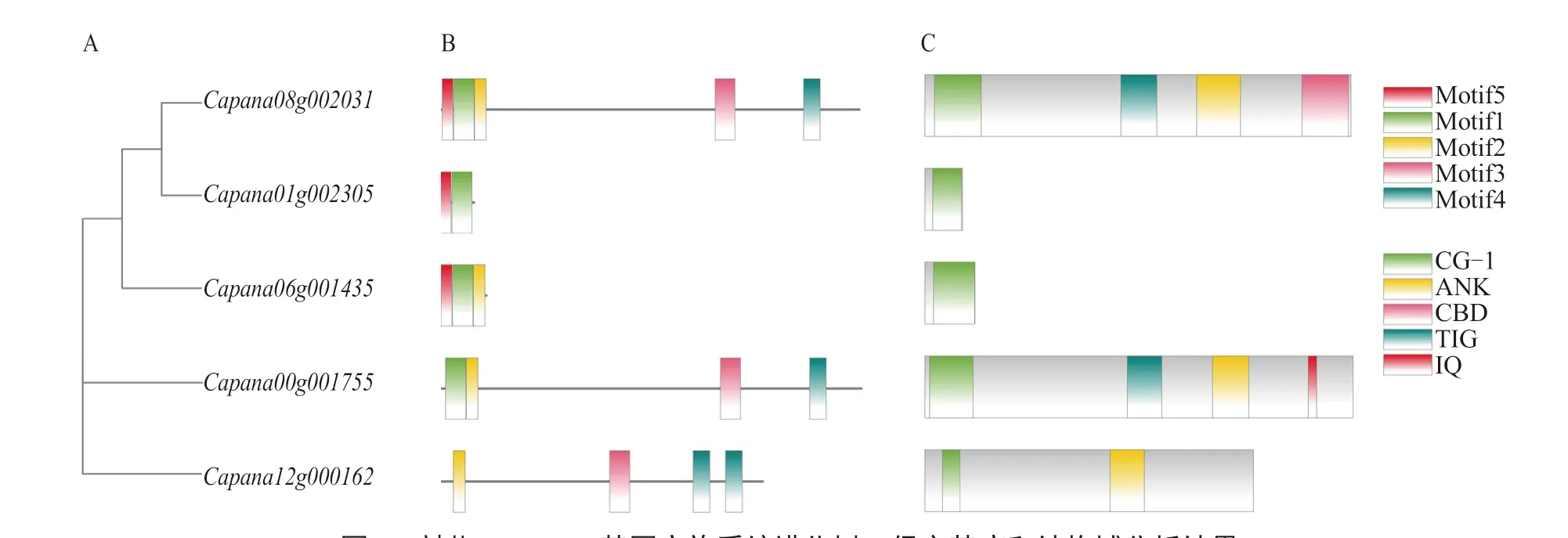
图2 辣椒CAMTA 基因家族系统进化树、保守基序和结构域分析结果
通过在线软件Swiss Model 对CaCAMTAs 家族蛋白进行三级结构预测,结果如图3 所示,辣椒CAMTA 家族蛋白构象并不完全相同,这与蛋白质的一级结构和二级结构有关,其中两条最小的蛋白Capana06g001435 和Capana01g002305 仅含有CG-1 结构域,其三维构象相仿。
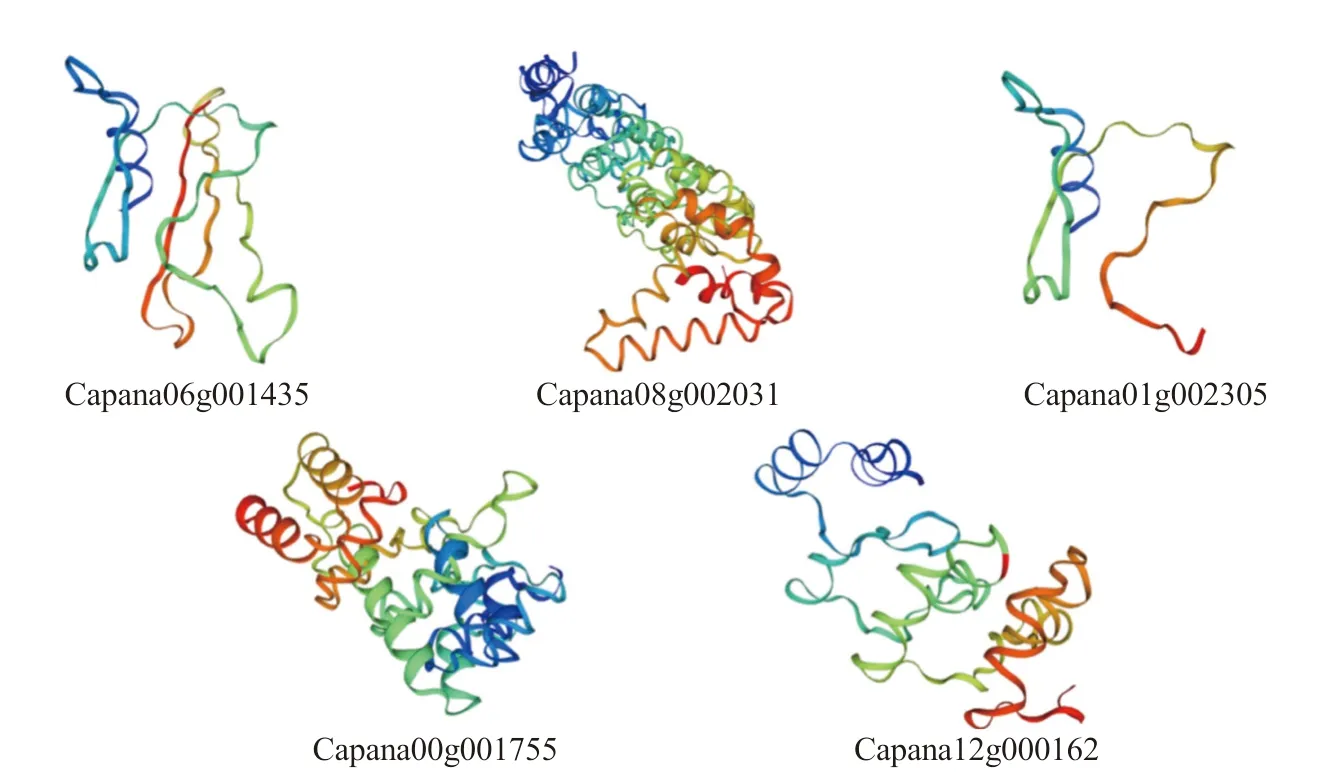
图3 辣椒CAMTA 基因家族蛋白质三级结构预测
2.4 辣椒CAMTA 基因家族系统进化分析
通过构建系统进化树,将辣椒与拟南芥、玉米、水稻、番茄的CAMTA 基因家族进行系统发育分析,结果如图4 所示。辣椒的5 个CAMTA可以分为3 个亚家族,Capana08g002031、Capana06g001435 和Capana01g002305 分 为1 组,Capana00g001755与Capana12g000162各自为1组。辣椒Capana08g002031 与番茄Solyc01g105230 亲缘关系最近,与拟南芥AT5G09410、AT5G64220 较近;辣椒Capana06g001435 与番茄Solyc01g057270亲缘关系较近;辣椒Capana01g002305 与水稻Os07g43030、玉米GRMZM2G431243 亲缘关系较近;辣椒Capana00g001755 与番茄Solyc05g015650亲缘关系最近,与番茄Solyc12g035520、拟南芥AT1G67310 亲缘关系较近;辣椒Capana12g000162与番茄Solyc12g099340 亲缘关系最近,与拟南芥AT4G16150、AT3G16940 亲缘关系较近。
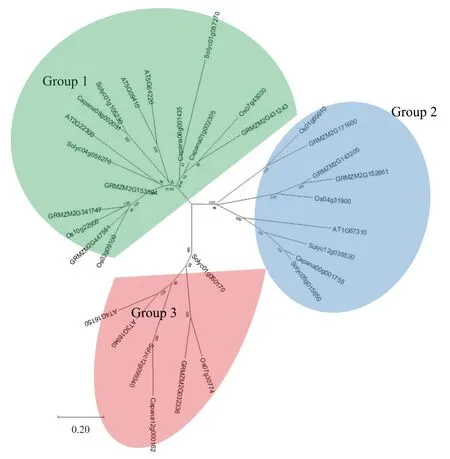
图4 辣椒、拟南芥、玉米、水稻和番茄CAMTA 基因家族系统进化分析结果
2.5 辣椒CAMTA 基因启动子顺式作用元件分析
通过辣椒CAMTA 基因启动子顺式作用元件分析,找出常见的顺式作用元件,包括防御应激反应元件和胁迫响应元件,结果如图5 所示。辣椒CAMTA 家族基因有9 种顺式调控元件,激素类的响应元件主要包括水杨酸响应元件(Salicylic acid responsiveness)、赤霉素响 应元 件(Gibberellin-responsiveness)、茉莉酸甲 酯响应元件(MeJA-responsiveness)、脱落酸响应元件(Abscisic acid responsiveness)、生长素响应元件(Auxin responsiveness),胁迫响应元件主要包括厌氧诱导响应元件(Anaerobic induction responsiveness)、防御和应激响应元件(Defense and stress responsiveness)、低温响应元件(Low temperature responsiveness)、干旱诱导的MYB 结合位点(MYB binding site)。表明辣椒基因与响应辣椒的非生物胁迫关系密切。
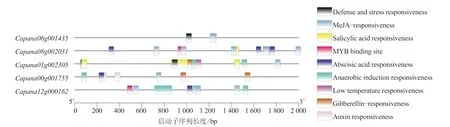
图5 辣椒CAMTA 基因启动子顺式作用元件分析结果
2.6 激素和胁迫处理下辣椒CAMTA 基因表达分析
通过定量分析辣椒CAMTA 家族基因在激素和非生物胁迫处理下的表达情况,基因表达量变化如图6 所示。在低温胁迫下,与对照相比,表达量下调,、在叶片中表达量上调,在根中处理12 h 时下调表达。NaCl 胁迫下,在叶片中处理6 h 后就开始上调表达,在根中处理24 h 时下调表达,在叶片中处理3 h 后开始上调表达,在叶片中处理6 h 后上调表达,在根中处理1.5 h 后上调表达。HO胁迫下,表达量上 调,表达量在叶片中处理6 h 后上调,在根中处理3 h 时下调表达,处理12 h 后上调表达,变化不显著。MeJA处理后,、与表达量均下调,而与表达量低且变化不明显。辣椒在低温、NaCl、HO与MeJA处理后,、与表达量均有不同程度的变化,表明辣椒CAMTA 基因家族参与了胁迫后的信号转导过程。
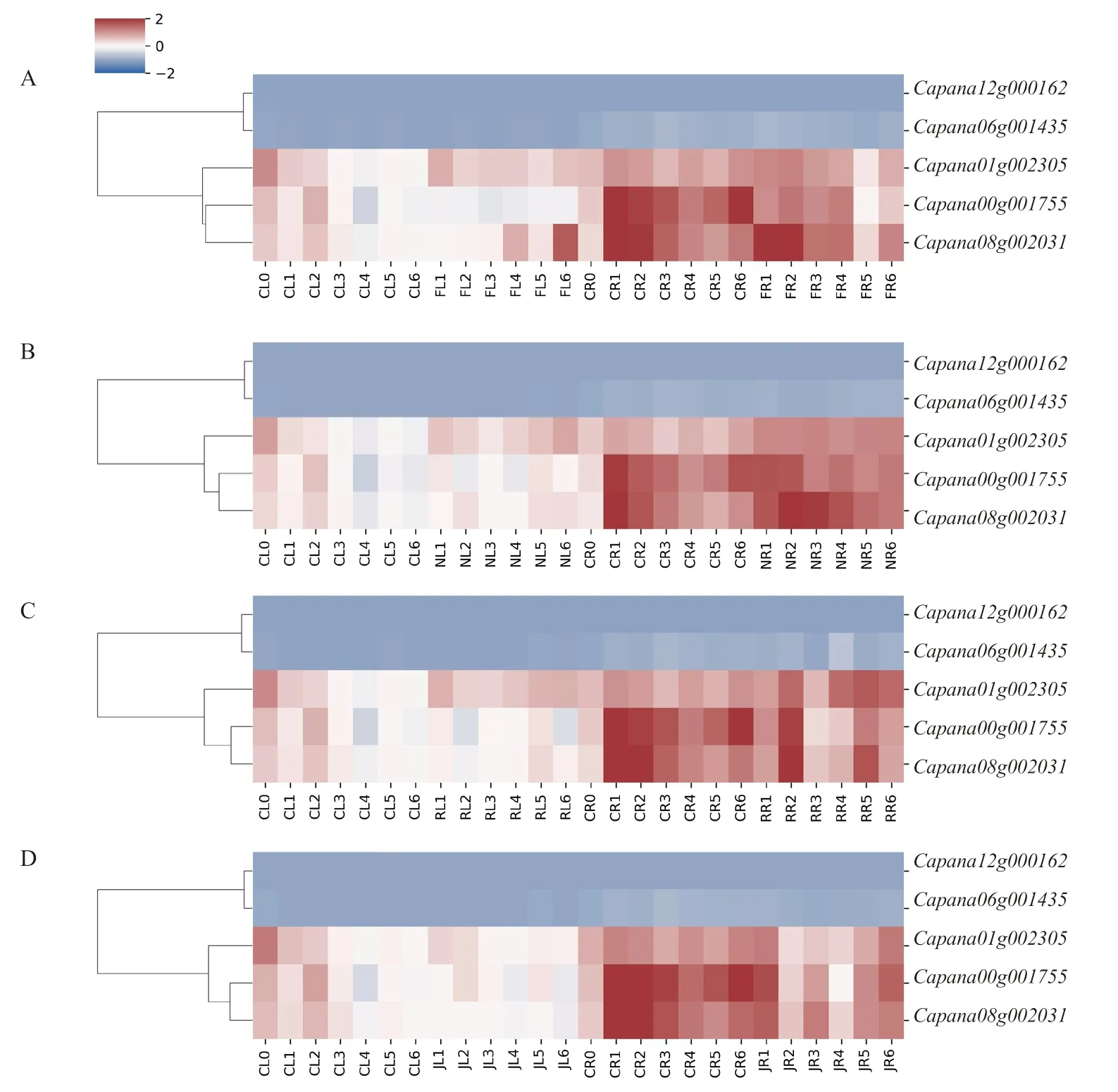
图6 CaCAMTA 基因在不同处理后的表达量变化
2.7 组织不同发育时期辣椒CAMTA 基因表达分析
为探究辣椒CAMTA 基因家族是否在组织发育过程中发挥了作用,对辣椒在叶片、花、果实不同发育时期的表达量进行了分析。在整个发育阶段表达量低且无明显变化,只在花蕾发育的2~10 d(图7-A)、胎座发育的40 d(图7-B)上调表达,而在其他组织的发育过程中变化不明 显。、和表达模式类似,在叶片、花蕾发育过程中有明显的表达量变化,在子房、花瓣、雄蕊中的表达量依次降低(图7-A)。在果肉、胎座、种子、早期的种子与胎座的发育过程中均有明显的表达量变化,种子发育的前期表达量较高,随后下调表达,这表明、和对种子发育的调节作用主要发挥在早期(图7-B)。
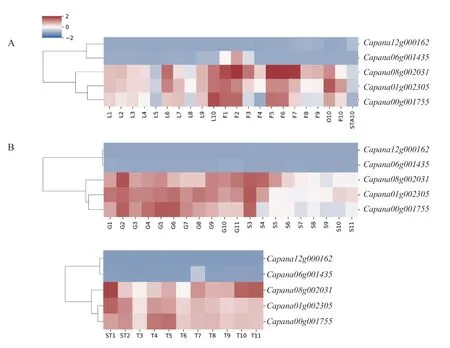
图7 CaCAMTA 基因在叶片、花、果实中不同时期的表达量变化
3 结论与讨论
了解植物对胁迫响应的分子机制对分析植物的生命活动具有重要意义,并进一步影响农业生产。CAMTA 家族作为钙调素转录激活因子,在植物受到胁迫信号转导过程中必然发挥着重要的作用。5 个辣椒CAMTA 基因分布在4 条染色体上,基因大小差异极大,内含子外显子数目也不尽相同,表达的蛋白质等电点变化范围较大且不稳定系数大于40,表明其表达产物并不稳定,唯一共同点是其共有的CG-1 结构域,可与DNA 特异性结合,并激活下游基因转录。对其启动子分析发现,CAMTA基因家族含有多个与胁迫相关的顺式作用元件,表明其在胁迫响应过程中的重要作用。在其他物种中的大量研究也已有证明。例如,在拟南芥中,、与协同工作,直接结合在的启动子上诱导表达,从而提高植物的抗冻性(Kim et al.,2013);也通过调节一些应激反应基因来积极应对干旱反应,包括、(Pandey et al.,2013)。本试验通过测定低温、盐、过氧化氢与茉莉酸甲酯处理后辣椒基因表达量的变化,表明在辣椒中CAMTA同样参与了多种非生物胁迫的响应。CAMTA 基因家族对胁迫的响应并不局限于非生物胁迫,在非生物胁迫产生的调控过程中同样发挥着重要作用,如可以作为植物免疫的负调节因子,通过激活介导的水杨酸(SA)信号来调节病原体防御反应(Du et al.,2009);可能是小麦条锈病防御反应的负调节因子,病毒诱导基因沉默(VIGS)后小麦的抗性增强。
本试验中,对叶片、花、果实中不同发育时期的表达量变化分析表明,辣椒CAMTA 基因家族在组织的发育过程中同样发挥了作用。在其他植物中,同样有报道基因表达的空间差异与植物生长和发育有关(刘文宇 等,2021)。在拟南芥花粉发育过程中,和可以增强在花粉中的特异性表达(Li et al.,2005)。在烟草中过表达基因(),叶片和花瓣出现早衰的表型,这意味着CAMTA 参与了发育调节(Yang &Poovaiah,2000)。本试验结果可以为辣椒CAMTA 基因家族成员的生物学功能研究与分子机制研究提供参考,同时为分子育种提供方向。
