布鲁氏菌分泌蛋白BspA 和BspB 真核表达载体的构建及在胚胎滋养层细胞中的表达
2022-09-30王书利魏淑娟李梦含司丽芳李志强
王书利,魏淑娟,李梦含,郑 好,司丽芳,李志强
(1. 河南科技大学 动物科技学院,河南 洛阳 471003;2. 商丘师范学院 生物与食品学院,河南 商丘 476000;3. 河南师范大学 生命科学学院,河南 新乡 453007)
布鲁氏菌病(Brucellosis)是由布鲁氏菌(Brucella)引起的一类人畜共患传染病,给许多国家带来巨大的经济损失[1]。该病可导致雌性动物出现流产、死胎,雄性动物表现为睾丸炎和附睾炎,从而影响受感染动物的繁殖性能[2]。人感染布鲁氏菌后,可引起波浪热、感染性心内膜炎、脾脓肿、子宫内膜炎、结节性红斑和败血症等[3]。吸入细菌气溶胶、摄入受污染的食品或接触伤口、黏膜是人感染的主要途径[4]。据估计,每年约新增50 万人类感染病例[5]。
布鲁氏菌Ⅳ型分泌系统(Type Ⅳsecretion system,T4SS)是由12 种蛋白质(VirB1—VirB12)组成的大分子复合物,是布鲁氏菌的重要毒力因子,由virB操纵子编码,在调节胞内存活和操纵宿主对细菌感染的免疫反应中发挥重要作用[6]。布鲁氏菌可通过T4SS分泌的效应蛋白进入宿主细胞,效应蛋白可改变病原菌的胞内运输,逃避感染细胞的免疫监视,维持布鲁氏菌在细胞的持续性感染[7]。MYENI 等[8]通过生物信息学和TEM-1 融合蛋白方法鉴定发现,BspA 和BspB 蛋白为T4SS 的分泌蛋白。BspA 和BspB 蛋白分别由191 个和187 个氨基酸组成,包含DUF2062 结构域(功能未知的结构域2062,Pfam 数据库)和蛋白质结构分类(SCOP)结构域(两侧有2个跨膜结构域)[8]。异位表达的BspA 和BspB 蛋白定位于内质网内[8],其在胞内与哪些宿主分子相互作用还未见报道。鉴于此,以布鲁氏菌T4SS 效应蛋白BspA 和BspB 为研究对象,利用分子克隆技术构建真核表达载体,以获得具有活性的BspA 和BspB 效应蛋白,为进一步研究布鲁氏菌分泌蛋白BspA和BspB的功能提供参考。
1 材料和方法
1.1 菌株、载体和细胞
布鲁氏菌S2308 基因组和pEGFP-N1 载体由石河子大学张辉教授馈赠;T-Vector pMDTM19(Simple)购自Takara 公司;胚胎滋养层细胞(HPT-8)由石河子大学张辉教授馈赠。
1.2 主要试剂和仪器
普通琼脂糖凝胶DNA 回收试剂盒、高纯度质粒小提试剂盒、无内毒素质粒大提试剂盒均购自天根生化科技(北京)有限公司;QuickCutTMEcoRⅠ和XbaⅠ限制酶购自Takara 公司;LipofectamineTM2000脂质体购自美国Invitrogen 公司;鼠抗BspA 和鼠抗BspB单克隆抗体购自英国Abcam 公司;辣根过氧化物酶(HRP)标记的山羊抗鼠IgG(H+L)购自美国Bioworld 公司;乳酸脱氢酶(LDH)细胞毒性检测试剂盒购自碧云天生物技术有限公司;人IFN-γ、IL-2、IL-4 和IL-5 细胞因子ELISA 检测试剂盒均购自美国R&D Systems公司。
PCR 仪(nexus GSX1)购自德国Eppendorf 公司,凝胶成像系统(Gel Doc XR+)购自美国BIO-RAD 公司,分子杂交箱(Big SHOT Ⅲ)购自美国Boekel Scientific 公司,生物安全柜(BIO ⅡA)购自西班牙Telstar 公司,半干式转膜系统购自北京六一生物科技有限公司。
1.3 引物设计与PCR扩增
根据布鲁氏菌S2308 的BspA(BAB1_0678)和BspB(BAB1_0712)基因序列,利用Primer Premier 5.0 软件设计引物(表1),并由生工生物工程(上海)股份有限公司合成。
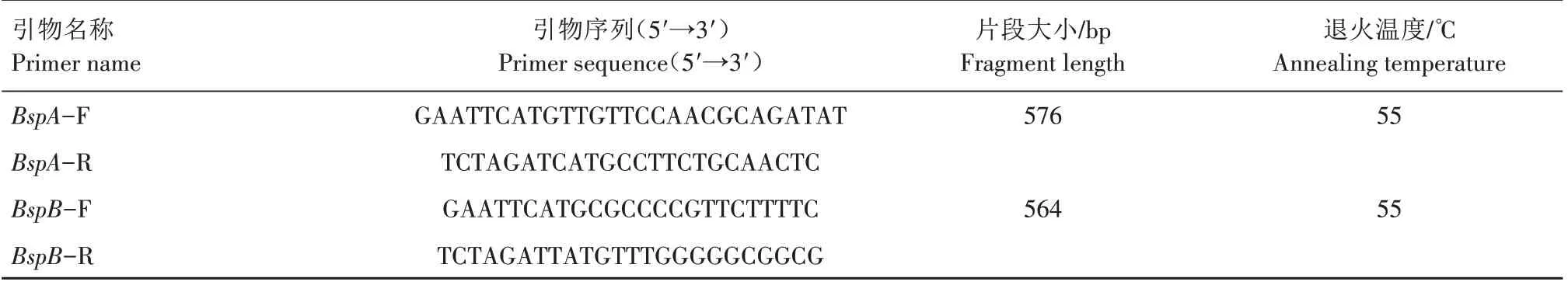
表1 布鲁氏菌BspA和BspB基因的引物序列Tab.1 Primer sequences of BspA and BspB genes of Brucella
以布鲁氏菌S2308 基因组或ddH2O(阴性对照)为模板,利用表1 中的引物,分别对BspA和BspB基因进行PCR 扩增。对PCR 产物进行1.5%琼脂糖凝胶电泳检测,将目的片段切胶回收纯化。
1.4 重组质粒pMD-BspA和pMD-BspB的构建和鉴定
将回收后的BspA和BspB目的片段分别与TVector pMDTM19(Simple)连接,连接后的产物转化感受态细胞DH5α 中,涂布含Amp(100 mg/L)的LB平板,筛选阳性菌,提取质粒,利用EcoRⅠ和XbaⅠ进行双酶切鉴定。将鉴定正确的质粒分别命名为pMD-BspA和pMD-BspB,并送生工生物工程(上海)股份有限公司测序。
1.5 真核表达载体pEGFP-BspA和pEGFP-BspA的构建和鉴定
将重组质粒pMD-BspA、pMD-BspB和pEGFPN1 载体利用EcoRⅠ和XbaⅠ进行双酶切,经1.0%琼脂糖凝胶电泳后,回收酶切产物,连接pEGFP-N1载体,转化DH5α感受态细胞,涂布含Amp(100 mg/L)的LB 平板,筛选阳性菌,提取质粒,利用EcoRⅠ和XbaⅠ进行双酶切鉴定。将鉴定正确的质粒分别命名为pEGFP-BspA和pEGFP-BspB,并送生工生物工程(上海)股份有限公司测序。
1.6 细胞转染
利用LipofectamineTM2000 进行细胞转染[9]。将HPT-8细胞传代于6孔板中,待细胞密度达到70%~80%时,分别取5 μg pEGFP-BspA、pEGFP-BspB或pEGFP-N1(阴性对照),加至1 mL 不完全DMEM 培养基中,再加入10 μL LipofectamineTM2000,混匀后室温静置20 min。将该混合液加至细胞培养孔进行转染,转染后的细胞置于37 ℃、5% CO2培养箱中,6 h 后弃去培养液,用PBS 液漂洗2 次,更换新鲜的完全培养基继续培养。24 h 后弃掉培养液,使用RAPA 裂解液裂解细胞,获得总蛋白质样品,对蛋白质浓度进行测定后,置于-20 ℃保存。
1.7 Western blot检测BspA和BspB的表达
将蛋白质样品加热变性后,进行SDS-PAGE 电泳。电泳结束后,将目的凝胶切下,利用半干式电转法,以200 mA电流转膜1 h,将目的蛋白质转印至硝酸纤维素膜(NC膜)上;用5 mL含5%脱脂奶粉的封闭液37 ℃封闭1 h;用TBST 洗膜3 次,加入5 mL一抗(鼠抗BspA 和BspB 单克隆抗体,稀释比例为1∶5 000),37 ℃孵育1 h;用TBST 洗膜3 次,加入5 mL 二抗(HRP 标记的山羊抗鼠IgG,稀释比例为1∶2 000),37 ℃孵育1 h;用TBST 洗膜3 次后,进行ECL化学发光检测[10]。
1.8 细胞因子检测
按1.6 中的方法转染HPT-8 细胞,分别在转染后12、24、48 h 收集细胞培养液,培养液经0.22 μm的滤膜过滤后,利用人IFN-γ、IL-2、IL-4 和IL-5 细胞因子ELISA 检测试剂盒检测细胞因子水平[11]。试验设3个重复。
1.9 细胞毒性检测
按1.6 中的方法转染HPT-8 细胞,分别在转染后12、24、48 h 利用乳酸脱氢酶细胞毒性检测试剂盒,测定细胞毒性[12]。乳酸脱氢酶释放量的计算方法:LDH=(处理样品吸光度-样品对照孔吸光度)/(细胞最大酶活性的吸光度-样品对照孔吸光度)×100%。
2 结果与分析
2.1 BspA和BspB基因的PCR扩增结果
BspA基因片段的大小为576 bp,BspB基因片段的大小为564 bp(图1)。
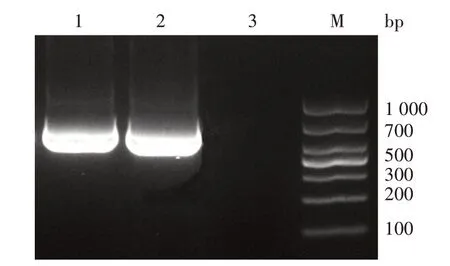
图1 布鲁氏菌BspA和BspB基因的PCR扩增结果Fig.1 PCR amplification products of the BspA and BspB genes of Brucella
2.2 重组质粒pMD-BspA和pMD-BspB的酶切鉴定结果
由图2 可知,重组质粒pMD-BspA和pMD-BspB经EcoRⅠ和XbaⅠ双酶切后,获得的条带大小分别为576 bp 和564 bp。测序结果表明,成功构建pMD-BspA和pMD-BspB载体。
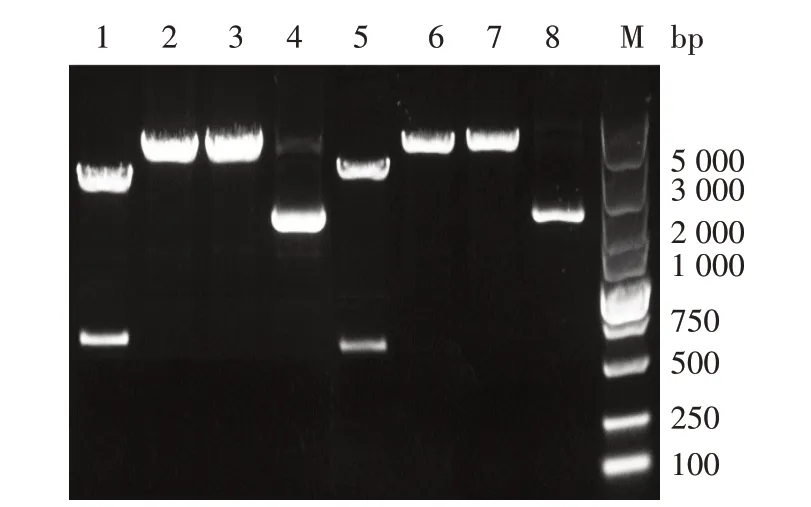
图2 重组质粒pMD-BspA和pMD-BspB的酶切鉴定结果Fig.2 Identification of recombinant plasmids pMD-BspA and pMD-BspB by enzyme digestion
2.3 重组质粒pEGFP-BspA和pEGFP-BspB的酶切鉴定结果
重组质粒pEGFP-BspA和pEGFP-BspB经EcoRⅠ和XbaⅠ双酶切鉴定,琼脂糖凝胶电泳结果显示,出现2 条目的条带,一条为pEGFP-N1 载体片段,另一条为目的基因条带(图3),且测序结果与GenBank登录的序列同源性为100%,表明重组质粒pEGFPBspA和pEGFP-BspB构建正确。
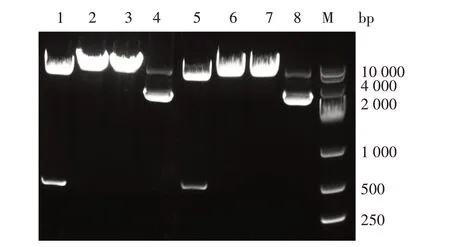
图3 重组质粒pEGFP-BspA和pEGFP-BspB的酶切鉴定结果Fig.3 Identification of recombinant plasmids pEGFPBspA and pEGFP-BspB by enzyme digestion
2.4 BspA和BspB蛋白的表达结果
Western blot 分析结果显示,转染空载体的对照组未出现条带,而转染pEGFP-BspA和pEGFP-BspB组分别在70 ku和68 ku处出现目的条带(图4)。结果表明,BspA和BspB蛋白在HPT-8细胞中成功表达。
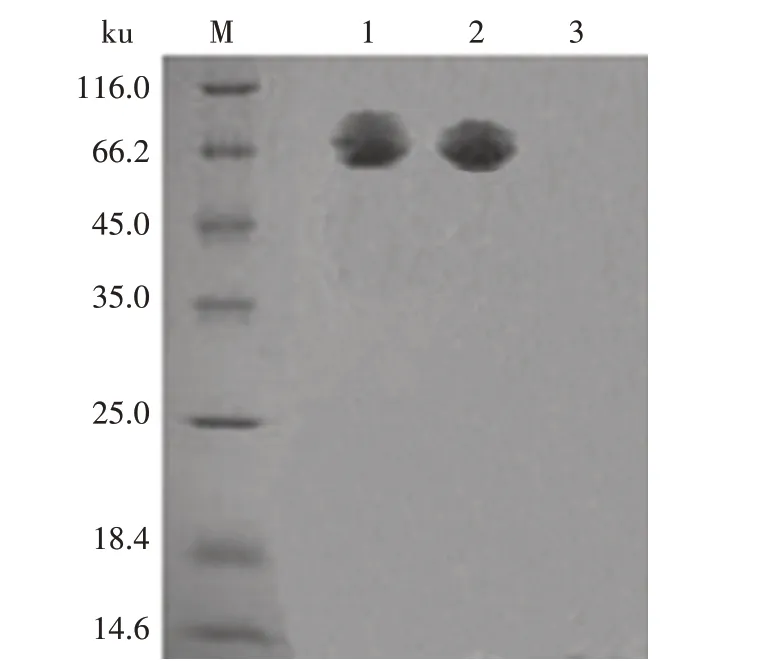
图4 Western blot检测BspA和BspB蛋白的表达结果Fig.4 Expression of BspA and BspB proteins detected by Western blot
2.5 BspA和BspB蛋白对细胞因子分泌的影响
细胞因子检测结果显示,与对照组(pEGFP-N1空质粒转染组)相比,pEGFP-BspA和pEGFP-BspB重组质粒转染的细胞中有较高水平的细胞因子产生(P<0.01)(图5)。此外,BspA 和BspB 蛋白诱导HTP-8 细胞产生Th1 型细胞因子IFN-γ 和IL-2 的水平略微高于Th2型细胞因子IL-4和IL-5的水平。以上结果表明,pEGFP-BspA和pEGFP-BspB转染HPT-8 细胞后,可诱导Th1 和Th2 型细胞因子的产生,且BspA 和BspB 蛋白诱导HTP-8 细胞产生细胞因子不存在偏好性。
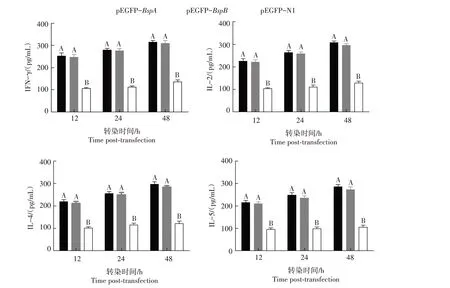
图5 pEGFP-BspA和pEGFP-BspB转染HPT-8细胞后IFN-γ(A)、IL-2(B)、IL-4(C)和IL-5(D)的水平检测结果Fig.5 Productions of IFN-γ(A),IL-2(B),IL-4(C)and IL-5(D)in HPT-8 cells transfected with pEGFP-BspA and pEGFP-BspB
2.6 BspA和BspB蛋白对细胞毒性的影响
细胞毒性检测结果(图6)显示,pEGFP-BspA和pEGFP-BspB重组质粒转染细胞12 h 后,细胞乳酸脱氢酶的释放量分别为5.88%和5.72%,pEGFP-N1转染细胞的乳酸脱氢酶释放量为3.52%;转染细胞24 h 后,细胞乳酸脱氢酶的释放量分别为6.17%和6.08%,pEGFP-N1转染细胞的乳酸脱氢酶释放量为4.63%;转染细胞48 h 后,细胞乳酸脱氢酶的释放量分别为6.58%和6.43%,pEGFP-N1转染细胞的乳酸脱氢酶释放量为5.05%。随着转染时间的延长,细胞乳酸脱氢酶的释放水平逐渐增加,但各组差异均不 显 著(P>0.05)。结 果 表 明,pEGFP-BspA和pEGFP-BspB重组质粒转染细胞后,对细胞无毒性反应。
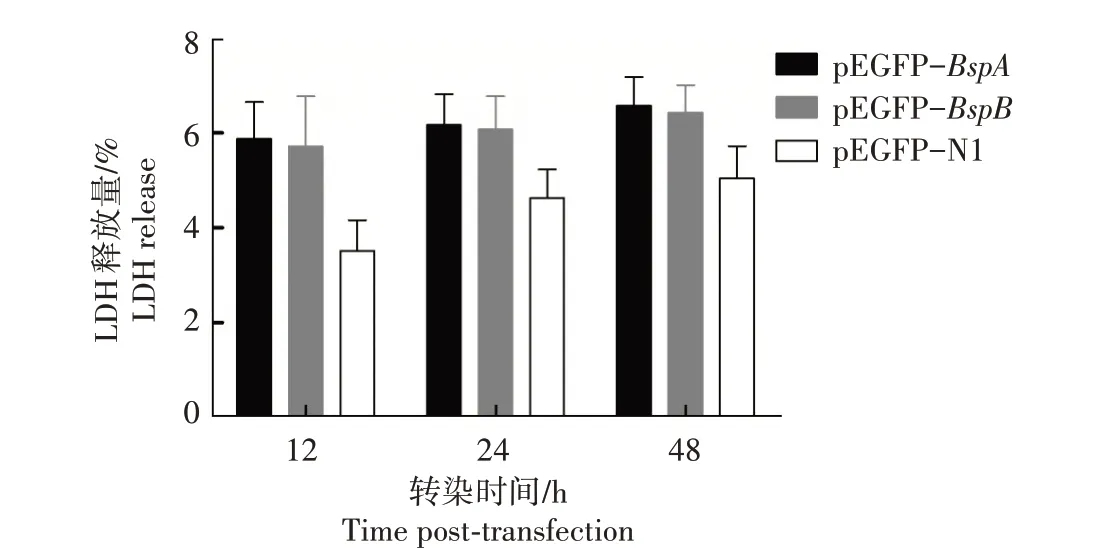
图6 BspA和BspB蛋白对HPT-8细胞的毒性Fig.6 The cytotoxicity of BspA and BspB proteins on HPT-8 cells
3 结论与讨论
布鲁氏菌为胞内寄生菌,T4SS是其关键的毒力因子,在感染期间抑制宿主免疫应答和调控胞内生存中发挥重要作用[13]。已有研究证明,在受感染的人宫颈癌细胞(HeLa)中,BspA 和BspB 蛋白可抑制宿主蛋白的分泌[8]。此外,BspA 和BspB 蛋白在转染细胞中过表达时可抑制宿主细胞的蛋白质分泌途径[8]。虽然BspA和BspB缺失后,影响布鲁氏菌在巨噬细胞内的繁殖能力,以及在感染小鼠肝脏中的生存能力[8],但仅在感染后期发挥作用,并且BspA 蛋白与BspB 蛋白具有互补功能。本研究成功构建了真核表达载体pEGFP-BspA和pEGFP-BspB,转染HPT-8细胞后,经Western blot检测,分别于70 ku和68 ku 处出现了目的条带,表明HPT-8 细胞表达的BspA 和BspB 蛋白具有良好的反应原性,为下一步筛选宿主互作蛋白提供了材料。
本研究选取的pEGFP-N1载体具有高效稳定表达目的蛋白的作用,该载体含有多克隆位点,可融合表达多种外源基因,并能保持外源蛋白的生物学活性,广泛应用于基因的表达检测[14-15]。张沾等[16]构建了T4SS 效应蛋白VceC 的真核表达载体pEGFPVceC,转染HPT-8 细胞后,促进细胞释放一氧化氮(NO)和增加乳酸脱氢酶活力。李跃峰等[17-18]利用pEGFP-N1载体构建了结核杆菌CFP10基因的重组真核表达载体pEGFP-N1-CFP10,转染人肾上皮细胞(293T)后,对细胞有促凋亡的作用。王慧勤等[19]研发了基于结核杆菌ESAT6基因的DNA 疫苗,免疫小鼠后可诱导机体产生有效的细胞免疫应答。此外,结核分支杆菌分泌蛋白Rv2031c 和Rv2626c 的融合表达重组载体pEGFP-N1-Rv2031c和pEGFPN1-Rv2626c转染293T 细胞后24、48 h 时促进了细胞凋亡[20]。除了293T 细胞外,HPT-8 细胞也被广泛用于表达研究外源基因,验证所构建的载体是否有效表达[21],且该细胞为布鲁氏菌的靶细胞[22-23]。本研究利用构建的重组质粒pEGFP-BspA和pEGFPBspB转染HPT-8 细胞,经Western blot 证实BspA 和BspB 蛋白获得表达,为筛选BspA 和BspB 在宿主细胞中的互作蛋白,研究效应蛋白BspA 和BspB 对宿主细胞正常代谢、凋亡等生理功能的影响及作用机制奠定了基础。
以产生IFN-γ 和IL-2 为特征的Th1 型免疫应答与布鲁氏菌的保护性免疫有关[24]。IFN-γ 可刺激Th1分化,从而诱导活化浆细胞产生抗体[25]。IFN-γ在感染早期根除胞内病原菌方面发挥重要作用[26]。IL-2 与布鲁氏菌的保护性免疫有关。IFN-γ 和IL-2是布鲁氏菌诱导Th1型免疫中的关键细胞因子[27]。IL-4 是一种重要的抗炎因子,参与对抗细胞外病原体,属于Th2 型细胞因子[28]。IL-5 由Th2 型细胞产生,是一种主要参与特应性疾病发病机制的细胞因子[29]。IL-4 和IL-5 的功能相互补充,促进Th2 细胞介导的过敏反应[30]。本研究发现,BspA 和BspB 蛋白可诱导产生较高水平的IFN-γ、IL-2、IL-4 和IL-5,表明BspA 和BspB 蛋白可诱导Th1 和Th2 型混合免疫反应。
BspA和BspB基因大小分别为576 bp 和564 bp。重组质粒pEGFP-BspA和pEGFP-BspB转染HPT-8细胞后,经Western blot 检测显示,分别在70 ku 和68 ku 处出现目的条带,表明真核表达载体能在HPT-8 细胞中表达。此外,BspA 和BspB 蛋白均可诱导细胞分泌Th1 型细胞因子(IFN-γ 和IL-2)和Th2型细胞因子(IL-4和IL-5),且不存在偏好性,对HPT-8 细胞无毒性。本研究为筛选分泌蛋白BspA和BspB在宿主细胞的互作蛋白,从宿主互作分子角度阐述布鲁氏菌逃避免疫的机制奠定了基础。
