胸腺肽α1辅助抗结核药物治疗结核病的效果分析
2022-09-29屈家扶邹兰花
屈家扶,邹兰花
(江门市新会区结核病防治所,广东 江门 529100)
结核病是指因结核分枝杆菌感染引起的一种慢性传染病。结核分枝杆菌感染的靶器官主要是肺脏,因此在结核病中肺结核较为常见。结核分枝杆菌也可侵及肺脏以外的其他器官,引起肺外结核病[1]。结核病自发现以来就一直是重大的公共卫生问题。2018 年的统计数据显示,结核病的发病率为61/10 万,近年来由于结核病防治工作的有序开展,结核病的发病率较10 年前已显著下降[2-3]。结核病的易感人群主要包括免疫力低下者、慢性病患者、长期应用类固醇激素或免疫抑制剂者、部分恶性肿瘤患者、婴幼儿、青少年及老年人等。在传播途径方面,结核分枝杆菌以飞沫传播为主,其他传播途径较为少见。目前临床上常联用多种抗结核药物治疗结核病,但由于耐药性等问题,导致患者的临床疗效不理想,因此需要不断改进治疗方案,以获得理想的疗效[4]。胸腺肽α1是一种胸腺激素,可调节机体的免疫功能。既往的研究证实,结核病的发生、发展均与患者免疫功能低下有直接的关系,因此给予此病患者免疫调节药物能在一定程度上提高其治疗效果[5]。基于该思路,本文将江门市新会区结核病防治所收治的80 例结核病患者作为研究对象,探讨用胸腺肽α1辅助抗结核药物治疗结核病的效果。
1 资料与方法
1.1 一般资料
本研究为前瞻性研究。选取江门市新会区结核病防治所2018 年8 月至2020 年8 月收治的80 例结核病患者作为研究对象。其纳入标准是:患有肺结核,且符合《肺结核诊断和治疗指南》中关于肺结核的诊断标准[6];病情首次确诊;具备独立自主的生活能力。其排除标准是:合并有其他感染性疾病;近期使用过糖皮质激素或免疫抑制剂;合并有严重的内科慢性疾病;患有精神分裂症等严重的精神疾病;处于妊娠期或哺乳期;对本研究中所用的药物过敏。使用SAS 软件将其随机分为对照组和观察组,每组各有患者40 例。在对照组患者中,有男性24 例,男性16 例;其年龄为19 ~68 岁,平均年龄为(42.04±15.76)岁;其病程为1 ~6 个月,平均病程为(3.05±1.42)个月。在观察组患者中,有男性25 例,男性15 例;其年龄为18 ~66 岁,平均年龄为(42.11±15.52)岁;其病程为1 ~7 个月,平均病程为(3.20±1.48)个月。两组患者的一般资料相比,差异无统计学意义(P>0.05),有可比性。本研究获得该所医学伦理委员会的批准,且研究对象均对研究内容知情,并签署了知情同意书。
1.2 方法
对对照组患者进行常规抗结核治疗,分阶段实施治疗方案,方法是:1)强化期治疗,予以患者异烟肼(生产厂家:山西云鹏制药有限公司;批准文号:国药准字H34021587),口服,200 mg/ 次,1 次/d ;链霉素(生产厂家:山东鲁抗医药股份有限公司;批准文号:国药准字H37020187),肌内注射,0.5 g/ 次,2 次/d ;吡嗪酰胺(生产厂家:河南省福林制药厂;批准文号:国药准字H41022614),口服,0.75 g/ 次,2 次/d;利福平(生产厂家:沈阳红旗制药有限公司;批准文号:国药准字H21021905),口服,0.45 g/ 次,1 次/d。强化治疗的时间为2 个月。2)巩固期治疗,予以患者异烟肼(同强化期)、利福平(同强化期);乙胺丁醇(生产厂家:成都锦华药业有限责任公司;批准文号:国药准字H51020917),口服,0.75 g/ 次,1 次/d。巩固治疗的时间为3 个月,在此期间视患者的情况调整用药剂量。观察组患者在常规抗结核治疗的基础上加用胸腺肽α1进行治疗。胸腺肽α1(生产厂家:四川源基制药有限公司;批准文号:国药准字H20020544)的用法是:皮下注射,1.6 mg/ 次,每周2 次(间隔3 d),持续治疗5 个月。
1.3 观察指标
比较两组患者的临床疗效。依据WHO 第四版结核病治疗指南[7]制定的疗效判定标准,用显效、有效、无效评估两组患者的临床疗效。显效:治疗后患者的肺结核相关症状基本消失,肺功能明显改善,痰涂片检查结果转阴,经肺部CT 检查显示病灶吸收。有效:治疗后患者的肺结核相关症状明显减轻,肺功能有一定改善,经肺部CT 检查显示病灶部分吸收。无效:治疗后患者的肺结核相关症状未减轻,肺功能无改善,经肺部CT 检查显示病灶未吸收。总有效率=(显效例数+ 有效例数)/ 总例数×100%。治疗前后,比较两组患者的肺功能指标,包括用力肺活量(FVC)、第1 s 用力呼气容积(FEV1)、呼气峰值流速(PEF)。采用麦邦肺功能检测仪MSA99 测定患者的上述肺功能指标。比较两组患者治疗前后血清免疫球蛋白A(IgA)、免疫球蛋白G(IgG)及免疫球蛋白M(IgM)的水平。IgA、IgG、IgM 的检测方法是:采集患者清晨空腹状态下的静脉血4 mL,经离心处理后分离出血清,采用多色流式细胞仪(生产厂家:美国BD ;型号:FACSCelesta)测定血清中IgA、IgG、IgM 的水平。比较两组患者治疗前后T 淋巴细胞亚群的水平。T 淋巴细胞亚群包括CD3+T 淋巴细胞、CD4+T 淋巴细胞、CD8+T 淋巴细胞,其检测方法是:采集患者清晨空腹状态下的静脉血4 mL,经离心处理后分离出血清,采用流式细胞仪测定血清中CD3+T 淋巴细胞、CD4+T淋巴细胞、CD8+T 淋巴细胞的水平。
1.4 统计学方法
用SPSS 24.0 软件处理本研究中的数据,计数资料用%表示,计量资料用均数±标准差(±s)表示,分别用χ²、t检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者临床疗效的比较
观察组患者治疗的总有效率高于对照组患者,差异有统计学意义(P<0.05)。详见表1。
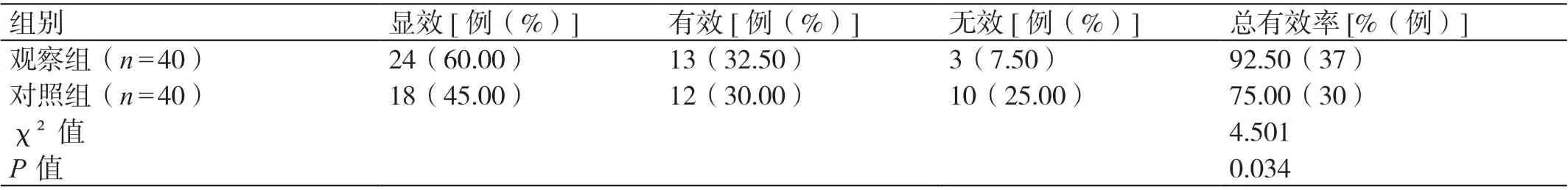
表1 两组患者临床疗效的比较
2.2 两组患者治疗前后肺功能指标的比较
治疗前,两组患者的FVC、FEV1、PEF 相比,差异无统计学意义(P>0.05)。治疗后,两组患者的FVC、FEV1、PEF 均高于治疗前。治疗后,观察组患者的FVC、FEV1、PEF 均高于对照组患者,差异有统计学意义(P<0.05)。详见表2。
表2 两组患者治疗前后肺功能指标的比较(± s)
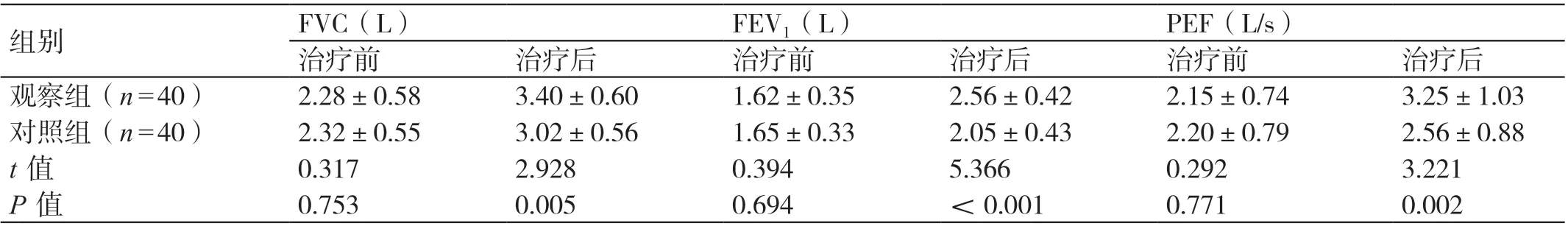
表2 两组患者治疗前后肺功能指标的比较(± s)
组别 FVC(L) FEV1(L) PEF(L/s)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组(n=40) 2.28±0.58 3.40±0.60 1.62±0.35 2.56±0.42 2.15±0.74 3.25±1.03对照组(n=40) 2.32±0.55 3.02±0.56 1.65±0.33 2.05±0.43 2.20±0.79 2.56±0.88 t 值 0.317 2.928 0.394 5.366 0.292 3.221 P 值 0.753 0.005 0.694 <0.001 0.771 0.002
2.3 两组患者治疗前后血清IgA、IgG、IgM 水平的比较
治疗前,两组患者血清IgA、IgG、IgM 的水平相比,差异无统计学意义(P>0.05)。治疗后,两组患者血清IgA、IgG、IgM 的水平均高于治疗前。治疗后,观察组患者血清IgA、IgG、IgM 的水平均高于对照组患者,差异有统计学意义(P<0.05)。详见表3。
表3 两组患者治疗前后血清IgA、IgG、IgM 水平的比较(μg/L,± s)

表3 两组患者治疗前后血清IgA、IgG、IgM 水平的比较(μg/L,± s)
组别 血清IgA 血清IgG 血清IgM治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组(n=40) 1.49±0.12 1.65±0.12 7.39±1.20 15.31±2.05 1.66±0.50 1.95±0.42对照组(n=40) 1.51±0.13 1.55±0.13 7.42±1.18 10.69±1.84 1.71±0.52 1.72±0.40 t 值 0.715 3.575 0.113 10.607 0.438 2.508 P 值 0.477 0.001 0.911 <0.001 0.662 0.014
2.4 两组患者治疗前后T 淋巴细胞亚群水平的比较
治疗前,两组患者血清CD3+T 淋巴细胞、CD4+T淋巴细胞、CD8+T 淋巴细胞的水平相比,差异无统计学意义(P>0.05)。治疗后,两组患者血清CD3+T淋巴细胞、CD4+T 淋巴细胞的水平均高于治疗前,血清CD8+T 淋巴细胞的水平均低于治疗前。治疗后,观察组患者血清CD3+T 淋巴细胞、CD4+T 淋巴细胞的水平均高于对照组患者,血清CD8+T 淋巴细胞的水平低于对照组患者,差异有统计学意义(P<0.05)。详见表4。
表4 两组患者治疗前后T 淋巴细胞亚群水平的比较(%,± s)

表4 两组患者治疗前后T 淋巴细胞亚群水平的比较(%,± s)
+++组别 CD3T 淋巴细胞 CD4T 淋巴细胞 CD8T 淋巴细胞治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组(n=40) 61.38±4.62 66.02±5.82 27.17±4.52 33.46±4.65 34.26±4.15 28.34±3.14对照组(n=40) 60.72±4.58 63.49±4.96 27.24±4.60 29.64±4.85 34.11±4.20 32.06±3.27 t 值 0.642 2.093 0.069 3.596 0.161 5.190 P 值 0.523 0.040 0.946 0.001 0.873 <0.001
3 讨论
结核病患者在发病之初无明显症状,但在潜伏期结束后根据感染部位的不同可出现不同的症状表现。例如,肺结核患者的主要症状是咳嗽、咳痰等,肾结核患者则以尿急、尿痛等为主要症状[8]。但无论哪个部位发生结核分枝杆菌感染,患者均可出现消瘦、虚弱、低热等全身性症状或体征,只有少数患者在感染结核分枝杆菌后无症状。目前临床上对结核病患者主要是进行抗结核治疗,遵循早发现、早治疗的原则,常用的治疗药物有异烟肼、利福平、吡嗪酰胺、乙胺丁醇等。新发结核病患者的治疗周期通常在6 个月左右,但视个体差异可适当延长治疗周期[9]。上述抗结核药物在结核病的治疗中发挥了重要作用,但近年来受到耐药问题的影响,抗结核治疗的疗效越来越差[10]。此外,长期使用抗结核药物还会导致患者的免疫功能失调,可增加其真菌感染的风险。胸腺肽α1是从牛胸腺组织中提取的多肽类激素,其作用是诱导成熟T淋巴细胞的增殖与分化,促进T 淋巴细胞释放多种细胞因子,以达到免疫调节的作用。结核病的发生与患者免疫功能低下有关。用胸腺肽α1对结核病患者进行治疗后,可增加其机体的免疫力,使结核分枝杆菌的载量下降,进而可达到改善其病情的目的。本研究的结果显示,观察组患者治疗的总有效率高于对照组患者,治疗后其FVC、FEV1和PEF 均高于对照组患者,差异有统计学意义(P<0.05)。提示用胸腺肽α1辅助抗结核药物治疗结核病的效果较为理想。分析原因可能是胸腺肽α1能提高结核病患者机体的免疫功能。因此本研究比较了两组患者治疗前后免疫功能的变化,结果显示治疗后观察组患者血清IgA、IgG、IgM、CD3+T 淋巴细胞、CD4+T 淋巴细胞的水平均高于对照组患者,其血清CD8+T 淋巴细胞的水平低于对照组患者,差异有统计学意义(P<0.05)。血清IgA、IgG、IgM水平的增高能反映患者机体免疫功能的增强。CD3+T淋巴细胞、CD4+T 淋巴细胞、CD8+T 淋巴细胞是细胞免疫功能的重要标志物,与体液免疫共同参与结核病的免疫抑制[11]。临床研究表明,当机体CD3+T 淋巴细胞、CD4+T 淋巴细胞的水平升高后,可增强吞噬细胞介导的抗感染作用,选择性抑制结核分枝杆菌[12]。
综上所述,用胸腺肽α1辅助抗结核药物治疗结核病的效果较为理想,能有效改善患者的肺功能,提高其免疫力,缓解其病情。但值得注意的是结核病迁延难愈,而辅助使用胸腺肽α1能否在本病的长期控制中发挥理想的效果,还有待于通过长期随访来确定。因此本研究将继续保持对该批次患者的随访,以明确胸腺肽α1辅助抗结核药物治疗结核病的远期疗效。
