合成纳米材料对神经系统的影响
2022-09-28时晓丽沙蕊彭汉勇温蓓
时晓丽,沙蕊,彭汉勇,温蓓,3,*
1.晋中学院生物科学与技术系,晋中 030619
2.中国科学院生态环境研究中心环境化学和生态毒理学国家重点实验室,北京 100085
3.中国科学院大学,北京 100049
合成纳米材料(ENMs)是指在三维空间中至少有一个维度或内部结构在纳米尺度(1~100 nm)或由它们作为基本单元构成的材料,相当于10~1 000个原子紧密排列在一起的尺度。由于合成纳米材料具有独特的物理化学特性,已被广泛应用于能源、电子、食品、农业、环境科学、化妆品和医药等领域[1]。例如,每年生产3 000 t二氧化钛(TiO2)纳米粒子,其中50%以上用于防晒霜等个人护理产品[2-3]。合成纳米材料也被作为药物或成像探针载体,用于诊断和治疗脑神经失调等多种疾病,如脂质体、树状大分子、金属纳米粒子、碳纳米管和量子点等[1]。
随着合成纳米材料的大量生产和使用,在环境中的含量急剧增加,部分合成纳米材料在粉尘和烟雾中以超细颗粒物的形式长期存在[4],其安全问题引起公众的广泛关注。由于合成纳米材料的体积较小,极易进入并长期停留在机体外周组织中,与活体组织和细胞相互作用,发生构象变化,诱导组织和细胞的功能发生改变[5]。研究发现合成纳米材料可以穿过或绕过血脑屏障(BBB),进入中枢神经系统(CNS),引起血脑屏障和神经递质功能障碍、神经退行性病变及认知学习和记忆功能障碍进而诱发神经毒性[6]。由于神经组织发挥生理功能的条件要求严格,且神经元细胞难以再生的特点,使得神经毒性成为合成纳米材料研究的关注热点和难点问题。
合成纳米材料的神经毒性分子机制仍在探索中,目前已报道的研究工作主要涉及氧化应激诱导细胞凋亡或自噬、免疫反应和炎症等,不同合成纳米材料通过激活特定的信号通路来影响神经细胞的功能。但合成纳米材料神经毒性研究亟需进一步拓展和深入。本文综述了合成纳米材料和靶细胞(特别是神经元和胶质细胞)之间相互作用的分子机制,并对相关领域发展方向作了展望。
1 影响合成纳米材料毒性的因素(Factors influencing toxicity of ENMs)
合成纳米材料由于其材料尺寸在纳米级,产生了不同的光、热、电、磁和力等性质,如吸附、分散、比表面积、表面活性以及催化性能等[7]。合成纳米材料按化学成分可分为碳纳米材料、无机纳米材料、有机纳米材料和杂化纳米材料等[8],其毒性主要取决于化学组成、尺寸、形状、表面性质(电荷、表面涂层等)、浓度和降解性能等参数[9]。以下部分简述了影响合成纳米材料毒性的主要影响因素。
1.1 尺寸和形状
纳米材料的尺寸影响其进入细胞及与机体作用的方式和毒性效应。合成纳米材料(特别是过渡金属及金属氧化物纳米粒子)表面的电子供体或受体与分子氧反应生成超氧自由基或羟基自由基,进而氧化其他生物分子,颗粒尺寸越小活性氧(ROS)的生成量越高。>50 nm合成纳米材料则通过吞噬作用进入细胞,而几纳米到几百纳米的合成纳米材料通过胞饮或大型胞饮作用内化,网格蛋白依赖的胞吞作用可能是细胞摄取<100 nm合成纳米材料的主要机制[10]。Park等[11]发现粒径较小的纳米银颗粒(<71 nm)能够被小肠吸收通过血液循环系统进入脑、肺、肝和肾等器官,而粒径较大的颗粒(323 nm)无法被小肠吸收。合成纳米材料的形状和长径比是影响其毒性的关键因素。合成纳米材料具有球状、平板状、管状、环形和纤维状等多种形状。与纤维状和杆状合成纳米材料相比,球形合成纳米材料更易被细胞胞吞[12]。Chithrani等[13]发现细胞对合成纳米材料的吸收率与形状有关,细胞对球形纳米金(74 nm或14 nm)的吸收率分别比金纳米棒(74 nm×14 nm)的高500%和375%。
1.2 表面性质
合成纳米材料表面电荷影响其与生物大分子(如蛋白质等)的相互作用,从而产生不同的吸收、排出速率和组织分布[7]。通过调节合成纳米材料的表面电荷能够影响细胞对合成纳米材料的吞噬作用。例如,带正电荷的合成纳米材料更容易穿过带负电荷的细胞膜,细胞摄入量更高。与中性合成纳米材料相比,带正电荷的合成纳米材料可迅速从血液中被巨噬细胞清除[14]。与聚对苯乙烯磺酸钠(PSS)或十六烷基三甲基溴化铵(CTAB)修饰的金纳米棒相比,聚二烯丙基二甲基氯化铵(PDDAC)修饰的金纳米棒在MCF-7细胞中摄取量最高[15]。同时,合成纳米材料表面修饰能够降低合成纳米材料团聚,延缓其降解速率并抑制蛋白冠的形成,进而增加其生物利用度。Li等[16]发现组成和大小相同的L-谷胱甘肽或D-谷胱甘肽修饰的DdTe量子点(L/D-GSH-QDs)对细胞毒性存在差异,D-GSH-QDs的毒性低于L-GSH-QDs的。
1.3 金属纳米材料的溶解和金属离子的释放
金属纳米材料在组织和器官内会被溶解,产生的离子影响其细胞毒性。二氧化硅(SiO2)纳米粒子能够进入人脐静脉内皮细胞HUVEC的胞浆和溶酶体,并溶解生成Si离子而排出胞外[17]。氧化铁纳米颗粒(IONPs)在体内代谢产生铁离子,与血红蛋白结合进入红细胞。γ-Fe2O3磁性纳米粒子(MNPs)与间充质干细胞温育1个月,通过透射电镜(TEM)观察发现大部分铁粒子溶解成较小的铁蛋白[18],该蛋白在人体内调节铁含量方面起着重要作用[14]。Qu等[19]通过同步辐射技术(X射线原位微区元素成像)结合化学结构分析技术研究量子点在秀丽线虫体内代谢与溶解过程,发现量子点经饮食摄入的方式进入消化系统,被内皮细胞摄取并定位于溶酶体,且能够从消化系统迁移进入生殖系统,同时量子点芯壳结构破坏释放出有毒镉离子,进一步导致生殖障碍和发育异常。Gliga等[20]发现10 nm柠檬酸盐包被AgNPs处理培养基4 h,其Ag+释放量为10.6%,显著高于10 nm PVP包被AgNPs的Ag+释放量(5.8%)。
2 合成纳米材料进入血脑屏障的摄取机制和转运途径(Uptake mechanism and transport pathways of ENMs in the blood-brain barrier)
血脑屏障(BBB)允许亲脂性分子、O2和CO2的自由扩散和运输,而其他化合物主要通过转运体或受体介导的胞吞作用进入大脑[22]。体内和体外研究均证实合成纳米材料可以经口服或注射的方式通过脑毛细血管内皮细胞上一系列转运体或受体跨过血脑屏障进入大脑,或经呼吸道通过鼻上皮进入嗅球绕过血脑屏障进入中枢神经系统[5,23-24]。通过对怀孕小鼠静脉注射70 nm SiO2和35 nm TiO2纳米粒子,发现合成纳米材料能够穿过怀孕小鼠的胎盘屏障进入子鼠的胎盘、大脑和肝脏[25]。Korzeniowska等[26]采用永生化脑微血管内皮细胞(hCMEC/D3)和原代星形胶质细胞为细胞模型,研究纳米银和纳米铂共同暴露对人脑细胞的影响,纳米银和纳米铂共暴露毒性大于单独暴露纳米银,且能够增强BBB的渗透性。TiO2纳米粒子能够诱导斑马鱼幼鱼和PC12细胞出现帕金森样症状,导致孵化过早并干扰其运动,并能够诱导斑马鱼脑组织中ROS生成,导致下丘脑区域细胞死亡[27]。石墨烯基纳米粒子神经毒性在多种生物模型中均有报道,如人类神经母细胞瘤细胞(SH-SY5Y和SK-N-SH)[28-29]、胶质细胞[30-31]、秀丽隐杆线虫[32]、斑马鱼[33]和小鼠[34]等。
合成纳米材料通过跨细胞转运、细胞旁途径、受体介导的胞吞作用(带有转铁蛋白、胰岛素或载脂蛋白E(Apo E)等配体的合成纳米材料)、吸附介导的胞吞作用(带正电荷的合成纳米材料)和细胞(巨噬细胞)介导的胞吞作用等不同方式跨过血脑屏障(图1),沉积在嗅球、海马、大脑皮层和纹状体等不同的大脑区域[21,35-36]。人工纳米脂粒表面富含Apo E分子能够与血脑屏障上过表达的低密度脂蛋白(LDL)受体之间特异性识别,经网格蛋白介导的胞吞作用将合成纳米材料摄入细胞,通过跨细胞转运途径穿过BBB[37]。Mendonça等[38]采用基质辅助激光解吸电离质谱成像(MALDI-MSI)表征还原氧化石墨烯在大鼠大脑中的时空分布,发现还原氧化石墨烯通过细胞旁途径进入BBB。Liu等[39]通过体外和体内实验研究发现SiO2纳米粒子通过ROS和ROCK/JNK介导的信号通路诱导紧密连接丧失和细胞骨架重排,进而干扰BBB结构和功能。Kafa等[40]采用一种低密度脂蛋白受体相关蛋白-1(LRP1)的配体angiopep-2(ANG),作为一种靶向多壁碳纳米管脑传递配体,能够显著提高多壁碳纳米管的血脑屏障转运。Huang等[41]采用乳铁蛋白(Lf)修饰树枝状阳离子纳米粒子的脑靶向配体,发现受体介导和吸附介导的胞吞作用有助于Lf修饰的纳米粒子跨过BBB。除此之外,巨噬细胞能够吞噬血液中的合成纳米材料,通过血脑屏障释放合成纳米材料进入中枢神经系统[21]。
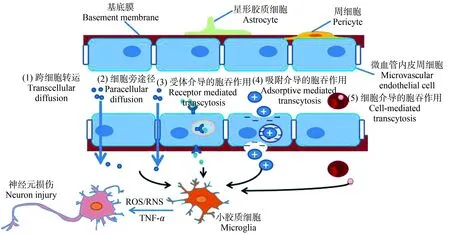
图1 不同物理化学性质的合成纳米材料(ENMs)通过血脑屏障(BBB)的方式[21]注:ROS表示活性氧;RNS表示活性氮。Fig.1 Engineered nanomaterials (ENMs) with specific physicochemical properties could pass through the blood-brain barrier (BBB) by way of several different strategies[21]Note:ROS stands for reactive oxygen species;RNS stands for reactive nitrogen species.
在合成纳米材料内化过程开始前,细胞膜是合成纳米材料与细胞相互作用的第一个接触部位,细胞膜上的脂质和蛋白质可能是其作用靶点。在神经元(和胶质细胞)的神经递质和神经激素受体中,转运体转运和通道转运是调节神经元活动和对外界刺激做出响应的主要方式。合成纳米材料能够通过影响神经元信号通路和其他参与神经信号传递的相关蛋白表达而对细胞造成损伤。离子转运蛋白是细胞内离子稳态的主要调控因子,目前在这方面的有关研究相对缺乏。Fe2O3纳米粒子能够抑制大鼠脑细胞内的Na+-K+泵、Mg2+-ATPase和Ca2+-ATPase的活性[43]。TiO2纳米粒子(5 nm,5~30 μg·mL-1)能够降低大鼠海马神经元细胞的Na+-K+泵和Ca2+-ATPase的活性[44]。ZnO纳米粒子(30 nm,2.5~10 μg·mL-1)也能够降低大鼠视网膜神经节细胞质膜上Ca2+-ATPase的活性[45]。AgNPs通过网格蛋白/胞膜窖依赖的胞吞作用或胞饮作用进入细胞,经囊泡运输进入溶酶体,溶酶体内的酸性环境导致AgNPs释放Ag+[46]。一方面,AgNPs诱导的氧化应激、碱化、渗透性肿胀或超负荷引起溶酶体膜渗透性改变,溶酶体膜完整性或酸度的丧失导致溶酶体功能障碍。AgNPs和Ag+从溶酶体逃逸到胞质中。胞质中的AgNPs和Ag+引起胞内ROS水平增加,从而诱导细胞的应激反应(如:内质网应激、DNA损伤等)和细胞器损伤(线粒体功能障碍)。另一方面,AgNPs还可以引起质膜的脂质过氧化而破坏细胞膜系统的完整性,使其能够直接穿过质膜进入细胞。除此之外,AgNPs与蛋白质巯基相互作用,导致蛋白质发生错误折叠,进而引发内质网应激。在ROS或应激反应和细胞器损伤协同作用下细胞自噬系统被激活。由于AgNPs诱导溶酶体发生损伤,溶酶体功能障碍与自噬体-溶酶体融合受阻密切相关,AgNPs中断溶酶体途径可能严重干扰自噬机制的功能,由于自噬清除途径无法发挥作用可能进一步加剧AgNPs诱导的毒性[47](图2)。
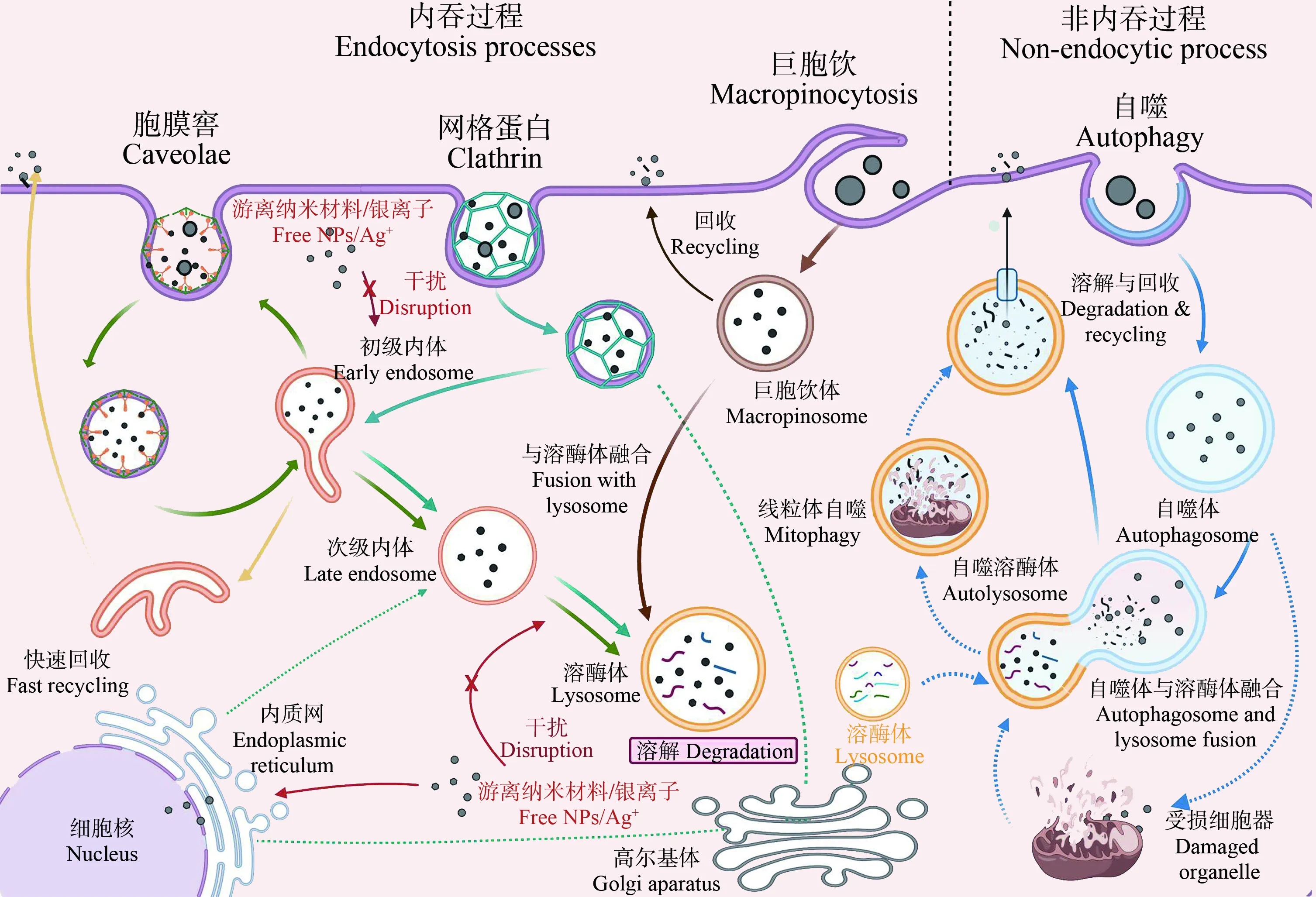
图2 细胞摄取和转运纳米银的途径[42]Fig. 2 Uptake mechanism and transport pathways of silver nanoparticles[42]
3 合成纳米材料诱导神经毒性的分子机制(Molecular mechanisms of neurotoxicity exerted by ENMs)
合成纳米材料诱导神经毒性的主要分子机制包括氧化应激、DNA损伤、炎症反应、自噬和凋亡等(图3)。在多数情况下,合成纳米材料通过多种机制共同产生神经毒性。

图3 合成纳米材料(ENMs)诱导神经毒性的潜在分子机理[6]Fig. 3 Mechanisms of neurotoxicity induced by ENMs[6]
3.1 氧化应激
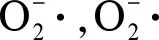

图4 合成纳米材料诱导ROS产生的机制[21]Fig. 4 Mechanisms of ROS production induced by ENMs [21]
氧化应激能够增强血脑屏障的通透性,并诱导BBB产生炎症。Liu等[39]发现SiO2纳米粒子诱导脑微血管内皮细胞(BMECs)产生ROS,ROS通过下调紧密连接蛋白(CLDN5、OCLN等)来增加BBB的通透性,导致微管不稳定而引发炎症反应。Nel等[9]认为ROS的过量产生是导致氧化应激和炎症反应的主要因素,低浓度ROS通过nrf-2转录因子激活细胞抗氧化元件,较高浓度ROS通过激活NF-κB信号通路进而引起炎症反应,更高浓度ROS则启动细胞凋亡程序。此外,合成纳米材料能够诱导小胶质细胞产生ROS,并对周围的神经元造成损伤[21,58]。合成纳米材料能够激活小胶质细胞和NLRP3炎性小体而触发炎症反应,该反应是由ROS和NF-κB信号通路激活介导的[6]。
合成纳米材料通过胞饮和网格蛋白介导的胞吞作用进入细胞,经胞吞-溶酶体途径转移到溶酶体,诱导线粒体ROS的产生从而导致溶酶体破裂,激活NLR家族的NLRP3炎性小体,调节促炎细胞因子的释放(如IL-1β)[58-61]。30 nm TiO2纳米粒子(5 μmol·L-1)能够进入溶酶体等亚细胞结构,诱导活性氧的产生和促炎细胞因子IL-1β的表达发生改变[62]。45 nm氧化铁纳米粒子(3 mmol·L-1)能够在小胶质细胞的溶酶体中大量积累,对小胶质细胞的毒性远高于对神经元和星形胶质细胞的毒性[63]。合成纳米材料能够激活小胶质细胞,使小胶质细胞的形态由分枝状转变为圆形巨噬细胞样并产生促炎细胞因子,如白细胞介素、肿瘤坏死因子蛋白家族和炎症趋化因子等[21],还能激活小胶质细胞细胞膜上的Toll样受体(Toll-like receptors,TLR),如TLR2、TLR4,活化的TLRs进一步激活NF-κB信号通路导致炎症因子的释放[64]。与此同时,合成纳米材料也可以通过抑制MAPK磷酸酶活性而激活ERK1/2导致炎症细胞因子的释放。
3.2 DNA损伤
合成纳米材料诱导DNA损伤的方式有2种,一种是合成纳米材料进入细胞核直接作用于DNA或DNA相关蛋白,另一种是由ROS和炎症引起的DNA损伤[21]。El-Ghor等[65]发现TiO2纳米粒子能够诱导小鼠大脑发生DNA损伤。AgNPs能够下调参与DNA损伤反应/修复系统基因的表达水平(XRCC1、XRCC13、FEN1、RAD51C和RPA1等)[66]。AgNPs(100 nm)通过PAK、MAPK和PPP2A途径间接诱导DNA损伤和细胞凋亡[67]。CdTe量子点(QDs)通过提高小胶质细胞BV-2胞内镉(Cd)离子浓度诱导ROS的生成而间接导致DNA损伤[68]。ZnO纳米粒子能够诱导SH-SY5Y细胞DNA氧化损伤和H2AX磷酸化,即DNA双链断裂[69]。DNA损伤导致细胞周期阻滞,为DNA修复系统提供充足的时间,而低效的DNA修复能够进一步诱导细胞凋亡。Valdiglesias等[70]发现TiO2纳米粒子能够诱导SH-SY5Y细胞产生微核和DNA双链断裂,进而诱导细胞凋亡。
3.3 细胞死亡
合成纳米材料诱导神经细胞死亡的途径包括3个方面。(1)依赖于caspase的凋亡:死亡受体途径、线粒体途径和内质网应激途径。(2)坏死:在TNFα作用下,RIP3通过与RIP1形成坏死复合体,介导caspase非依赖性细胞坏死。(3)自噬:通过PI3K-Akt-mTOR通路负反馈调节机制进行调控[21]。
合成纳米材料诱导神经胶质细胞凋亡涉及多条信号通路。MAPKs是丝氨酸/苏氨酸激酶家族,包括JNK(c-Jun氨基末端激酶)、ERK(胞外调节蛋白激酶)、p38 MAPK,参与细胞的发育、增殖、分化和凋亡。ZnO纳米粒子通过JNK信号通路和线粒体内源性凋亡途径来诱导原代星形胶质细胞的凋亡[71],也能够诱导小神经胶质细胞的ERK发生磷酸化,释放细胞色素c到细胞质,激活caspase-9(内源性凋亡通路的生物标志物),还能够诱导p38 MAPK的磷酸化,激活caspase-8和caspase-3,进而导致PARP的裂解[31]。TiO2纳米粒子能够诱导C6和U373小胶质细胞ROS生成量增加,进而诱发炎症和细胞凋亡[51]。Zhang等[72]研究发现AgNPs诱导的细胞凋亡过程中内质网应激起着重要的调节作用,产生了内质网应激标志物的变化,如PERK、eIF2α、IRE1的磷酸化、XBP-1的剪接、ATF6(内质网应激传感器)的裂解、Grp-78和CHOP/GADD153蛋白表达水平的上调。其中,ATF6在AgNPs诱导细胞焦亡过程中起到至关重要的作用[73]。由多种合成纳米材料(如聚苯乙烯纳米粒子、TiO2纳米粒子、Al2O3纳米粒子和Fe3O4纳米粒子)诱导的内质网应激可以介导自噬激活。PERK依赖的内质网应激途径可能是自噬和凋亡的交互作用机制的基础[47]。坏死是一种非依赖于caspase的细胞死亡途径。氧化铝纳米粒子能够诱导ICR小鼠海马细胞坏死和凋亡,其中坏死是导致ICR小鼠神经行为缺陷的直接原因[74]。Sun等[75]发现Ag+对大鼠脑星形胶质细胞的毒性显著高于AgNPs,Ag+损坏细胞膜的完整性进而诱导细胞坏死,而AgNPs通过增强caspase的活性从而诱导细胞凋亡。合成纳米材料诱导的神经细胞坏死及其作用机制有待更深入的研究。
自噬是一种合成纳米材料的潜在毒性作用机制[76],但有关合成纳米材料与神经毒性关系的研究报道非常有限。纳米金能够增加人胚肺成纤维细胞(MRC-5)中自噬相关蛋白的表达水平,同时生成过量的丙二醛(MDA)[77]。SiO2纳米粒子通过抑制自噬特异性蛋白的磷酸化和PI3K-Akt-mTOR信号通路来促进PC12细胞自噬[54]。ZnO纳米粒子能够诱导PINK1/parkin介导的选择性线粒体自噬过程,parkin蛋白从细胞质转运到线粒体以及PINK1蛋白表达水平的下调,从而导致线粒体自噬的发生[29],而线粒体功能障碍与多种神经退行性疾病有关[6]。AgNPs能够诱导阻断自噬通量,引发自噬小体积累,从而在细胞和机体水平上加剧AgNPs诱导的稳态失衡[47]。氧化铁纳米粒子和TiO2纳米粒子诱导人大脑内皮细胞(HCECs)发生自噬,同时产生氧化应激和DNA断裂[78]。
3.4 DNA甲基化
阿尔兹海默症、亨丁顿舞蹈症和肌萎缩性脊髓侧索硬化症等神经退行性疾病均受到DNA甲基化的调控。神经胶质瘤细胞中兴奋性氨基酸转运蛋白(EAAT2)启动子的超甲基化导致星形胶质细胞EAAT2的表达缺失,通过抑制DNA甲基转移酶活性能够恢复EAAT2的转录。精神疾病与大脑中异常的DNA甲基化状态有关[76]。合成纳米材料引起DNA甲基化水平异常已有相关研究报道。SiO2纳米粒子能够降低人永生化角质形成细胞HaCaT的整体DNA甲基化水平,并改变PARP-1启动子的甲基化状态[79-80]。AgNPs和氧化石墨烯在A549和293T细胞中通过改变DNMT酶和TET(ten-eleven translocation)蛋白的浓度导致DNA整体甲基化水平的改变。TET蛋白可以催化5-甲基胞嘧啶(5-mC)转化为5-羟甲基胞嘧啶(5-hmC),是DNA去甲基化过程中的一种重要的酶。DNA的甲基化和去甲基化过程均易受合成纳米材料暴露的影响[81]。然而,DNA甲基化在合成纳米材料诱导的神经毒性中的作用有待进一步研究。
4 总结与展望(Conclusion and perspectives)
合成纳米材料穿过或绕过血脑屏障进入中枢神经系统的过程,受到合成纳米材料的化学组成、尺寸、表面性质(电荷、表面涂层等)、形状、浓度和降解性等性质的影响。通过对多种不同类型的合成纳米材料的神经毒性研究,揭示了一系列潜在的分子机制,包括氧化应激、遗传毒性、炎症反应、自噬和细胞凋亡、对细胞组分的直接损伤、DNA甲基化等。不同的毒性机制往往会协同产生,例如,氧化应激会引发炎症、DNA损伤和细胞凋亡等,DNA损伤也能够导致细胞凋亡。目前,合成纳米材料神经毒性的评价主要针对无机纳米材料,如金属及金属氧化物纳米材料、碳基纳米材料,而有机纳米材料的研究尚未开展,如高分子纳米粒子和脂质体。在合成纳米材料毒理研究中已发现的多种分子机制如细胞自噬、坏死以及DNA甲基化等,需要更多的研究证据。此外,合成纳米材料在跨越BBB过程中,与生物分子作用形成蛋白冠,改变了合成纳米材料的理化性质,影响其转运途径和产生毒性的机制,其表面蛋白冠组成对神经毒性的影响亟需系统深入的研究。
