磷酸三丁酯的生物毒性效应研究进展
2022-09-28张金凤逯南南侯书国孙韶华贾瑞宝武道吉
张金凤,逯南南,侯书国,孙韶华,贾瑞宝,*,武道吉,#
1.山东省城市供排水水质监测中心,济南 250100
2.山东建筑大学,济南 250101
有机磷酸酯(organophosphorus esters,OPEs)是一类含有有机基团的磷酸衍生物,分为卤代磷酸酯、芳基磷酸酯和烷基磷酸酯三大类,因取代基不同而导致物理化学性质差异很大[1]。OPEs生产工艺简单、价格低廉,在杀虫剂、除草剂、消泡剂和增塑剂等方面应用广泛。因其卓越的阻燃性能,OPEs被添加到塑料、家具、包装、电子设备和建筑材料中,成为一类重要的有机磷阻燃剂(organophosphate flame retardants,OPFRs)[2]。随着多溴联苯醚等传统溴代阻燃剂被限制使用并逐步淘汰,OPFRs成为其替代品,然而OPFRs并非完全安全[3]。OPFRs主要以物理方式进行添加,容易通过产品挥发、磨损或泄露释放到周围环境中[4]。OPFRs对生态系统和人类健康具有潜在不利影响,其生态风险已引起世界各国的广泛关注[5]。已有研究表明,OPFRs对多种生物产生毒性,如神经毒性、生殖发育毒性和致畸致癌毒性等,这些研究主要集中在氯代OPFRs和芳基OPFRs[6-8]。
磷酸三丁酯(tributyl phosphate,TBP)是一种无色、无臭的液体,包括磷酸三正丁酯(TnBP)和磷酸三异丁酯(TiBP)2种异构体,其主要性质如表1所示。TBP脂溶性高,易与有机质结合,热稳定性高,阻燃效果好,是一种应用比较广泛的烷基OPFR[2]。在工业上常用作包装材料增塑剂、水泥砂浆消泡剂及金属离子萃取剂等[9-11],也是液压油、润滑油、传动液和机油的重要组成成分[12]。研究发现,TBP广泛存在于多种环境介质中,并具有长距离传输性[13],在土壤[14-15]、沉积物[16-17]、饮用水[18]、地下水[16,19]、河流湖泊[20]甚至在人迹稀少的高原冰川积雪[21]和北极海水[13]中被检出。TBP容易挥发进入大气,许多大气细颗粒物PM2.5样本中检出TnBP和TiBP[22-23],检出率甚至在90%以上,2种异构体存在相同的来源、性质和排放途径[24]。TBP通过吸入、饮食摄入或皮肤接触等途径进入生物体,进行迁移和富集,进而危害生态系统[25-26]。
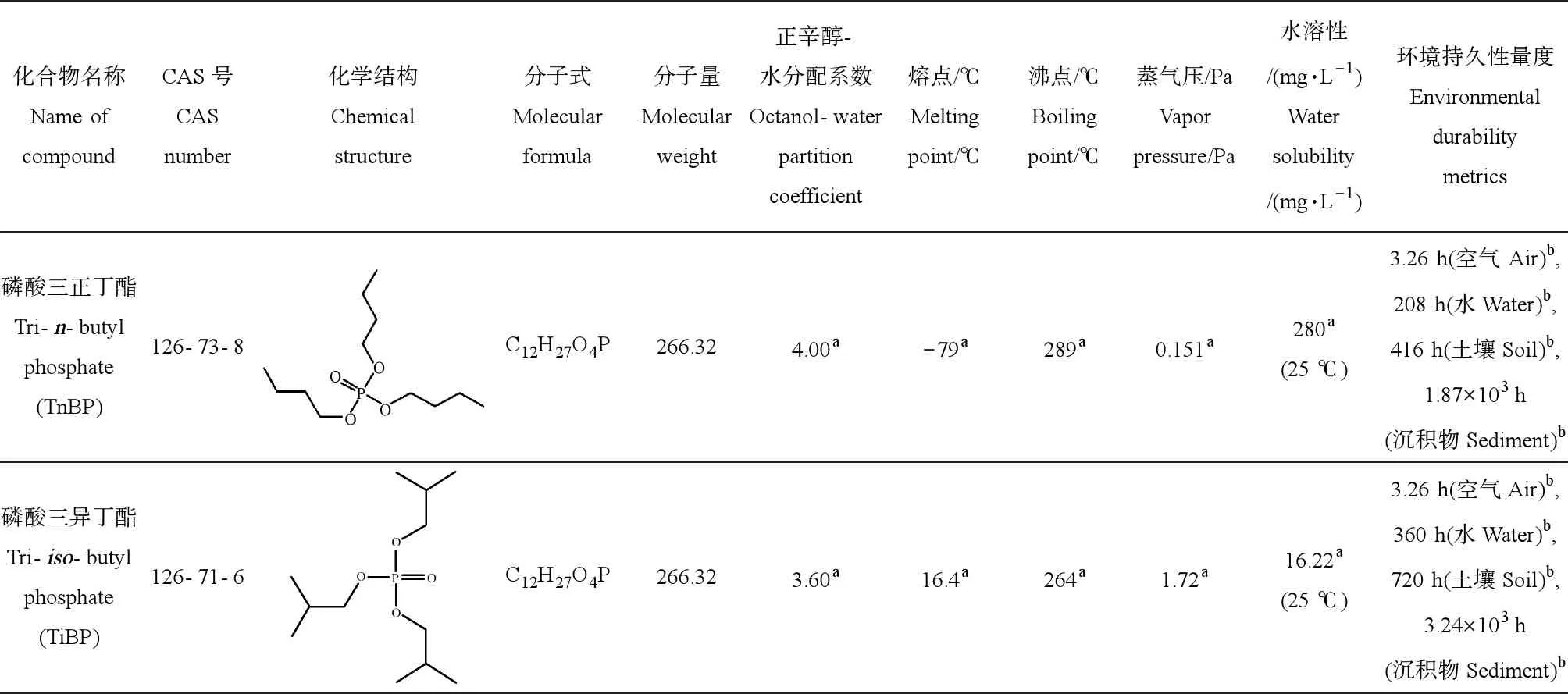
表1 磷酸三丁酯(TBP)的性质Table 1 Properties of tributyl phosphate (TBP)
作为一种烷基OPE,TBP的生物毒性及潜在的生态风险逐渐成为人们关注的焦点。本文总结了TBP的生物富集、毒性效应和作用机制,提出了当前该领域中存在的问题和建议,同时展望了生物毒性评价的发展趋势,为全面评估其生态风险提供依据。
1 TBP在生物体内的蓄积与代谢(Accumulation and metabolism of TBP in organisms)
TBP可在生物体内发生蓄积和代谢,在生物体内的含量与其物理化学性质、当地污染水平和生物富集能力密切相关[27]。生物富集因子(bioconcentration factor,BCF)和生物-沉积物富集因子(biota-sediment accumulation factor,BSAF)用来表示有机化合物在生物体内富集作用的大小,是评估生物累积性的重要指标。
1.1 TBP在植物体内的蓄积
TBP通过污水、污泥或大气沉降进入农田,被植物吸收,并在植物体内蓄积[28]。陈阳等[21]对四川省海螺沟景区的9种植物进行了检测,发现TnBP的检出率为100%。与其他植物相比,虎耳草、七筋姑和水竹叶中TnBP的含量较高,最高检出量(162.4 ng·g-1)出现在水竹叶中。重庆地区的蔬菜样品中同样检出了TnBP和TiBP,检出范围分别为2.66~39.9 ng·g-1和1.18~9.55 ng·g-1[29]。研究表明,不同植物对TBP的富集能力不同,胡萝卜根部BCF为0.37~4.6,大麦根部BCF为1.18~1.39,牛尾草叶片和胡萝卜叶片部位的BCF均<1.2,而3种植物的种子均未检出TBP,因此TBP易进入植物的可食部位[28,30]。在水稻稻田的环境介质(包括大气、降尘、雨水、灌溉水、水稻土和林地土)及稻米中均检出了TnBP和TiBP,检出率为75%~100%,2种异构体在稻米中的检出浓度均值分别为0.08 ng·g-1(TnBP)和0.17 ng·g-1(TiBP)。随着植株的生长,水稻根系不断从水体中吸收TnBP和TiBP,导致其含量升高,生物积累能力逐渐增强[31]。
1.2 TBP在动物体内的蓄积
TBP可在多种动物体内蓄积,在环境介质中的浓度影响其在生物体内的浓度水平[32]。在重庆地区多种动物的肌肉中检出TnBP和TiBP,占总OPEs浓度的66.9%,是主要的OPEs污染单体,与室外空气和水体中两者的污染水平密切相关[29]。在我国珠江入海口鱼体肌肉中测得TnBP的最高含量为2 946 ng·g-1(以脂质量计)[33],高于菲律宾马尼拉湾海鱼样品中TnBP的最高检出量(590 ng·g-1,以脂质量计)[34],这与当地水域TnBP的污染情况相吻合。
在不同生物体内TBP的含量与分布都具有差异。TnBP通过皮肤接触进入蚯蚓体内,在肠道和脑神经节中积累,并随着暴露浓度的升高含量逐渐增多[35]。Liu等[36]研究了TnBP在黑斑蛙和牛蛙体内的分布情况,发现肝脏中TnBP的含量高于肾脏、小肠和心脏,这种差异与性别有关,而牛蛙的肺中未检出TnBP。He等[29]发现鱼体肌肉中TnBP的平均浓度(487 ng·g-1,以脂质量计)高于鸡、猪和牛,而TiBP在牛肌肉中的浓度最高(135 ng·g-1,以脂质量计)。TnBP在斑马鱼的卵、脑和肝脏等器官中积累,浓度与组织中的脂肪含量显著相关(r2=0.94,P<0.01)[37]。日本沼虾、鲫鱼、鲮鱼、胡鲶和黑鱼体内TnBP的检出率为100%,在胡鲶、鲮鱼和鲫鱼中TnBP约占总OPFRs浓度的50%~66%,浓度与鱼体肌肉中的脂肪含量也呈明显的相关性(r2=0.79,P<0.01),BCF和BSAF分别为20~228和0.066~0.162[27,38]。对稀有鮈鲫来说,卵巢对TnBP的摄取速度比其他器官快,富集程度高,BCF为23.74~27.73[39]。我国北京多条河流中的淡水鱼(麦穗鱼、鲫鱼和泥鳅)体内TnBP的浓度为64.4~449 ng·g-1(以脂质量计),其中肝脏中的含量最高,其次为肌肉、肠道、肾脏和卵巢,BCF平均为173[38]。邓旭[32]发现鲶鱼肌肉中TnBP的含量(31.9 ng·g-1,以湿质量计)高于草鱼(23.1 ng·g-1)和鲫鱼(23.9 ng·g-1),而鲶鱼肝脏中TnBP的含量(584.1 ng·g-1)高于腮(329.7 ng·g-1)和肾脏(268.3 ng·g-1)。在我国成都锦江河鱼体中TnBP和TiBP主要富集在肌肉、鳃和内脏中,含量依次降低[16]。在韩国洛东江的鲫鱼中全部检出了TnBP,其中肝脏中的含量最高(2.02~3.53 ng·g-1),在肌肉、肝脏和性腺中BCF介于为5.99×104~1.40×105之间,BSAF介于20.5~48.7之间[40]。而Liu等[27]研究结果与之不同,鲫鱼对TBP的BCF和BSAF分别为120和0.151。在鸟类和哺乳动物中也发现类似的分布规律。在我国广东电子垃圾拆解区鸡鸭等家禽的肌肉样品中检出了TnBP,含量为11.7~281 ng·g-1(以脂质量计)[33]。Li等[41]对澳大利亚多个地区收集的鸡蛋进行了分析,发现在蛋黄和蛋清中TBP的检出率分别为46%和59%。在北美银鸥的蛋黄中TnBP的检出率约为25%,蛋清中则未检出[42]。陈敏等[43]发现TnBP在小鼠器官中的含量依次为肾脏>脾脏>肺>心脏>肝脏。
动物的发育阶段、体型和体质量对TBP蓄积能力的影响不同。Sundkvist等[44]发现大型鲈鱼体内TnBP的含量明显高于小型鲈鱼。鲫鱼肌肉中TnBP的含量随着鱼体的生长而增加(P<0.05),当雌鱼生长到最大体型后TnBP的浓度反而发生下降,说明随着雌鱼生殖系统的成熟TnBP逐渐从肌肉迁移至性腺[40]。另有研究表明,三峡库区多种鱼类的肌肉中TnBP与TiBP的平均含量分别为(336±227) ng·g-1(以脂质量计)和(81.8±87.8) ng·g-1(以脂质量计),与鱼体大小、体质量和脂肪含量并无显著相关性(P>0.05)[45]。
TBP的生物富集平衡时间与生物以及组织类型有关。在斑马鱼暴露试验中,前3 d TnBP在鱼体内的浓度快速升高,4~12 d持续增加,第14天左右达到稳定状态[37]。TnBP在稀有鮈鲫体内的变化规律与之类似,前4 d TnBP的浓度逐渐增高,低浓度组(10 μg·L-1)于第8天浓度达到最高后趋于稳定,高浓度组(100 μg·L-1)于第15天浓度达到平衡状态[39]。当锦鲤暴露于TnBP(100 μg·L-1和500 μg·L-1)时,肌肉中TnBP的浓度于第3天达到最高,分别为(5.2±0.5) ng·g-1(以湿质量计)和(35.5±1.2) ng·g-1(以湿质量计),随后稍有降低,直至第14天趋于稳定,分别为5.4 ng·g-1(以湿质量计)和33.3 ng·g-1(以湿质量计);而腮和肾脏中TnBP的浓度在第5天达到最大,第14天趋于稳定[32]。陈敏等[43]发现TnBP-d27在小鼠心脏、肝脏与肺的富集浓度最高时间点为12 h,而肾脏与脾脏的富集浓度最高点分别为24 h和36 h。
TBP暴露浓度不同导致生物体内BCF产生差异。蚯蚓暴露于低剂量TBP(10 mg·kg-1)时BCF为0.062~0.204,而在高剂量组(50 mg·kg-1)中BCF为0.018~0.090[46]。在低浓度(35 μg·L-1)和高浓度(191 μg·L-1)TnBP处理条件下,斑马鱼各个组织的BCFlw平均值分别介于305.5~507.5和221.2~395.0之间[37]。锦鲤对不同浓度TnBP的富集能力不同,低浓度(100 μg·L-1)时BCF为31±10,高浓度(500 μg·L-1)时BCF为28±8[32]。
1.3 TBP在人体内的蓄积
血清、尿液、乳汁、羊水或胎盘等样品可用于检测TBP及其代谢产物磷酸二丁酯(DBP),以反映TBP在人体中的蓄积水平[47-50]。我国国内多个地区的人血清样本中检出了TnBP,检出率和浓度存在差异[47,51-52]。渤海湾地区居民的血清中TnBP和TiBP的检出率分别为11.2%和25.8%,最高值分别为184 ng·g-1和59.4 ng·g-1(以脂质量计),并且男性血清中TiBP浓度高于女性[53]。多项研究表明,人尿液中检出DBP的浓度中位数介于0.11~3.5 ng·mL-1之间[54-56]。张晓华等[48]发现我国多地人群尿液中DnBP的检出率为66%,中位数为0.84 ng·mL-1,其中深圳人群尿液中DnBP约占总OPFRs浓度的42%。青少年人群(12~15岁)尿液中DBP的检出率超过99%,中位数为1.49 ng·mg-1[26]。挪威儿童尿液中DnBP检出率约为15%[57],低于德国儿童尿液中DBP的检出率(71%)[58]。生活在电子垃圾拆解地区的孕妇尿液和羊水样本中TnBP检出率为93%,DBP的浓度比本地区普通成年人高3倍~5倍[59],约13%孕妇每日摄入量超过了TnBP参考剂量(2 400 ng·kg-1·d-1)[49]。在人体胎盘中TnBP的检出率为46%,浓度为ND~100 ng·g-1(以脂质量计),其中在电子垃圾拆解区母亲胎盘中TnBP浓度偏高[26,50]。在胚胎绒毛膜绒毛样品中TBP的含量(18.8 ng·g-1) (以干质量计)高于孕妇蜕膜样本(10.8 ng·g-1) (以干质量计)[60]。在瑞典多个地区的母乳样品中TnBP的平均含量为12 ng·g-1(以脂质量计)[44],高于来自日本、菲律宾和越南的母乳样品(分别为0.39、1.5和2.0 ng·g-1)[61]。澳大利亚0~5岁儿童的尿液中全部检出了DBP,其浓度随年龄增长而下降,但未检出TBP,儿童对应的母乳中TBP含量为0.26~2.1 ng·mL-1,表明婴幼儿体内高浓度的DBP主要来源于母乳喂养[62]。
1.4 TBP在生物体内的代谢转化
污染物进入生物体后发生代谢或降解,生成相应的代谢产物[63]。研究发现,无光照条件下TBP在pH 7~11的水溶液中持续35 d不会发生降解[64]。在蚯蚓-土壤生态系统中,蚯蚓能够显著加快TBP的降解,主要由蚯蚓的肠道微生物和土壤中的微生物来完成[65]。肝脏是TnBP发生代谢的主要部位,发生氧化(羟基化)、脱烷基、磷酸化、羧酸化以及与硫酸酯结合等反应,生成极性、亲水的代谢物,Ⅰ相代谢产物主要有羟基化TBP(TBP-OH,有2种异构体)、脱烷基的二酯产物DBP和羧酸化TBP,Ⅱ相代谢产物主要有乙醇-DBP、硫酸化的乙醇-DBP、磷酸化的TBP-OH(有2种异构体)[46]。另外DBP继续脱烷基形成磷酸单丁酯(MBP)[66],葡萄糖醛酸转移酶可催化TBP-OH与葡萄糖醛酸结合[37]。研究发现,在长时间暴露情况下TBP更易发生羟基化和磷酸化,而不是发生水解和羧酸化[46]。这些代谢物通过肝胆系统释放到肠道,导致肠道中代谢物的浓度高于肝脏,最终经泌尿系统排出体外[67]。在鲫鱼[68]、银鸥[69]和大鼠[66]等肝脏微粒体以及大鼠肝癌细胞H4ⅡE[70]中TBP被迅速代谢。TBP的代谢速度与物种有关,在人体、鱼类和鸟类中代谢速度呈递减趋势[42,68-69]。在不同生物中TBP向代谢产物的转化率不同。在斑马鱼体内TnBP向DnBP的代谢转化率为3.4%[67],在麦穗鱼、鲫鱼和泥鳅等鱼体内TnBP向DnBP的转化率约为30%[38]。鲫鱼肝脏微粒体中TBP-OH比DBP产生速度更快,TBP向两者的转化率分别为43.1%和12.9%[68]。在银鸥肝脏微粒体中约14%的TBP转化为DBP[69]。Sasaki等[71]发现大鼠肝脏微粒体中的双功能氧化酶(MFO)将TBP氧化为TBP-OH,进而生成TBP-(OH)2和DBP。细胞色素P450同工酶CYP3A4和CYP1A1也参与TBP的氧化过程[68,70]。此外,一种沼泽红假单胞菌的重组膜结合蛋白CYP201A2能够催化TBP降解过程的初始步骤[72]。
基于1H-NMR的代谢组学分析,DBP和N-乙酰-(S-3-羟丁基)-L-半胱氨酸是区分TBP是否染毒的重要生物标志物,TBP-OH、内源性2-酮戊二酸、苯甲酸盐、延胡索酸、葫芦巴碱和顺式乌头酸也可作为生物标志物进行检测,以反映生物体的负荷及主要暴露途径[73-75]。
由此可见,TBP可在多种生物体内蓄积,其组织分布、含量和富集规律不尽相同[32]。通过对不同生物的研究发现,BCF介于0.018~1.40×105之间,说明生物种类对TBP的富集程度不同(表2)。这种差异主要与以下因素有关。(1)TBP较高的亲脂性使其在血液与组织中进行分配,进而影响生物富集能力[37]。有学者认为TBP通过被动运输和主动累积进行富集,其中主动累积是决定TBP分布的主要方式[39,42]。(2)不同器官的脂肪与蛋白质含量不同,TBP趋向富集于脂肪含量高的组织如肝脏、脑和卵[27,32]。(3)生物发育阶段、体质量和体型对TBP生物富集与放大效应的影响并不一致[40,44-45],可能的原因是动物体内存在代谢途径,改变了随动物生长而产生的富集与放大效应[45]。(4)摄食习性会影响生物富集能力。食肉性为主的鱼类(如鲶鱼)比以植物为主的杂食性鱼类(如草鱼)摄取更多TnBP,表现为随营养级升高而增高的趋势[27,45],TiBP则表现出相反的趋势[45]。Liu等[27]发现淡水食物网中TnBP的营养放大因子(TMF)仅为0.57,表明发生了营养稀释。在荷兰西斯凯尔特河口的水层食物网和总食物网(底栖和水层)中同样发现TBP的营养稀释效应[76]。TBP在不同食物链(网)的生物放大效应需要进一步探讨。(5)代谢和排泄能够影响TBP的富集程度。在稀有鮈鲫[39]、锦鲤[32]、斑马鱼[37]、虹鳟鱼[77]和金鱼[77]等鱼体内TnBP的代谢半衰期分别为0.6~2.0 d、1.4 h、4.8~6.2 h、58 h和100 h,说明在体内停留时间较短,有利于排出。当代谢速度大于富集速度时,TBP浓度降低,富集能力逐渐减弱,这也是导致TBP在水生食物链(网)中没有出现明显生物放大效应的原因之一[27,44]。(6)环境介质中污染物的浓度和暴露途径对生物富集效果也有一定的影响[78]。

表2 不同生物对磷酸三丁酯的生物富集效应Table 2 Bioaccumulation effect of various organisms for tributyl phosphate
2 TBP的生物毒性(Biological toxicity of TBP)
OPFRs对生物体具有毒性效应,主要表现为急性毒性、生殖与发育毒性、器官毒性、神经毒性以及致畸致癌致突变等方面[79]。在毒性研究中,通常用半数致死浓度或剂量(LC50/LD50)、半数抑制浓度(IC50)、半数效应浓度或剂量(EC50/ED50)和未观察到损伤的作用浓度或剂量(NOEC/NOEL)等指标来表征污染物毒性作用的强弱。
2.1 急性毒性
许多研究利用不同的受试对象来检测TBP的急性毒性效应。姜丹等[80]以青海弧菌Q67发光菌为受试生物,结合微孔板高通量检测技术,得到TBP的EC50为109 μmol·L-1。大肠杆菌暴露于TBP 90 min后菌体数量下降明显,经计算IC20为205.6 μmol·L-1[81]。TBP(50 μg·L-1)染毒48 h导致蛋白核小球藻细胞壁严重变形,群体数量明显减少,抑制率约17.9%[82]。TBP(≥0.2 mg·L-1)显著抑制三角褐指藻生长,TBP浓度越高其抑制作用越强[83],所得EC50值与Song等[84]的结果不同,可能是三角褐指藻的接种密度和培养条件不同所致。TnBP(1 mg·L-1和6 mg·L-1)能够干扰褶皱臂尾轮虫群体的生长,24 h急性毒性的LC50为12.45 mg·L-1[85]。大型溞暴露于TBP 48 h死亡率随浓度升高而增大,EC50为12 mg·L-1(或45 μmol·L-1)[86]。利用滤纸片接触法进行蚯蚓的急性暴露试验,测得TBP对掘穴环爪蚓和赤子爱胜蚓的LD50(48 h)分别为3.3 μg·cm-2和20.232 μg·cm-2[46,87]。杜仲坤[8]以斑马鱼胚胎和成体为受试动物研究TBP的急性毒性作用,以卵凝结和心跳作为致死性指标,得到胚胎和成体的LC50分别为7.815 mg·L-1和7.152 mg·L-1(96 h)。SD大鼠通过灌胃方式进行急性暴露试验,在高剂量组(1 000 mg·kg-1TBP)中雄性大鼠的平均体质量较对照组出现明显下降[88]。体外实验结果表明,TBP能够抑制大鼠肝癌细胞株H4ⅡE和大鼠肾上腺嗜铬细胞瘤PC12细胞的生长,细胞存活率下降,IC50分别为177.6 μmol·L-1(48 h)[70]和338.09 μmol·L-1(24 h)[89]。TBP(200 μmol·L-1)染毒24 h人肺癌细胞A549和结肠腺癌细胞Caco-2的存活率分别下降14.2%和21.1%[90]。此外TBP还能抑制人肝癌细胞HepG2的增殖,IC50为299 μmol·L-1(48 h)[91]。美国政府工业卫生专家协会(ACGIH)将TBP列为中度毒性物质,对人体的致死量为0.5~5 g·kg-1(以体质量计)[92]。
2.2 生殖与发育毒性
污染物发挥生殖与发育的毒性作用主要表现为个体发育迟缓或发育不足,生殖器官或细胞的形态和功能异常[63]。研究发现,TnBP(6 mg·L-1)对褶皱臂尾轮虫的生殖系统表现出一定的毒性[85]。斑马鱼胚胎暴露于不同浓度的TBP(25、125、625和3 125 μg·L-1)5 d,胚胎发育基本不受影响,胚胎孵化率、孵化时间、畸形率、体长和心率等没有发生明显变化[93]。TBP(3 125 μg·L-1,14 d)可导致青鳉鱼胚胎孵化率显著降低,孵化时间延长,畸形率升高,心率下降[93]。Müller等[94]对小鼠2-细胞期胚胎的发育情况进行了研究,发现5 μmol·L-1TBP染毒18 h对胚胎无明显毒性,细胞增殖也未受到影响。当浓度增大到15~40 μmol·L-1时,约50%~90%植入胚胎的发育和细胞增殖受到不同程度的影响,但TBP并未诱导胚胎细胞出现微核。2代CD大鼠通过自由饮食方式染毒TBP(200、700和3 000 mg·kg-1),生殖器官、怀孕和泌乳均未受到明显影响[95]。Wistar大鼠在妊娠7~17 d后进行TBP(800 mg·kg-1·d-1)染毒,所有怀孕大鼠死亡[96]。TBP(0.14 mL·kg-1·d-1和0.42 mL·kg-1·d-1)连续灌胃14 d导致SD大鼠的曲细精管出现退行性病变,出现不同程度的精子生成缺乏症状,少数精管内可见巨细胞及核固缩的细胞[97]。由此可见,TBP对多种动物的生殖系统与胚胎发育具有潜在的危害。
2.3 器官毒性
TBP通过不同途径进入生物体后,经过血液运输进入组织器官,产生一定的器官毒性,如肝脏毒性、肾脏毒性和肠毒性等[87,98-99]。在人工土壤中蚯蚓暴露于环境相关或更高浓度的TnBP(0.1、1和10 mg·kg-1)14 d后,体质量增加,致死率<5%[35]。TnBP进入蚯蚓的消化道,严重影响肠道的结构和功能,破坏小肠上皮细胞的紧密连接和渗透平衡,抑制蛋白酶体的活性,纤维素酶活性明显升高,精氨酸含量下降,干扰肠道对营养的吸收[35],消化道出现明显的剂量反应性降解,肠壁变细,肠腔扩张,肠道微生物菌群发生改变,易发生炎症[87]。在亚慢性毒性(325 mg·kg-1·d-1灌胃3个月)暴露试验中,SD大鼠的体质量增长率明显下降,并出现个体死亡[88]。TBP(0.42 mL·kg-1·d-1)导致SD大鼠肝脏系数变大,其他器官如脑、心脏、肾脏和肺等脏器系数无明显变化,血液指标和生化指标的变化与性别有关,雌性大鼠中平均红细胞血红蛋白量与浓度均下降,甘油三酯和淀粉酶升高,而雄性大鼠中血液指标未发生明显变化,胆固醇、淀粉酶、胆红素、血尿素氮和尿素含量升高[97]。Wistar雄性大鼠饮食摄入TBP 9~10周,脑、肝脏和肾脏等脏器系数变大,肝脏出现损伤,低剂量组(质量分数为0.5%的TBP)大鼠血液指标未发生变化,高剂量组(质量分数为1%的TBP)大鼠血液中总蛋白、胆固醇和尿素氮含量升高,凝血时间延长,谷草转氨酶、谷丙转氨酶和碱性磷酸酶含量下降,血清和肝脏中的胆碱酯酶活性无明显变化,而大脑中胆碱酯酶活性升高[98,100]。采用气管滴注方式进行TBP染毒28 d,Wistar大鼠支气管肺泡灌洗液中总蛋白量和总细胞数明显增高,引起肺部损伤[101]。经长时间(24个月)喂养,SD大鼠的尿路和膀胱上皮组织出现明显的再生性增生,局部组织出现炎症、溃疡和坏死[99,102],膀胱增生的发生率和严重程度与TBP剂量密切相关[95]。另有研究表明,CD-1小鼠长期摄入TBP(18个月),生存率、血液和尿液等参数均未发生显著变化,体质量增长率下降,肝脏肿大[103]。因此对于啮齿类动物而言,TBP对肝脏、肺和肾脏等器官造成明显的损伤。
2.4 神经毒性
由于TBP与有机磷农药的结构类似,其神经毒性效应受到许多研究者的关注。胆碱酯酶和神经病靶酯酶(NTE)的变化以及神经功能的改变用来表征污染物的神经毒性效应[104]。乙酰胆碱酯酶(AChE)的活性与基因表达变化趋势之间的差异与AChE的补偿机制有关[105]。研究发现,TBP抑制AChE和丁酰胆碱酯酶(BuChE)的活性,从而表现出一定的神经毒性[106]。TnBP导致蚯蚓脑神经节中Ca2+-ATPase和Na+/K+-ATPase活性下降,Ca2+和Na+浓度升高,干扰渗透压平衡,加快兴奋性神经递质谷氨酸的传递,对神经造成损伤[65,87]。斑马鱼幼鱼和青鳉鱼幼鱼暴露于TBP(3 125 μg·L-1)时,自由游泳速度明显变慢,在光周期刺激实验中移动速度降低,说明TBP能够影响运动神经功能[93]。斑马鱼中与神经发育相关的多个基因表达下降,AChE活性未发生显著变化[107],而青鳉鱼中AChE活性明显升高[93]。亚致死剂量的TBP(1 500 mg·kg-1)导致母鸡血浆中BuChE活性升高2倍~3倍,而NTE和AChE的活性没有发生变化,TBP未损伤神经功能[108]。采用一次性肌肉注射法染毒TBP(1 000 mg·kg-1)后6 d左右母鸡腰髓前角神经元数量减少,出现肌无力和共济失调等进行性神经疾病的典型症状[109]。体外细胞实验结果显示,TnBP通过抑制大鼠PC12细胞中AChE的活性来影响神经元的分化[89]。SD大鼠暴露于TBP后唾液分泌增加,刺激反应时间延长,活动能力和前肢握力均下降[88]。Laham等[110]发现TBP(0.42 mL·kg-1·d-1,14 d)影响SD雄性大鼠的外周神经系统,尾神经传导速度降低,并伴有坐骨神经形态学改变,无髓纤维中的施万细胞突起收缩,但未发现神经细胞轴突变性。
2.5 致畸、致癌及致突变性
在已有的研究中,TBP对不同生物表现的致畸、致癌和致突变效应不同。TnBP对非洲爪蟾胚胎具有潜在的致畸作用[111]。蚯蚓在慢性暴露(TnBP 10 mg·kg-1和50 mg·kg-1,28 d)试验中没有出现任何身体变形或畸形[46]。孕期Wistar大鼠通过口服进行TBP染毒,与对照组相比死胎数量和仔鼠体质量均无显著差异,畸形发生率没有明显升高,因此Noda等[96]认为TBP对大鼠未表现出明显的致畸作用。
SD大鼠饮食摄入TBP(700 mg·kg-1和3 000 mg·kg-1),膀胱出现乳头状或结节状肿瘤,具有明显的剂量依赖性,在遗传基因毒性试验中结果为阴性,表明肿瘤由非遗传毒性机制诱发[75]。Arnold等[102]发现SD大鼠尿路上皮组织出现肿瘤,并且雄性比雌性更易发生。CD-1小鼠体内出现了肝脏肿瘤[103]。因此,1998年ACGIH将TBP列为动物致癌物[112]。
2.6 其他毒性
除上述毒性效应外,TBP对特定环境中的高暴露人群具有一定的健康风险。在生产或使用TBP的环境中工人出现恶心、头痛及呼吸道刺激等症状[92],约5.56%的工人出现烦躁、精神不振和嗜睡等不适症,而常规体检结果如内科、皮肤、五官、血常规、尿常规、肺通气和胸部透视等与对照组相比没有显著差异[113]。另有研究发现,TBP与过敏性鼻炎和哮喘等疾病的流行呈显著相关性[114]。
3 TBP的毒性作用机制(Toxic mechanisms of TBP)
体内外实验结果已证实,TBP通过诱导氧化应激、干扰细胞代谢、干扰内分泌以及诱导细胞死亡等机制发挥其毒性作用[84,115-116]。
3.1 诱导氧化应激
污染物进入生物体后,细胞激活应激反应,抗氧化酶和热休克蛋白(Hsp)可作为环境污染与生物预防的早期预警信号[117-118]。TBP导致多种生物(如藻类[82-83]、轮虫[85]、河蚬[115]、蚯蚓[87]、斑马鱼[119]和大鼠[101]等)体内产生活性氧(ROS),诱导氧化应激,抗氧化酶和应激蛋白出现不同程度的变化。Krivoshiev等[81]对大肠杆菌(E.coliSF1和GC4436菌株)的应激基因谱进行分析,发现TBP(300 μmol·L-1)诱导多种应激蛋白如过氧化氢酶(CAT)-过氧化物酶Ⅰ(由KatG基因编码)、葡萄糖-6-磷酸脱氢酶(G6PDH,由zwf基因编码)和分子伴侣ClpB等基因表达上调,这种变化与TnBP的浓度呈正比。在蛋白核小球藻和三角褐指藻中超氧化物歧化酶(SOD)和丙二醛(MDA)水平升高[82-83]。褶皱臂尾轮虫细胞中MDA和谷胱甘肽还原酶(GR)的活性升高,线粒体的形态与功能出现异常[85]。河蚬暴露于TBP(20 μg·L-1和200 μg·L-1)28 d,消化腺中CAT、SOD和MDA水平下降,Hsp40、Hsp60和Hsp70的mRNA水平降低,同时多异源抗性系统abcc1和abcb1基因表达发生改变来阻止异源物质进入体内[115]。Wistar大鼠肺组织匀浆中SOD、CAT、谷胱甘肽过氧化物酶(GPx)和GR的活性明显降低,而MDA水平升高[101]。体外细胞的实验结果表明,在大鼠肝癌细胞株H4ⅡE中参与氧化还原反应和生物代谢的酶如gpx1、gr、cat、谷胱甘肽-S-转移酶A2(gsta2)和细胞色素cyp1a1的基因表达上调,GPx、谷胱甘肽巯基转移酶(GST)、乙氧基-异吩唑酮脱乙基酶(EROD)和甲氧基-异吩唑酮脱甲基酶(MROD)的活性显著增强[70]。TBP还会导致HepG2和A549细胞产生过量ROS,氧化还原平衡发生紊乱[90-91]。
3.2 干扰细胞代谢
细胞内产生的氧化应激导致物质代谢和能量代谢受到干扰,影响脂质、核苷酸以及RNA的代谢过程[85]。TBP导致蛋白核小球藻细胞壁严重变形,抑制叶绿素合成和光合作用效率,类囊体片层结构松散甚至消失。分子对接(molecular docking)技术表明TBP能够与脂质运载蛋白相结合,因此Chu等[82]认为TBP对微藻的毒性与脂质运载蛋白有关。三角褐指藻光合效率下降,与糖酵解、脂肪酸的生物合成及β氧化相关的基因表达发生变化[84]。Zhang等[85]通过代谢组学分析,发现褶皱臂尾轮虫暴露于TnBP(6 mg·L-1)时有583个代谢物出现差异,其中398个代谢物升高,主要涉及氨基酸生物合成、核苷酸降解、氨酰-tRNA生物合成和脂质代谢等过程。TBP干扰斑马鱼肝脏细胞的正常代谢,使能量代谢受阻,乙酸、胆碱、谷氨酸、谷氨酰胺、琥珀酸以及乙酰肉碱含量显著降低[8]。锦鲤肝脏中乙氧基香豆素-O-脱乙基酶(ECOD)活性升高,羧酸酯酶(CESE)活性降低,而AChE、GST和磷酸三酯酶(PTE)没有发生明显的变化[37]。TBP改变小鼠血浆和肝脏中的内源性代谢产物,影响不饱和脂肪酸的生物合成、精氨酸和脯氨酸的代谢以及腺苷三磷酸结合盒转运蛋白(ABC转运蛋白)等代谢通路,短时间暴露还能破坏小鼠肝脏细胞的尿素循环,抑制细胞色素CYP3A11和CYP2B10的活性[120]。大鼠尿液中的代谢物(包括苯甲酸盐、尿素和葫芦巴碱等)以及三羧酸循环的代谢物(包括柠檬酸、顺式乌头酸、反式乌头酸、2-酮戊二酸、琥珀酸和延胡索酸等)同样受到TBP的影响[73]。此外TnBP还能破坏人体血液中鞘脂的稳态[51]。
3.3 干扰内分泌
作为内分泌干扰物,TBP具有多种核受体的活性,影响内分泌激素的平衡,在多个研究报道中得到了证实[111,116]。TBP具有明显的雌激素活性,与17-β雌二醇共同存在时表现出雌激素拮抗活性[121]。荧光素酶报告基因实验表明,TBP对孕烷X受体(PXR)具有激动活性,而对雄激素受体(AR)、糖皮质激素受体(GR)以及甲状腺受体β(TRβ)具有拮抗活性。在甲状腺激素T3存在时TBP显著降低大鼠垂体瘤GH3细胞的存活率,说明TBP具有T3拮抗作用[111,116]。TBP短期暴露能够激活组成型雄甾烷受体(CAR)[111]。然而,DBP对AR、ER、GR或PXR等核受体没有表现出激动或拮抗活性,可能是DBP的疏水性比TBP低所致[111,122]。目前TBP作为内分泌干扰物的研究主要采用体外细胞实验方法,为了系统全面地研究TBP对内分泌系统的影响,还需要开展体内实验进行验证。
3.4 诱导细胞死亡
机体内的氧化应激会导致DNA损伤,细胞周期发生停滞,促进凋亡因子的释放,最终造成机体死亡[123]。TBP染毒诱导三角褐指藻细胞变形,线粒体膜电位发生变化,最终导致细胞凋亡,1.2 mg·L-1TBP诱导的凋亡率约为(56.48±1.3)%[83]。随着TBP浓度的升高,河蚬消化腺细胞中DNA发生损伤,caspase-3/8/9的活性和细胞色素c水平随之升高,TBP通过线粒体和非线粒体途径诱导细胞凋亡[123]。在斑马鱼肝脏细胞中,与细胞周期、DNA修复及细胞凋亡相关的多个基因表达发生变化,DNA断裂,但是雌雄鱼体对TBP毒性响应的趋势有所不同,具有性别差异[119]。TBP染毒21 d后,鸡的脊髓前角神经元细胞发生凋亡,神经元数量下降[109]。TBP导致大鼠PC12细胞形态改变,细胞核凝集,乳酸脱氢酶(LDH)和caspase-3活性升高,细胞发生坏死性死亡[89]。TBP(50、100和200 μmol·L-1)抑制HepG2细胞增殖,改变线粒体膜的通透性,DNA断裂,细胞周期停滞在G0/G1期,通过c-Jun N末端激酶(JNK)和胞外调节蛋白激酶(ERK1/2)信号激活线粒体和p53介导的细胞凋亡通路[91]。在A549细胞和Caco-2细胞中也得到类似的结果,DNA损伤,LDH活性升高,最终导致细胞死亡[90]。
总之,TBP主要通过以上4种作用机制来发挥其毒性作用。当暴露于污染物时,细胞会发生氧化应激来适应环境的变化。适度的ROS可以作为信号分子来调节各种信号通路,而过量的ROS会造成氧化损伤,改变细胞代谢进而诱导细胞死亡。细胞针对氧化应激发生的反应和后果取决于污染物暴露的条件以及细胞类型[124]。
Verbruggen等[125]对1975—1999年期间发表的有关TBP急性或慢性暴露的研究成果进行了总结,涉及细菌、藻类、原虫、扁形虫、甲壳类和鱼类等多种生物,并根据已有数据推算了TBP的效应浓度(包括NOEC、EC10、EC50和EC100等)以及在淡水和海水环境中TBP的最大允许浓度(MPC)和严重生态风险浓度(SRCeco)。我们着重对2000年以来有关TBP的生物毒性及作用机制的研究成果进行了汇总(表3)。

表3 磷酸三丁酯对不同生物的毒性效应指标及作用机制(2000年以来)Table 3 Toxic effect index and mechanisms of tributyl phosphate on organisms (since 2000)

续表3生物/细胞种类Organisms/Cell types毒理效应指标Toxic effect index毒性作用机制Toxic mechanisms参考文献References河蚬C. fluminea-消化腺细胞中SOD和GR活性以及MDA含量下降,产生氧化应激,细胞色素cyp4基因表达升高,谷胱甘肽-S-转移酶gsts1和gstm1基因表达下降,多个热休克蛋白(Hsp)和多异源抗性系统的基因表达发生变化,DNA断裂,caspase-3/8/9活性和细胞色素c水平升高,诱导凋亡Decreases of SOD, GR activities and MDA content in the digestive gland cells, oxidative stress, upregulation of cytochrome cyp4 expression, down-regulation of glutathione-S-transferase gsts1 and gstm1, mRNAs of several heat shock proteins (Hsp) and multixenobiotic resistance system change, DNA breakage, caspase-3/8/9 activity and cytochrome c increase, and cell apoptosis[115,123]斑马鱼D. rerioLC50: 7.815 mg·L-1 (96 h) (胚胎embryo), 7.152 mg·L-1(96 h) (成体adult) ED50: 17.7 mg·L-1(96 h) (胚胎embryo)幼鱼的自由游泳和移动速度变慢,乙酰胆碱酯酶(ache)基因表达下降但其活性未改变,神经发育相关的基因如神经生长相关蛋白43(gap43)、微管蛋白α1(α1-tubulin)、音猬因子(shha)、突触核蛋白(syn2a)和胶质纤维酸性蛋白(gfap)基因表达下降,神经元表达RNA结合蛋白elavl3基因表达升高,肝脏细胞能量代谢下降,sod和cat的mRNA水平下降,细胞周期检查点激酶(chk2)表达升高,起始识别复合物亚基1(orc1)、周期蛋白A1(ccna1)和周期蛋白B(ccnb)表达下降,caspase-3/9表达下降,DNA修复相关基因表达也发生变化,造成DNA损伤The free-swimming speed and locomotor behavior of larval zebrafish de-crease, acetylcholinesterase (ache) expression decrease but its activity not change, downregulation of genes involved in neural development, such as growth associated protein-43 (gap43), α1-tubulin, sonic hedgehog (shha), synuclein2a (syn2a) and glial fibrillary acidic protein (gfap), upregulation of neuron-enriched RNA-binding protein elavl3 expression, lower hepatic en-ergy metabolism, upregulation of cell cycle checkpoint kinase (chk2) ex-pression, downregulation of sod, cat, origin recognition complex subunit 1 (orc1), cyclin A1 (ccna1), cyclin B (ccnb) and caspase-3/9 expression, the genes related to DNA repair change, and DNA damage[8,93,107,119]青鳉鱼O. latipesLC50: 14.2~18 mg·L-1(48 h), 9.6~17 mg·L-1(96 h)胚胎孵化率降低,孵化时间延长,畸形率升高,影响幼鱼自由游泳的行为,AChE活性升高Embryo hatching rate decrease, hatching time delay, gross abnormalities in-crease, the free-swimming behavior disruption, and AChE activity increase[93,125]锦鲤C. carpio-乙氧基香豆素-O-脱乙基酶(ECOD)活性升高,羧酸酯酶(CESE)活性降低Ethoxycoumarin-O-deethylase (ECOD) activity increase and carboxylester-ase (CESE) activity decrease[37]鸡G. gallusLD50: 1 500 mg·kg-1丁酰胆碱酯酶(BuChE)活性升高,腰髓前角神经元发生凋亡,数量下降,出现肌无力和共济失调等症状Butyryl cholinesterase (BuChE) activity increase, apoptosis of neurons in the anterior horn of spinal cord, cell viability reduction, and neurological symptoms such as myasthenia and ataxia[108-109]

续表3生物/细胞种类Organisms/Cell types毒理效应指标Toxic effect index毒性作用机制Toxic mechanisms参考文献References小鼠M. musculusNOEL: 28.9 mg·kg-1·d-1(雌性female), 24.1 mg·kg-1·d-1 (雄性male)(18个月 18 months)ED50: 15~34 μmol·L-1 (胚胎embryo);ED90: 41~107 μmol·L-1(胚胎embryo)影响小鼠胚胎的增殖和形态发育,慢性染毒导致小鼠肝脏肿大,出现肝脏肿瘤,改变血浆和肝脏中内源性代谢产物,抑制尿素合成,影响不饱和脂肪酸的生物合成、精氨酸和脯氨酸的代谢以及腺苷三磷酸结合盒转运蛋白(ABC转运蛋白)等代谢通路,激活组成型雄甾烷受体(CAR),细胞色素cyp2b10的基因表达上调,CYP2B10和CYP3A11的活性被抑制Cell proliferation and morphological development of embryos disruption, hepatomegaly and hepatocellular adenomas after chronic exposure, endoge-nous metabolites in plasma and liver change, urea synthesis inhibition, sev-eral metabolic pathways disruption such as unsaturated fatty acids biosyn-thesis, arginine and proline metabolism and adenosine triphosphate binding cassette transporters (ABC transporters), activation of constructive andro-stane receptor (CAR), upregulation of cytochrome cyp2b10 expression, and inhibition of CYP2B10 and CYP3A11 enzymatic activity[94,103,120]大鼠R. norvegicusNOEL: 12 mg·kg-1·d-1 (雌性female), 9 mg·kg-1·d-1(雄性male) (24个月 24 months)干扰三羧酸循环,肺组织中SOD、CAT、谷胱甘肽过氧化物酶(GPx)和GR活性下降,MDA水平升高,诱发氧化应激,大脑中胆碱酯酶(ChE)活性升高,尾神经传导速度下降,肝小叶肥大,肺部和肝脏受损,膀胱上皮和肾盂上皮出现增生、坏死和溃疡,出现膀胱乳头状或结节状瘤,曲细精管出现退行性病变,影响精子形成 Disruption of tricarboxylic acid cycle, decreases of SOD, CAT, glutathione peroxidase (GPx) and GR activities, MDA content increase, oxidative stress, cholinesterase (ChE) activity in the brain increase, the conduction velocity of caudal nerve reduction, hepatic centrilobular hypertrophy, lung and liver injury, hyperplasia, necrosis and ulceration in urinary bladder epithelial and renal pelvic epithelial cells, papillary or nodular tumor of bladder, degenera-tive lesions of seminiferous tubules, and spermatogenesis disruption[73,75,88,95,97-102,110]大鼠肝癌细胞株H4ⅡERat hepatoma cell line H4ⅡEIC50: 177.6 μmol·L-1(48 h)细胞存活率下降,诱导氧化应激,gpx1、gr、谷胱甘肽-S-转移酶α2 (gstα2)、细胞色素cyp1a1和cat等基因表达上调,GPx、GST、乙氧基-异吩唑酮脱乙基酶(EROD)和甲氧基-异吩唑酮脱甲基酶(MROD)等活性增强Cell viability reduction, oxidative stress, upregulation of gpx1, gr, glutathi-one-S-transferase alpha 2 (gstα2), cytochrome cyp1a1 and cat expression, and increases of GPx, GST, ethoxyresorufin-O-deethylase (EROD) and methoxyresorufin-O-demethylase (MROD)[70]大鼠肾上腺嗜铬细胞瘤PC12Rat adrenal pheochromocytoma cell line PC12IC50: 338.09 μmol·L-1(24 h)细胞存活率下降,细胞严重变形,细胞核凝集,AChE活性下降,乳酸脱氢酶(LDH)和caspase-3活性升高,细胞发生坏死性死亡Cell viability reduction, cell malformation, nuclear shrinkage, AChE activity decrease, lactate dehydrogenase (LDH) and caspase-3 activity increase, and necrotic death[89]

续表3生物/细胞种类Organisms/Cell types毒理效应指标Toxic effect index毒性作用机制Toxic mechanisms参考文献References人肝癌细胞系HepG2Human hepatoma cell line HepG2IC50: 299 μmol·L-1 (48 h)细胞存活率下降,抑制细胞增殖,细胞周期停滞在G0/G1期,ROS过量产生,诱导氧化应激,DNA损伤,线粒体膜电位降低,通过c-Jun N末端激酶(JNK)和细胞外信号调节蛋白激酶(ERK1/2)信号通路诱导凋亡Cell viability reduction, cell proliferation inhibition, cell cycle arrest in G0/G1 phase, ROS overproduction, oxidative stress, DNA damage, MMP de-crease, and cell apoptosis through c-Jun N-terminal kinase (JNK) and ex-tracellular signal-regulated kinases (ERK1/2) signaling pathways[90-91]人肺癌细胞系A549Human lung carcinoma cell line A549-细胞存活率下降,ROS水平和LDH活性均升高Cell viability reduction, ROS and LDH activity increase[90]人结肠腺癌细胞系Caco-2Human colorectal adenocarcinoma cell line Caco-2-细胞存活率下降,LDH活性升高,DNA损伤Cell viability reduction, LDH activity increase, and DNA damage[90]
4 结论与展望(Summary and prospect)
TBP的大量生产和使用导致其在环境介质中分布广泛,其潜在的负面生态效应与健康风险备受人们关注[25]。目前,关于TBP在生物体内的富集、生物毒性效应和分子机制的研究已有许多报道,本文对此进行了总结。
在国内外许多地区的植物、动物和人体中TBP检出的浓度具有很大差异,一方面反映了TBP污染具有广泛性和地域差异性的特点,另一方面反映出TBP对整个生态系统具有潜在的危害性。不同食物链(网)中TBP的生物富集和放大效应不同,这与生物种类、生理指标和环境条件密切相关。此方面的研究尚不完善,应加强对典型污染区域和各种类型食物链(网)中TBP的生物富集效应及其影响因素的研究,对于准确评价TBP的生态环境风险、TBP的环境容量及制定环境标志提供科学依据。TBP在生物体中能够进行代谢,DBP和TBP-OH被认为是用于TBP监测的重要生物标志物。对各类组织样本特别是人体样本检测时不能仅仅测定DBP,应将TBP-OH或其他典型代谢物共同纳入监测,同时不应忽视这些代谢物的生物活性及潜在的毒性效应。
植物作为生物圈的生产者,对维系生物圈的稳定起着极其重要的作用。目前,TBP的毒性研究主要集中在动物和人体,而对植物的毒性及对食物链影响的研究十分缺乏。大多数研究使用的TBP剂量远远高于实际环境暴露量,这样获得的毒性数据用来进行风险评价存在一定的局限性,亟需开展环境浓度的暴露以及长期低剂量暴露的相关研究,使实验数据更加符合实际情况。此外,自然界中各种污染物非单独存在,TBP与其他共存污染物可能产生的联合毒性需要多加关注。
在生物毒性实验中,抗氧化酶体系和Hsp等应激蛋白是反映TBP生物毒性的早期预警指标,这些指标易受个体差异的影响,应挖掘更多灵敏、准确、易监测的预警参数。已有学者利用转录组学[8]和代谢组学[85]技术进行聚类分析和显著性富集分析,对生物体中差异表达的信息进行预测与验证。目前互作网络分析的关注点主要集中在蛋白质-蛋白质、蛋白质-基因以及代谢途径之间的关系上,而对于TBP与生物分子之间的相互作用[82]以及其他生物分子如非编码RNA对其生物毒性作用的调节机制[126]等方面的认识非常有限,迫切需要深入研究,为今后全面了解TBP的毒性和生态风险评估提供理论依据和数据支持。
