富马酸氯马斯汀减轻小鼠肠缺血/再灌注损伤
2022-09-28录亚鹏钟海莲刘婕婷王迎斌
刘 洋,录亚鹏,郝 伟,钟海莲,刘婕婷,王迎斌
(兰州大学第二医院 麻醉科, 兰州大学 第二临床医学院,甘肃 兰州 730030)
肠缺血/再灌注(ischemia-reperfusion,I/R)损伤又称再灌注损伤是临床常见的病理生理过程。由此引起的临床疾病称为再灌注综合征。肠I/R诱发的局部和全身炎性反应可造成多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),病死率达30%~90%[1]。据报道,肠组织内NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎性小体活化半胱氨酸蛋白酶-1(caspase-1)并伴有大量促炎性因子释放诱发的促炎性程序性细胞死亡方式,在肠I/R的病理生理过程中起着关键作用[1]。抑制NLRP3炎性小体的激活可抑制I/R引起的肠道炎性反应,减轻肠损伤[2]。因此NLRP3炎性小体可能是肠I/R损伤的有效治疗靶点。
富马酸氯马斯汀(clemastine fumarate,CLE),是组胺1受体(histamine 1 receptor,H1R)拮抗剂,主要参与机体变态反应。有报道CLE能抑制炎性反应,减轻器官缺血再灌注损伤[3-4],但其对肠I/R损伤过程中的机制尚不清楚。本研究拟观察CLE是否影响小鼠肠I/R损伤及其可能的作用机制。
1 材料与方法
1.1 实验动物及试剂
1.1.1 动物:SPF级Balb/c小鼠24只,体质量18~25 g,雄性(中国农业科学院兰州兽医研究所实验动物中心)。
1.1.2 试剂:CLE(上海蓝木化工有限公司);TNF-α、IL-18及IL-1β ELISA试剂盒(上海优选生物科技有限公司);NLRP3抗体(Abcam公司);Caspase-1抗体和消皮素D(gasdermin D,GSDMD)抗体(武汉三鹰生物技术有限公司);RIPA裂解液(北京索莱宝科技有限公司);蛋白酶抑制剂(上海碧云天生物技术有限公司);ECL发光液(Millipore公司)。
1.2 实验方法
1.2.1 动物的分组及处理:小鼠随机分为假手术组(sham组)、I/R组和CLE组,每组8只。CLE组术前1 h腹腔注射CLE 5 mg/kg。建立肠系膜上动脉分支夹闭模型(缺血40 min,再灌注2 h)[5]。Sham组小鼠行相同手术但不做夹闭处理。异氟醚麻醉,眼眶静脉采血。过量麻醉致死收集盲肠上5 cm 缺血/再灌注肠组织。
1.2.2 肠组织病理检测:小肠组织石蜡包埋切片,HE染色。光镜下观察肠黏膜病理变化。采用Chiu’s评分:正常为0分;绒毛顶端上皮下间隙增宽为1分;绒毛顶端上皮下间隙进一步扩大,绒毛尖端上皮抬高与固有膜剥离为2分;绒毛上皮成块脱落为3分;上皮完全脱落,仅有固有膜为4分;固有膜层崩裂,出现出血与溃疡为5分。
1.2.3 ELISA检测血清炎性因子:眼眶静脉取静脉血样800~1 000 μL,室温静置1h,离心,分离血清。按ELISA试剂盒说明检测和计算血清TNF-α、IL-1β及IL-18水平。
1.2.4 Western blot检测NLRP3、caspase-1及GSDMD蛋白表达:按照常规方法检测并分析肠组织NLRP3、caspase-1及GSDMD蛋白的表达。
1.3 统计学分析
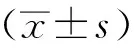
2 结果
2.1 肠黏膜病理改变
Sham组肠黏膜完整,绒毛直立排列整齐;I/R组绒毛顶部结构大片缺失,绒毛失去基本结构,大量炎性细胞浸润,红细胞淤积;CLE组绒毛结构基本存在,但绒毛出现倒伏,Gruenhagen’s间隙扩大,小部分绒毛顶端有缺失,伴较多炎性细胞浸润。与sham组相比,I/R组和CLE组Chiu’s评分明显升高(P<0.05);与I/R组相比,CLE组Chiu’s评分显著降低(P<0.05)(表1,图1)。

表1 各组小鼠肠黏膜病理Chiu’s评分结果
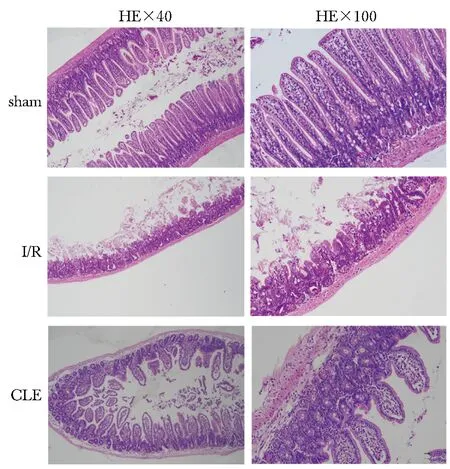
图1 各组小鼠肠组织HE染色Fig 1 Intestinal tissues of mice in various groups by HE (×40,×100)
2.2 血清TNF-α、IL-1β及IL-18含量
与sham组相比,I/R组及CLE组血清TNF-α、IL-18及IL-1β明显升高 (P<0.05); 与I/R组相比,CLE组血清TNF-α、IL-18及IL-1β显著降低(P<0.05)(表2)。
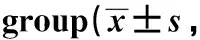
表2 各组小鼠血清TNF-α、IL-1β及IL-18含量
2.3 肠组织NLRP3、caspase-1及GSDMD蛋白表达水平
与sham组相比,I/R组缺血再灌注肠组织NLRP3、caspase-1及GSDMD蛋白表达量明显上升(P<0.05); 与I/R组比较, CLE组缺血再灌注肠组织NLRP3、caspase-1及GSDMD蛋白表达量显著降低(P<0.05)(图2)。
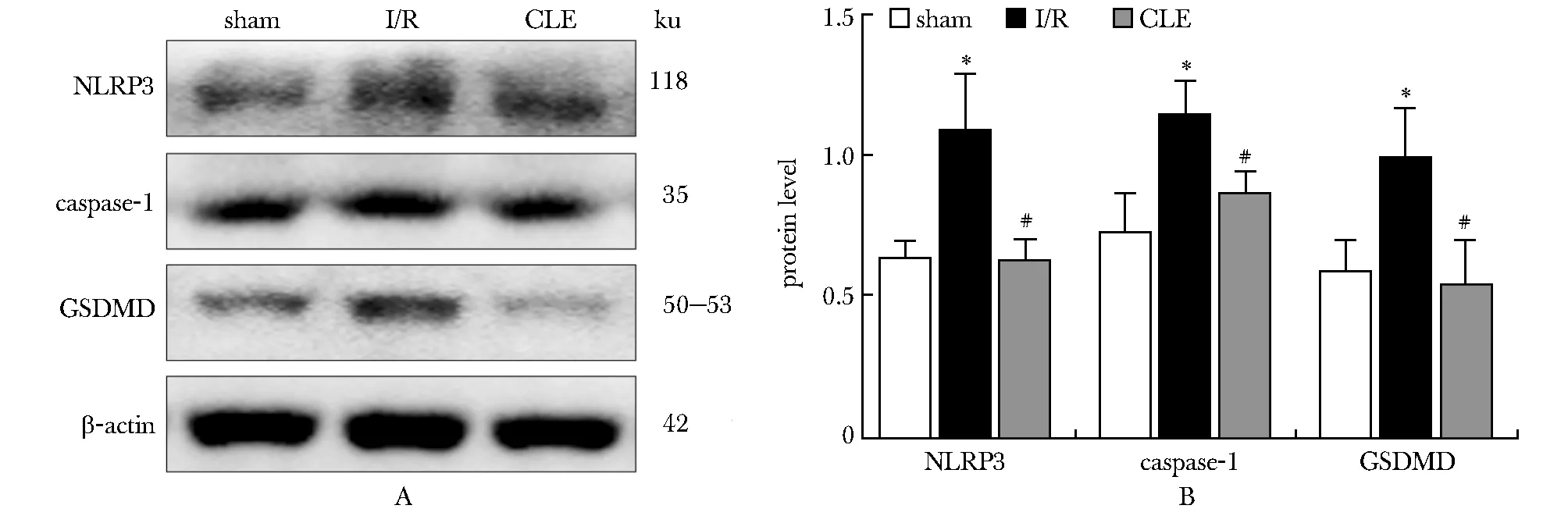
A.expression of NLRP3, caspase-1 and GSDMD proteins by Western blot; B.bar graph of NLRP3, caspase-1 and GSDMD proteins expression;*P<0.05 compared with sham group; #P<0.05 compared with I/R group
3 讨论
H1R在小肠黏膜中广泛分布,其激活可加速氧自由基的生成,诱导中性粒细胞聚集,介导炎性反应加重肠组织损伤[6]。H1R拮抗剂可以抑制肥大细胞(mast cell,MC)脱颗粒作用,减少组胺和促炎性细胞因子的释放[3]。大鼠肠I/R模型中抑制MC脱颗粒,可抑制肠道炎性反应,减轻肠组织损伤[7]。本实验观察到,CLE降低肠黏膜损伤Chiu’s评分,提示CLE可减轻I/R肠黏膜损伤。
激活的NLRP3炎性小体通过活化caspase-1切割GSDMD,致GSDMD的N端结构域在质膜中形成孔洞,释放细胞内大量IL-1β和IL-18,进而引发细胞死亡裂解, 发生爆发性的炎性反应[8]。NLRP3炎性小体在肠早期再灌注2~4 h发生渐进激活,相关的Chiu’s评分和炎性细胞因子也随之明显上升[1]。本实验观察到CLE降低了肠组织NLRP3、caspase-1及GSDMD细胞焦亡相关蛋白的表达,并下调血清TNF-α、 IL-1β及IL-18炎性细胞因子的含量,提示CLE可能通过抑制I/R肠组织NLRP3炎性小体的激活, 从而减轻肠道炎性反应。
病原相关分子模式(pathogen-associated mole-cular patterns,PAMPs)可活化NF-κB通路,上调NLRP3和IL-1β表达;多种PAMPs和损伤相关分子模式(danger-associated molecular patterns,DAMPs)则促进NLRP3炎性小体的组装与激活。本研究观察到CLE减少I/R肠组织NLRP3炎性小体的表达。据报道,CLE可抑制器官I/R中Toll样受体4(Toll-like receptor 4,TLR4)的表达[3,9]。TLR4可通过MyD88激活NF-κB依赖性和非依赖性途径, 导致NLRP3表达增加[10]。抑制TLR4/MyD88/NF-κB信号通路,有效减轻肠I/R损伤[11]。肠I/R还可诱导大量MC活化并造成TLR4、NF-κB和TNF-α的过表达[12],MC脱颗粒促进剂compound40/80可促进NLRP3炎性小体的表达,而给予MC膜稳定剂则出现相反的结果[7]。因此推测CLE抑制了NLRP3炎性小体的激活可能与抑制TLR4的表达和/或抑制MC脱颗粒相关。
综上所述,第二代H1R拮抗剂CLE,减轻肠I/R损伤,其机制可能通过抑制肠组织NLRP3炎性小体激活。进一步探讨CLE调控NLRP3炎性小体的机制可为肠I/R的防治提供新的实验基础。
