改性蓝藻生物炭促进生物电化学系统阴极氢自养反硝化过程研究
2022-09-27熊江磊罗嘉豪严群
熊江磊,罗嘉豪,严群
1.中国电子系统工程第二建设有限公司
2.江南大学环境与土木工程学院
含硝酸盐废水的过量排放和不当处置可能导致出生缺陷、致畸性和发生突变等不良影响,故这类废水的有效处理已受到广泛关注[1]。与物理化学法或生物处理法等常规处理手段相比,利用生物电化学系统(BES)处理废水对能耗及污泥处理的需求更低[2]。此外,与以硫、铁及其化合物为底物的自养反硝化相比,以氢为电子供体时的氢自养反硝化过程终产物仅为氮气和水,且无有害副产物,对环境更加友好[3]。据报道,变形菌门(Proteobacteria)中的陶厄氏菌属(Thauera)和氢噬胞菌属(Hydrogenophaga)等[4-5]属于氢氧化型反硝化剂,且其大部分都属于细菌。因此耦合氢自养反硝化的BES处理硝酸盐的工艺更具研究价值和应用前景。
为了进一步提升BES阴极反硝化的效率,已出现利用电子穿梭载体促进阴极微生物间的电子传递过程的方法[6]。其中,生物炭材料因为其丰富的电活性官能团及良好的生物相容性,已经广泛应用于农业、环境和能源领域[7]。由于生物炭具有醌-对苯二酚结构以及与缩合芳香族结合的共轭π电子体系2种氧化还原活性结构,因此可以促进生物降解系统中微生物和污染物间的胞外电子传递(EET)[8]。此外,通过酸、碱等不同预处理方式,可以提高生物炭表面含氧官能团的种类和丰度以及材料的比表面积,有利于提升生物炭的性能[9-10]。但目前利用生物炭促进BES生物阴极的反硝化过程中的电子传递的研究尚不多见。
笔者利用太湖蓝藻制备生物炭,并用酸和碱等不同预处理方式对其进行改性。通过扫描电子显微镜(SEM)、X射线能谱分析(EDS)和傅里叶红外光谱(FTIR)等对生物炭的性质进行表征,将生物炭加入到BES反硝化阴极,通过测定硝氮和亚硝氮的浓度研究硝氮还原过程,并借助高通量测序技术对各组BES阴极微生物的群落结构进行测定,探究氢自养反硝化过程中的电子传递机制,以期为蓝藻生物炭促进生物电化学系统反硝化脱氮提供理论参考。
1 材料与方法
1.1 蓝藻生物炭的制备和改性
从太湖(无锡市)收集新鲜蓝藻并晒干,用去离子水清洗干净后于105 ℃烘箱(博讯 GZX9146)中烘干3 h。将蓝藻粉置于真空管式炉(BEQ BEF-1200C-PV)中热解。热解的温度梯度为5 ℃/min,热解最终温度为400 ℃,热解时间为2 h。收集热解后的固体,记为ABC-400。
取ABC-400 5 g与同等质量的分析纯KOH固体混合,以温度梯度为10 ℃/min升温至800 ℃,并停留1.5 h,所得固体记为ABC-800K。取ABC-400 10 g于圆底烧瓶中,加入200 mL硝酸(分析纯)溶液,于100 ℃水浴80 min。干燥后按上述方法同样进行热解,所得产品记为ABC-800N。另取ABC-400 10 g,以温度梯度为 10 ℃/min升温至800 ℃,并停留1.5 h,所得产品记为ABC-800。
1.2 生物炭材料的表征
生物炭材料的表面形貌由场发射扫描电子显微镜(SEM,日立 S-4800,日本)观察,精度为 2 μm。利用全自动比表面积仪(Micromeritics ASAP 2460,美国)对生物炭材料的孔径分布、比表面积进行分析。材料表面的官能团由傅里叶红外光谱仪(Thermo Nicolet IS10,美国)检测,分析软件为OMNIC(Nicolet,美国)。
1.3 BES反硝化试验
搭建双室BES反应器,阴、阳极室通过阳离子交换膜(跃进CMI-7000S,中国)隔开,各室实际容积为480 mL。利用钛丝将碳纤维材料固定成束,制作两极室的碳刷。非生物阴极中不含微生物。生物阴极中,阳极微生物的驯化通过数据记录仪(Keithley 2700,美国)记录,当阳极电位在-0.55 V保持24 h以上时视为驯化完成。阴极微生物驯化完成的标志则是当阴极电位在-0.63 V并保持24 h以上[11]。
设置2组非生物阴极反应器,其中1组阴极添加0.5 g ABC-800,不添加生物炭材料的另外1组设为对照组,测定阴极9 d的硝态氮、亚硝态氮浓度。根据非生物阴极的结果,进行BES的生物阴极试验。在微生物驯化完成后,向试验组分别加入0.5 g ABC-800、ABC-800N和ABC-800K,并以加入的生物炭材料命名反应器,探究不同生物炭对生物阴极反硝化效果的影响。每24 h从阴极室中部取5 mL水样,依据《水和废水监测分析方法》[12]测定硝氮和亚硝氮浓度。所有的测试至少进行3次,取平均值。
1.4 高通量测序试验
阴极的电势与脱氮效果稳定之后,取各组反应器阴极碳刷上的微生物进行测序。试验前分上、中、下3处剪取约3 cm的样品,并与阴极液共同置于EP管中,混合均匀。经DNA提取后,以细菌的16S rRNA基因的V3~V4可变区为靶标进行PCR扩增(ABI GeneAmp 9700,美国)。扩增时的正向引物为338F(ACTCCTACGGGAGGCAGCAG),反向引物为 806R(GGACTACHVGGGTWTCTAAT)。纯化的扩增子在Illumina Miseq测序平台上测序,可以同时完成传统基因组学、功能基因组学等的研究。
2 结果与分析
2.1 生物炭材料的结构表征
2.1.1 生物炭材料的表面形貌
ABC-800、ABC-800N和ABC-800K 3种生物炭材料的表面形貌如图1所示。由图1可知,ABC-800的表面较为平滑,偶见颗粒或结晶,扫描区域未出现明显孔状结构;生物炭ABC-800N孔洞呈现蠕虫刻蚀状,孔洞碳壁互相连通,孔隙结构以微孔为主;而KOH改性后的ABC-800K材料表面为沟壑状,孔洞穿插于碳壁中,孔隙率较大。可见,2种改性方式都可有效改善生物炭的表面形貌,增加材料表面的孔隙结构。
3种蓝藻生物炭表面N、O元素含量的分布如图2、图3所示。由图2可知,3种蓝藻生物炭材料中N元素(图中红色散点)的分布区域有较大差异,ABC-800N的N元素分布最为广泛,即其表面含量最高;ABC-800K次之,而ABC-800的N元素含量最低。由图3可知,O元素(图中绿色散点)的分布情况与N元素较为相似,ABC-800N在O元素分布上仍表现出最高丰度,而ABC-800最低。通过对3种材料表面元素含量进行分析(表1)可知,ABC-800N中N、O元素含量最高,这可能会使该材料拥有较好的电子传递性能。

图 1 3种生物炭材料的表面形貌Fig.1 Surface morphology of the three biochar materials

图 2 3种生物炭材料表面N元素含量分布Fig.2 Distribution of N element content on the surface of three biochar materials

图 3 3种生物炭材料表面O元素含量分布Fig.3 Distribution of O element content on the surface of three biochar materials
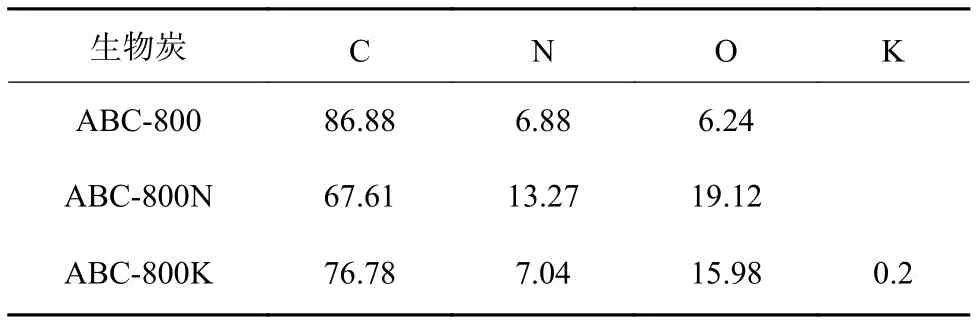
表 1 3种生物炭材料表面元素含量Table 1 Surface element contents of the three biochar materials %
2.1.2 生物炭材料的孔隙结构
3种生物炭的N2吸附-脱附曲线、孔径分布如图4所示,其中图4(b)纵坐标dV/dW为孔径的微分分布,表示孔容随孔径变化的关系。由图4(a)可知,2种改性蓝藻生物炭的吸附曲线为Ⅰ型曲线,说明孔内的吸附势较强,材料改性后微孔数量增多。中压区出现滞后环,表明改性材料中具有一定数量的中孔[13]。由图4(b)可知,未经改性的ABC-800平均孔径较大,孔容较小;而改性的平均孔径显著减小,孔容增加,说明对蓝藻生物炭的改性可以有效改善材料表面的孔隙结构。此外,ABC-800、ABC-800N、ABC-800K的比表面积分别为1.65、1 040.04和1 731.58 m2/g,表明2种改性方式可以极大地提升蓝藻生物炭的比表面积。
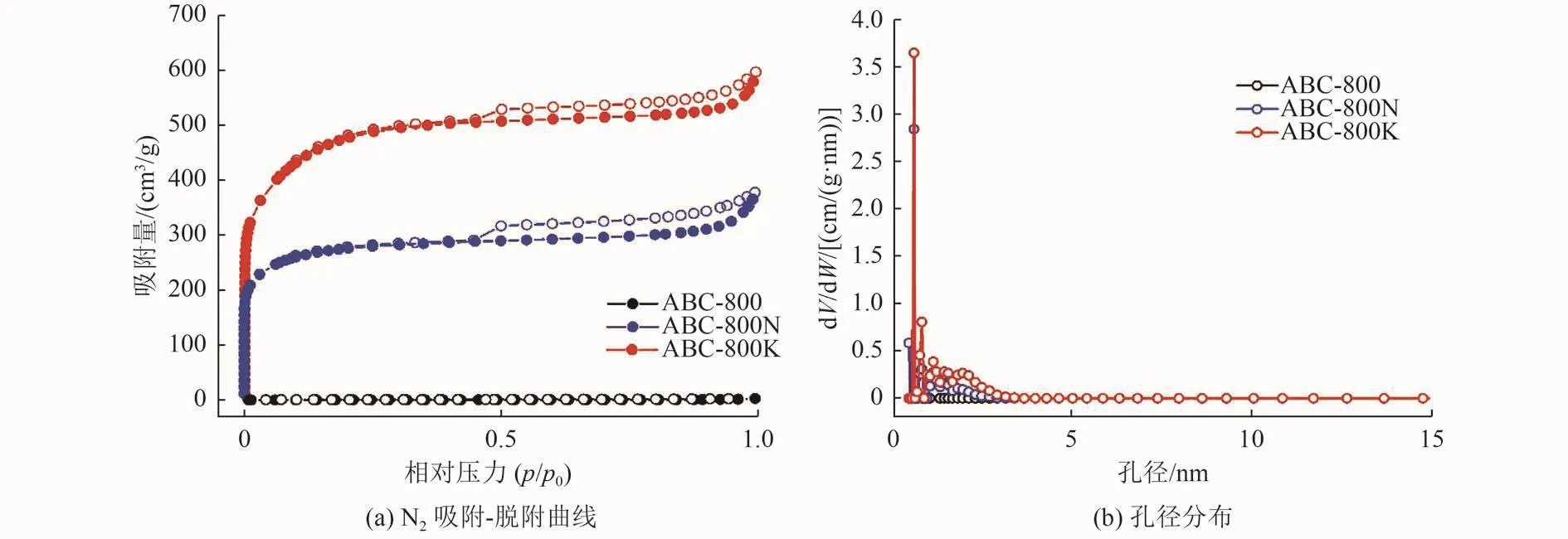
图 4 3种生物炭的N2吸附-脱附曲线和孔径分布Fig.4 Nitrogen adsorption-desorption isotherms and pore width distribution of the three materials
2.1.3 生物炭表面的官能团组成
由图5可见,3种生物炭的FTIR谱图较为相似,其中在3 425 cm-1处出现的宽带峰,是由于醇、酚羟基或羧基中—OH的伸缩振动引起的;而2 925 cm-1处的吸收峰多数为脂肪烃中C—H的伸缩振动所引起[14]。在1 600 cm-1处有明显的吸收峰,应归因于芳香族中C=C结构的伸缩振动,以及共轭醌或酮上存在的C=O结构的伸缩振动[15]。而1 389 cm-1处的吸收峰,则与羧基或苯酚中的—OH结构的弯曲振动相关[16]。在750 cm-1处出现了1个小的吸收峰,可能是高温热解过程中产生的吡啶结构所引起的环振动[17]。因此,蓝藻生物炭及其改性材料拥有丰富的官能团结构。由于共轭醌、酮结构是良好的电子传递结构,既可接受电子也可释放电子;而ABC-800N芳香类结构C=O官能团所对应的吸收峰强度(1 600 cm-1)大于ABC-800及ABC-800K,因此在生物相容性和电子传递能力方面,ABC-800N可能优于ABC-800及ABC-800K。
2.2 生物炭对BES脱氮的影响
2.2.1 对非生物阴极脱氮的影响
2组非生物阴极BES反应器硝氮、亚硝氮浓度随时间的变化如图6所示。由图6可知,当各阴极初始硝态氮浓度为100 mg/L时,由于添加生物炭材料的作用,从第1天起各非生物阴极反应器中硝氮浓度呈现不同程度的下降趋势。第9天时对照组阴极室内硝氮浓度为79.66 mg/L,而加入ABC-800的BES组反应器阴极硝氮浓度仅为60.52 mg/L,较对照组硝氮脱除率提高112.49%。这表明ABC-800的加入使得BES阴极硝氮的脱除效率提高,其机理为阳极产生的电子经由外部的导线传递到阴极后,经过阴极电极后被溶液中的硝酸盐利用,从而进行还原脱氮,但各反应器中亚硝氮浓度呈现积累的趋势。对照组的9 d亚硝氮积累浓度远高于ABC-800组,在第9天时达5.86 mg/L,而ABC-800组仅为1.68 mg/L。这可能是因为亚硝氮更难以接受来自电极上的电子,而ABC-800作为电子穿梭载体,其本身可能会促进亚硝氮的还原。
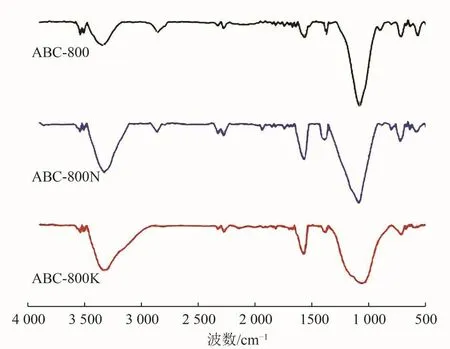
图 5 不同生物炭材料的FTIR谱图Fig.5 FTIR spectra of different biochar materials
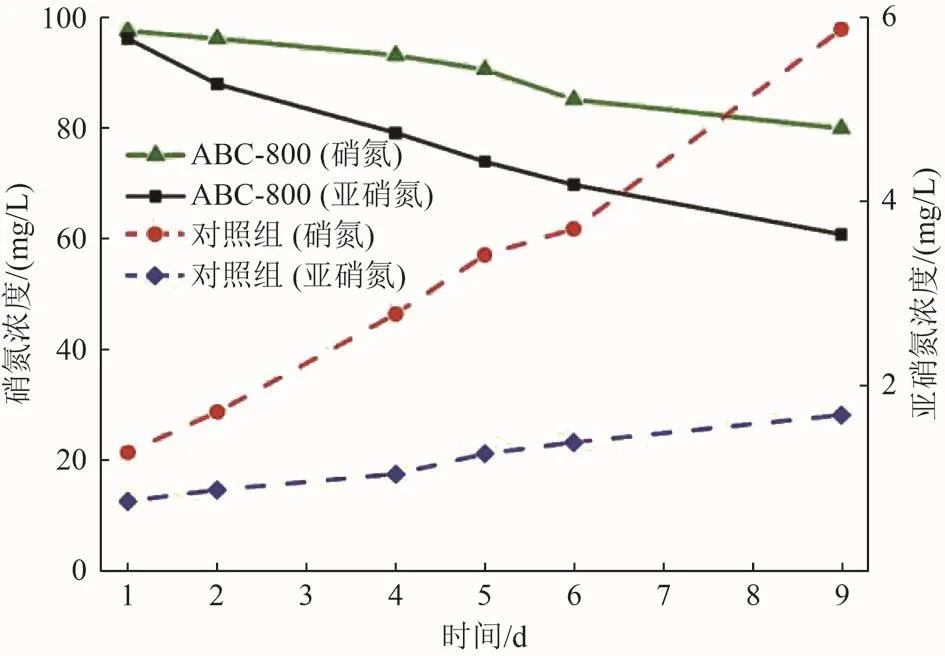
图 6 2 组非生物阴极硝氮、亚硝氮浓度随时间的变化Fig.6 Variation of nitrate and nitrite concentrations with time in two groups of abiotic cathodes
2.2.2 对生物阴极脱氮的影响
各组BES阴极室内硝氮和亚硝氮浓度变化如图7所示。由图7可知,加入3种生物炭后生物阴极中硝氮的浓度均有所下降,其中ABC-800N组和ABC-800K组效果较好,第7天时硝氮浓度分别为5.45和50.75 mg/L,而ABC-800组次之,硝氮浓度为72.06 mg/L;对照组硝氮浓度最高,为99.44 mg/L。4组反应器7 d脱氮效率分别为29.6%(对照组)、46.5%(ABC-800)、96.0%(ABC-800N)和 62.5%(ABC-800K)。这说明加入生物炭后BES阴极的硝氮去除效率明显提升,且ABC-800N的效果最好。其原因可能是改性后蓝藻生物炭表面含有丰富的含氧官能团,且ABC-800N含有较多的与生物相容性及电子传递能力相关的芳香性含氧功能基团。但各反应器中亚硝氮浓度的变化表现出一定的差异:对照组和ABC-800组亚硝氮浓度呈上升趋势,而ABC-800N和ABC-800K组则先上升后下降(图7)。其中,第3天ABC-800N组达到峰值(1.26 mg/L),而ABC-800K则为5.36(mg/L);第7天亚硝氮浓度分别为12.06(对照组)、7.21(ABC-800)、0.27(ABC-800N)和2.66(ABC-800K)mg/L,表明对照组和 ABC-800组中均有一定程度的亚硝氮积累,而ABC-800N和ABC-800K组中亚硝氮的脱除效率更高。
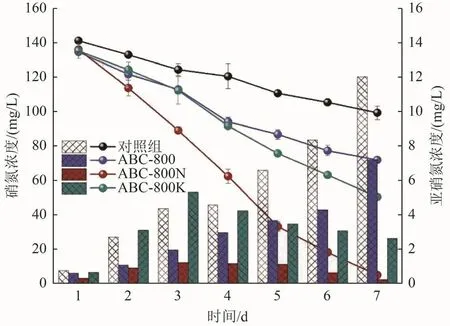
图 7 投加3种生物炭材料后生物阴极硝氮、亚硝氮浓度随时间的变化Fig.7 Variation of nitrate and nitrite concentrations with time in biological cathode under the addition of three biochar materials
2.3 高通量测序分析
2.3.1 门水平上微生物种群分布
投加不同生物炭材料时共有OTU在门水平的相对丰度如表2所示。由表2可知,加入改性蓝藻生物炭后,BES阴极微生物群落在门水平上显示出较大的差异性。4个试验组相对丰度占比较高的有变形菌门(Proteobacteria,均值>30%)、拟杆菌门(Bacteroidota,均值>12%)以及绿弯菌门(Chloroflexi,均值>8%)。其中,对照组中的优势菌群为变形菌门(相对丰度占比为52.15%)和拟杆菌门(12.91%),而加入生物炭后,变形菌门的相对丰度有所下降,分别为37.63%(ABC-800)、30.96%(ABC-800N)和36.02%(ABC-800K);同时拟杆菌门的含量有所上升,达27.49%(ABC-800)、28.88%(ABC-800N)和21.89%(ABC-800K)。此外,相较于对照组,加入生物炭后BES阴极中放线菌门(Actinobacteriota)和酸杆菌门(Acidobacteriota)的相对丰度也有所上升, ABC-800N组的相对丰度几乎是对照组的20倍。因此,在加入生物炭后,氢自养反硝化BES的阴极微生物群落结构发生了较大的变化。原因是生物炭的加入可以改变阴极表面的比表面积与孔径分布,此外不同的改性方式会导致阴极表面的官能团以及N、O元素含量发生不同程度变化,从而可以不同程度改变微生物的群落分布。
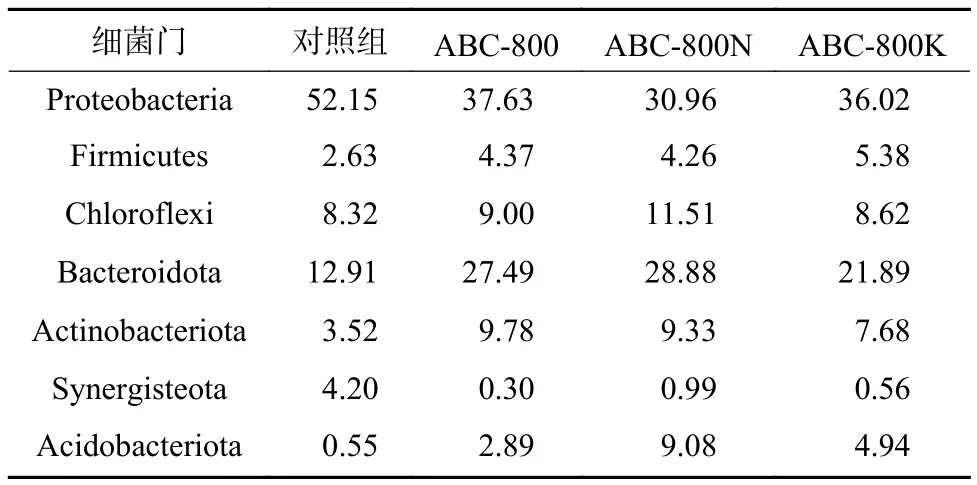
表 2 投加不同生物炭材料后各组反应器微生物的共有OTU在门水平的相对丰度Table 2 Relative abundance of shared OTU of microorganisms in each reactor at phylum level after different biochar materials addition %
2.3.2 属水平上微生物的群落差异
各组反应器中除了有其特有的微生物种群外,共有的微生物菌属的相对丰度也有较大差异。因此通过横向比较各反应器中同一微生物的相对丰度可以判断加入生物炭后微生物结构的变化(图8)。与对照组相比,加入蓝藻生物炭后BES阴极的微生物群落结构发生很大变化,其中ABC-800N组的陶厄氏菌属(Thauera)、JGI_0001001_H03以及Thiobacillus等属的相对丰度明显提升。Thauera是一种典型的氢自养反硝化细菌,已证实存在于在多种氢营养型反应器中,并与种间电子的直接传递过程(DIET)相关[18];JGI_0001001_H03属细菌目前较少见于文献报道中,Yao等[19]在其反硝化效率较好的CW-C组反应器中发现该细菌大量富集,表明其与反硝化过程相关;Thiobacillus也是一种常见的自养反硝化菌,它可以利用电极上的电子作为电子供体进行硝氮的还原,并且与N2O的产生相关[20]。ABC-800组中丰度较高的种属为PHOS-HE36,其是一种典型的反硝化剂[21]。ABC-800K 组中,Thermomonas及Chitinophagaceae的丰度较高。Bacteroidetes_VC2.1_Bac22见诸于硫酸盐还原环境中,表明其有可能参与了硫酸盐的还原[22];而Thermomonas则是一种效果很好的反硝化剂[23];Chitinophagaceae是一种氨氧化细菌[24]。这表明ABC-800K组微生物结构发生了不同的改变,出现了其他的代谢机制。
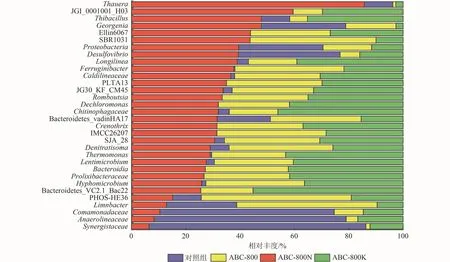
图 8 添加不同生物炭材料时反应器内微生物种群相对丰度Fig.8 Relative abundance of microbial population in reactors with different biochar materials addition
3 结论
(1)经硝酸改性后的生物炭(ABC-800N)增加了材料本身的比表面积,且其表面含有较多的与生物相容性及电子传递能力相关的芳香性含氧官能团。
(2)将ABC-800N投加到BES生物阴极后,其脱氮效率相较对照组明显提高。
(3)生物阴极高通量测序结果表明,在门和属水平上,各组反应器的优势菌属都包含电活性、产氢和反硝化相关的微生物群落;投加ABC-800N可以促进BES反应器中阴极的氢自养反硝化过程,缓解亚硝态氮的积累,同时提高了与氢自养反硝化及电子传递相关的微生物菌属丰度。
