磷对硫自养反硝化效果的影响
2022-09-27赵东华岳冬梅郑岩皓束梦照葛俊孙菲菲
赵东华,岳冬梅,郑岩皓,束梦照,葛俊,孙菲菲
中交上海航道勘察设计研究院有限公司
硝酸盐浓度是衡量水环境质量的重要水质指标之一,其过量进入水体不仅易引起水体富营养化,破坏水生生态系统,还威胁饮用水安全[1-2]。研究表明,硝酸盐污染已经成为地表水和地下水共同面临的重要水环境问题之一[2],我国地表水和地下水硝酸盐污染情况也不容乐观[3-4]。张鑫等[3]收集了我国7大地区的71条主要河流硝酸盐氮-N)浓度数据,发现7.83%的河流-N浓度超过了10 mg/L,其中牡丹江、海河和长江入海口的-N浓度超过20 mg/L,呈重度污染。据《中国生态环境状况公报(2018年)》[4],全国2 833处浅层地下水监测井水质总体较差,-N为主要超标指标之一。
目前,传统异养生物反硝化因其经济、高效的特性被广泛用于污水脱氮。传统异养反硝化以碳源为电子供体,将-N还原为氮气从而实现脱氮,但当进水碳氮比(C/N)过低时,需要额外投加碳源,投加量不足时难以满足反硝化过程,而投加过量则会产生二次污染,反硝化过程受进水水质影响较大。硫自养反硝化以单质硫或硫的还原态化合物作为电子供体,将-N还原为氮气,摆脱了对碳源的依赖,可以作为异养反硝化的替代方案,用于C/N较低的地表水和地下水脱氮,因此备受研究者关注[5-8]。
磷作为参与微生物生长和代谢的大量元素,其浓度极大地影响着微生物的生长代谢。大量研究表明,磷限制会显著影响生物反硝化效率,补充磷后脱氮率会大幅度提升[9-11]。Moon等[10]采用硫单质作为电子供体的自养反硝化柱处理硝酸盐污染的地下水,磷限制时,系统难以去除硝酸盐,补充磷后,出水-N浓度显著下降。Fan等[11]利用硫自养和混养反硝化活性污泥系统处理模拟的低磷浓度微污染地表水,发现补充磷能显著提升-N去除率。由于氮、磷在污水处理过程中的去除率以及在自然界中迁移转化特性等方面的差异,导致很多轻污染河湖水、地下水及某些污水处理厂尾水中的磷浓度很低[9,12],这可能会对反硝化效率产生不利影响。此外,很多污水处理和水体修复工程中,氮和磷均需要去除,但大多数水处理工艺中氮和磷的去除是不同步的,因此在工艺设计中往往需要考虑脱氮除磷的先后顺序,或者将反硝化进水中的磷控制在既满足反硝化的需求又不会导致磷污染的浓度水平。因此,有必要深入研究能满足硫自养反硝化的最低磷浓度,但目前该方面的研究还比较缺乏。Wang等[9]研究表明,适合硫自养反硝化的最低可生物利用磷浓度为0.15 mg/L,但该研究中-N浓度仅为4.5 mg/L,难以为-N浓度较高的水处理提供支持。
笔者通过考察不同磷浓度对硫自养反硝化的效果和微生物群落结构的影响,以探究硫自养反硝化所需的最低磷浓度,以及磷浓度对硫自养反硝化效率的影响机理。
1 材料与方法
1.1 试验装置
采用内径为6 cm、高50 cm的有机玻璃柱进行试验。柱子内部从下至上依次装填砾石(直径为1~2 cm)5 cm,单质硫与石灰石混合层40 cm(单质硫与石灰石体积比为1∶1,片状单质硫直径为0.5 cm,石灰石直径为0.5~1 cm),砾石(直径为0.5~1 cm)5 cm。进水为连续流,下进上出,由蠕动泵控制流量。整个试验过程中,有机玻璃柱放置在室温约20 ℃的房间中。
1.2 进水及运行参数
试验周期为2021年2月3日—4月1日,共57 d,分为常规运行期、磷饥饿期和磷恢复期3个阶段(表1),共设置7个处理组,每组设2个平行。各处理组全部采用自然挂膜的方式启动,启动时的进水为处理生活污水的生物接触氧化池出水。系统成功启动后,试验进水均为低磷浓度的池塘水,通过补充一定量的KNO3和KH2PO4将进水调至所需的氮、磷浓度水平。常规运行期和磷饥饿期各处理组的进水及运行参数均相同;磷恢复期,各处理组的进水总磷(TP)浓度分别为0.050、0.075、0.100、0.200、0.300、0.400、0.500 mg/L(溶解性反应磷占TP的比例不低于95%),其他进水理化指标均相同。整个试验期内各处理组水力停留时间(HRT)均设为3.5 h。
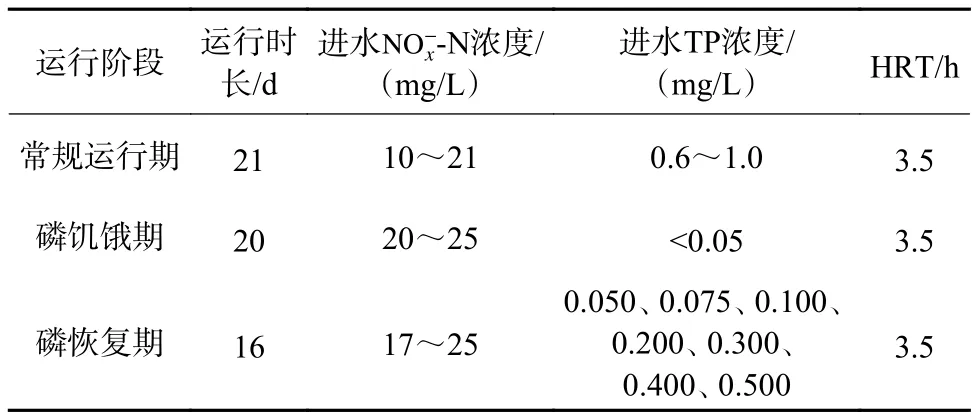
表 1 试验系统运行阶段与运行参数Table 1 Operational phases and parameters of the test system
1.3 水质指标检测
水样先经0.45 μm微孔滤膜过滤,然后再进行检测分析。-N浓度采用紫外分光光度法测定,亚硝酸盐氮-N)浓度采用N-(1-萘基)-乙二胺分光光度法测定,硝态氮-N)浓度为-N和-N浓度之和。
1.4 微生物样品分析
在磷恢复期的第16天,分别取磷饥饿和磷恢复处理组有机玻璃柱中段单质硫样品,进行微生物群落结构分析。
1.4.1 DNA提取、PCR扩增和lluminaMiSeq测序
使用OMEGA试剂盒E.Z.N.ATMMag-Bind Soil DNA Kit提取样品总DNA后检测DNA质量。利用Qubit3.0 DNA检测试剂盒对基因组DNA精确定量后,加入引物341F(5'-CCTACGGGNGGCWGCAG-3')和 805R(5'- GACTACHVGGGTATCTAATCC-3')进行聚合酶链反应(PCR),使用PCR基因扩增仪来扩增细菌16S rRNA基因的V3~V4区,扩增条件:94 ℃ 3 min,94 ℃ 30 s,45 ℃ 20 s,65 ℃ 30 s,5 个循环;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,20 个循环;最后延伸72 ℃ 5 min。PCR产物作为第2轮扩增的模板,引入Illumina桥式PCR兼容引物,扩增条件:95℃ 3 min,94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,5 个循环;最后延伸72 ℃ 5 min。在2%(w/v)琼脂糖凝胶上检测PCR产物,并使用Qubit3.0荧光定量仪进行定量。设3个平行样,将纯化的扩增子等摩尔合并,MiSeq文库构建和测序均在生工生物工程(上海)股份有限公司进行,测序平台为llumina MiSeqPE300。
1.4.2 序列处理与分析
获得原始序列后,使用PRINSEQ过滤质量低于20的碱基。通过USEARCH将优化后的序列以97%的相似度聚类为OTU,然后将代表性序列与核糖体数据库(RDP数据库,http://rdp.cme.msu.edu)进行比对。使用Mothur软件基于OTU信息计算Alpha多样性指数,包括Shannon、Simpson、Chao和Ace指数。
2 结果与讨论
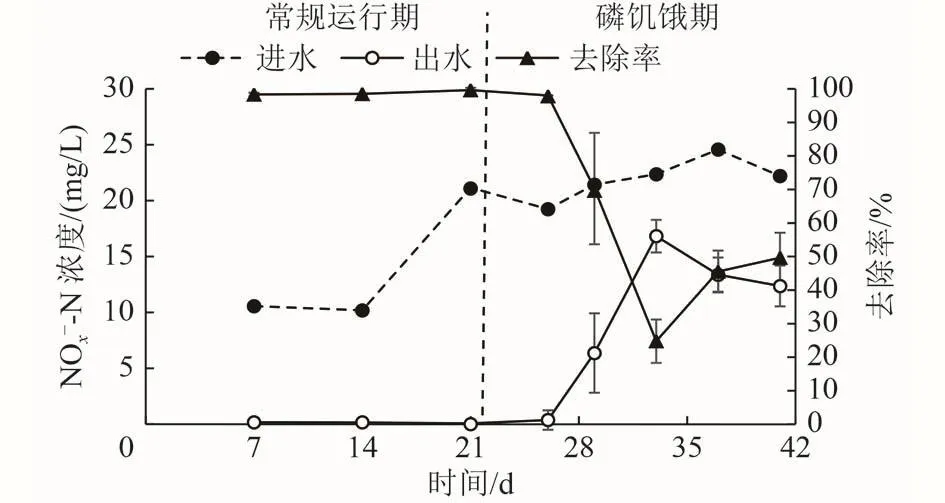
图 1 常规运行期和磷饥饿期进出水-N浓度及去除率Fig.1 Concentrations of influent and effluent-N and its removal efficiency during the normal and phosphorus starvation periods
2.1 磷饥饿对硫自养反硝化效果的影响
以磷酸钙沉淀的形式部分截留下来[13],而反硝化菌群能利用固态的磷酸钙作为磷源[14]。
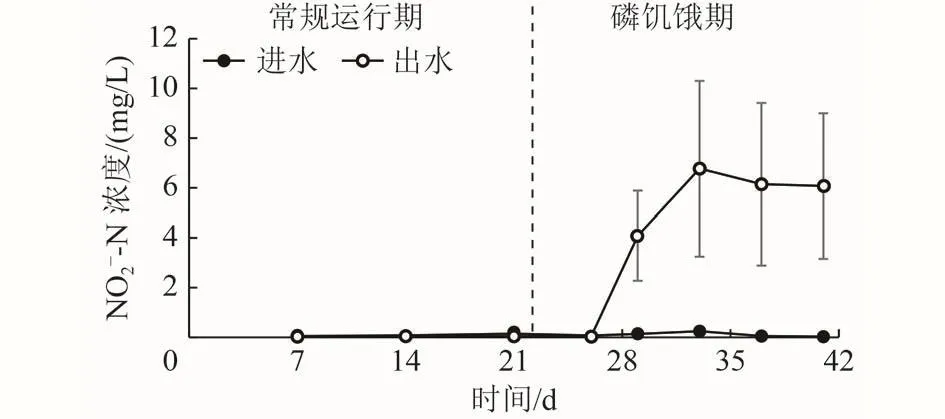
图 2 常规运行期和磷饥饿期进出水-N浓度Fig.2 Concentrations of influent and effluent-N during the normal and phosphorus starvation periods
2.2 硫自养反硝化所需的最低磷浓度
在经过20 d的磷饥饿后,将7个处理组进水磷浓度分别调至0.050、0.075、0.100、0.200、0.300、0.400、0.500 mg/L,以分析硫自养反硝化所需的最低磷浓度。由图3可知,进水磷浓度越高的处理组,其-N去除率越快恢复至饥饿前水平。进水磷浓度为0.400、0.500 mg/L的处理组,-N去除率在补充磷的第3天,恢复至磷饥饿前水平,稳定达到98%以上。进水磷浓度为0.300 mg/L的处理组,-N去除率在补充磷的第6天,恢复至磷饥饿前水平。进水磷浓度为0.200 mg/L的处理组,-N去除率在补充磷的第9天,恢复至磷饥饿前水平。进水磷浓度小于0.200 mg/L的处理组,在本试验周期内,-N去除率始终未曾恢复至饥饿前水平。
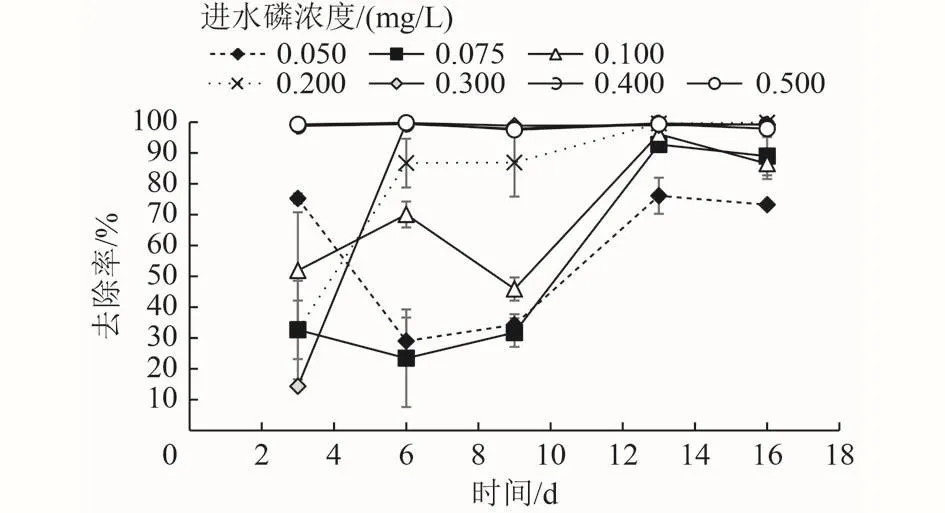
图 3 磷恢复期不同进水磷浓度下的-N去除率Fig.3 -N removal efficiency under different influent phosphorus concentrations during phosphorus recovery period
Wang等[9]研究认为,当-N浓度为5~16 mg/L时,硫自养反硝化所需的最低生物可利用磷浓度为0.150 mg/L,其计算依据主要为出水相对于进水减少的磷浓度,即硫自养反硝化系统磷去除量。但也有研究发现,当反硝化系统磷去除量为0.148 mg/L,而进水磷浓度为0.160 mg/L时,并不能支撑反硝化系统进行完全反硝化[14]。多种因素,如HRT、进水硝酸盐浓度和进水磷浓度等,均会影响硫自养反硝化系统的磷去除量[14],因此不同运行条件下,硫自养反硝化系统磷去除量可能存在较大差异。此外,充足的磷有利于增强反硝化系统对进水水质水量波动的耐受性[9],从本研究中也可以发现,磷充足时(常规运行期),硫自养反硝化系统能适应进水硝酸盐浓度的较大变化,当进水-N浓度从10 mg/L提升至21 mg/L时,-N去除率未发生明显变化(图1)。因此,本研究以能满足硫自养反硝化实现最大-N去除率的最低进水磷浓度,即0.200 mg/L,作为硫自养反硝化所需的最低磷浓度。
2.3 磷浓度对微生物群落结构的影响
在磷恢复期的第16天,分别采集磷饥饿处理组(进水磷浓度为0.050 mg/L的处理组,已经处于磷饥饿状态36 d)和磷恢复处理组(进水磷浓度为0.500 mg/L)中段的硫磺颗粒,进行高通量测序。
2.3.1 微生物多样性
磷饥饿和磷恢复处理组的高通量测序分别获得212和232个OTU,并且2个样品的检测覆盖率(coverage)均在0.99以上,表明本研究中测序结果几乎囊括了样品中所有的细菌物种,能够反映样品中细菌群落的真实情况(表2)。
Alpha多样性指数可以反映微生物群落的丰度和多样性。Shannon指数和Simpson指数反映样品的多样性程度,Shannon指数越高,而Simpson指数越低,表明微生物群落的多样性越高;Chao指数和Ace指数是用不同的算法估计样本中所含OTU数目的指数,其值越大,表明物种数越多,微生物群落的丰度越高。由表2可知,以上4个指数均表明,磷恢复处理组的物种多样性及丰度均高于磷饥饿处理组,其他研究也表明营养盐充足时的物种多样性显著高于饥饿条件下的物种多样性[11,20]。
2.3.2 群落结构
基于RDP数据库的分类信息,分别对磷饥饿及磷恢复处理组的高通量测序数据进行了属水平上的分类分析,结果见图4。从图4可看出,磷饥饿和磷恢复处理组的优势菌属差异很大。磷饥饿处理组的优势菌属(占比大于1%)为Psychrobacter(35.34%)、Desulfocapsa1(0.11%)、Sulfurisoma(3.93%)、Luteolibacter(3.79%)、Rhizobium(2.94%)、Simplicispira(2.12%)、Pseudomonas(2.00%)。Psychrobacter是一类嗜冷菌,但能适应多种温度范围,Psychrobacter具有修复被杂环化合物、烃类、药物等污染环境的潜力[21]。Zheng等[22]从好氧生物滤池分离了一株Psychrobacter,能在好氧条件下以硝酸盐和亚硝酸盐为电子受体进行反硝化。但是,目前关于该类细菌的研究还较少,其生理生化特征、在反应中的具体代谢过程和在反硝化过程中的作用还有待进一步研究。Desulfocapsa是一类硫酸盐还原菌,广泛存在于自然水体和污水处理系统中,会与异养反硝化菌群竞争碳源,但也有些硫酸盐还原菌能同时进行反硝化。硫自养反硝化系统-N去除率下降时,Desulfocapsa的丰度显著增加,而具有硫自养反硝化功能的Thiobacillus丰度则显著下降[23]。磷恢复处理组的优势菌属为Sulfurimonas
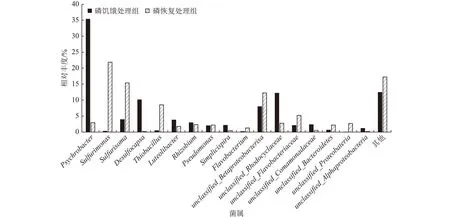
图 4 不同处理组属水平上微生物群落结构Fig.4 Microbial community structure at genus level of different treatment groups
(21.86%)、Sulfurisoma(15.39%)、Thiobacillus(8.53%)、
Psychrobacter(2.96%)、Rhizobium(2.36%)、
Pseudomonas(2.18%)、Luteolibacter(1.80%)、
Flavobacterium(1.28%)。其中,丰度最高的
Sulfurimonas、Sulfurisoma、Thiobacillus均为硫自养反硝化相关的功能菌属,三者的相对丰度之和高达
45.78%。但在磷饥饿处理组中,参与硫自养反硝化过程的功能菌相对丰度较低,Sulfurimonas、
Sulfurisoma、Thiobacillus仅 为0.29% 、3.93%和
0.45%,三者的相对丰度之和为4.67%。磷的添加显著促进了硫自养反硝化功能菌的生长。此外,饥饿会显著改变系统的优势菌属,磷限制会导致硫自养反硝化功能菌在系统中的丰度大幅减少,当营养恢复后,其丰度又会大幅提升[9,11,20,24]。这可能也是磷饥饿时-N去除率大幅下降,而磷恢复后其去除率又逐步提升的重要原因。
3 结论
(3)磷恢复处理组的微生物多样性和丰度均显著高于磷饥饿处理组。磷浓度极大地影响着硫自养反硝化系统的微生物群落结构,硫自养反硝化相关功能菌属在磷饥饿处理组的相对丰度仅为4.67%,而在磷恢复处理组中的相对丰度高达45.78%。
