含酚废水α-Fe2O3催化臭氧氧化参数优化及机理分析
2022-09-27王勇张耀宗毕莹莹杜明辉孙晓明
王勇,张耀宗,毕莹莹,杜明辉,孙晓明*
1.国家环境保护生态工业重点实验室, 中国环境科学研究院
2.华北理工大学建筑与土木工程学院
焦化、造纸、印染及制药等行业生产过程会产生大量含酚废水,是国内外污水处理领域的一大难题,采用传统工艺很难将其去除[1]。催化剂能够促进臭氧分解生成·OH等自由基,从而有效降解含酚废水[2-3]。同时,催化剂可降低臭氧在气相-液相转换时的传质阻力[4],从而提高臭氧利用率。铁基催化剂由于具有储量丰富、易于合成、低毒性等优点而受到越来越多的关注[5-6]。其中,α-Fe2O3具有较强的臭氧催化活性[7-8],研究α-Fe2O3催化臭氧氧化处理含酚废水具有一定实际意义和应用价值。
有研究表明,臭氧投加量、催化剂投加量、pH及反应时间是催化氧化过程的主要影响因素[9-11]。参数选取对催化氧化过程和污染物氧化效果影响明显。因此,需对反应过程中各影响因素控制权重进行评估,进而优化反应条件。限于试验次数、时间、计算等问题,不断修正参数并完整地进行每个试验显然是困难的,为达到满意的处理效果,同时减少冗杂的试验次数,可对试验进行正交设计[12-14]。
笔者采用α-Fe2O3催化臭氧氧化技术处理苯酚废水,以COD去除率和单位臭氧COD降解量作为参考指标设计正交试验。通过极差分析,得到各指标的最佳反应条件与各因素对指标的影响权重;经过权重矩阵计算得到各因素对指标的综合影响程度,优化了试验过程;对正交试验数据做方差分析和验证试验,验证了试验结果的真实性,探讨了苯酚废水的催化氧化降解机理,以期为含酚废水的有效处理提供参考。
1 材料与方法
1.1 试验材料与设备
试验用α-Fe2O3经Zetasizer Nano ZS90粒度分析仪表征,其粒径为6.03 μm。试验开始前打开臭氧浓度检测器进行预热,控制仪器温度为20~24 ℃。使用去离子水配制50 mg/L苯酚溶液1 L于柱状反应装置中。以99.999%纯度氧气经臭氧发生器(3ST,北京同林科技有限公司)制备臭氧,通过流量计控制气体流量为100 mL/min,调节发生器功率控制臭氧浓度,并通过臭氧在线检测仪(3S-J5000,北京同林科技有限公司)实时监测臭氧浓度。制备的臭氧通过10 μm孔径曝气头向装置底部曝气,反应同时,装置底部放置转子进行磁力搅拌(C-MAG MS 4,德国IKA),以防止催化剂沉积。试验尾气用硫代硫酸钠(Na2S2O3)吸收。使用NaOH、HCl调节溶液pH。试验流程如图1所示。
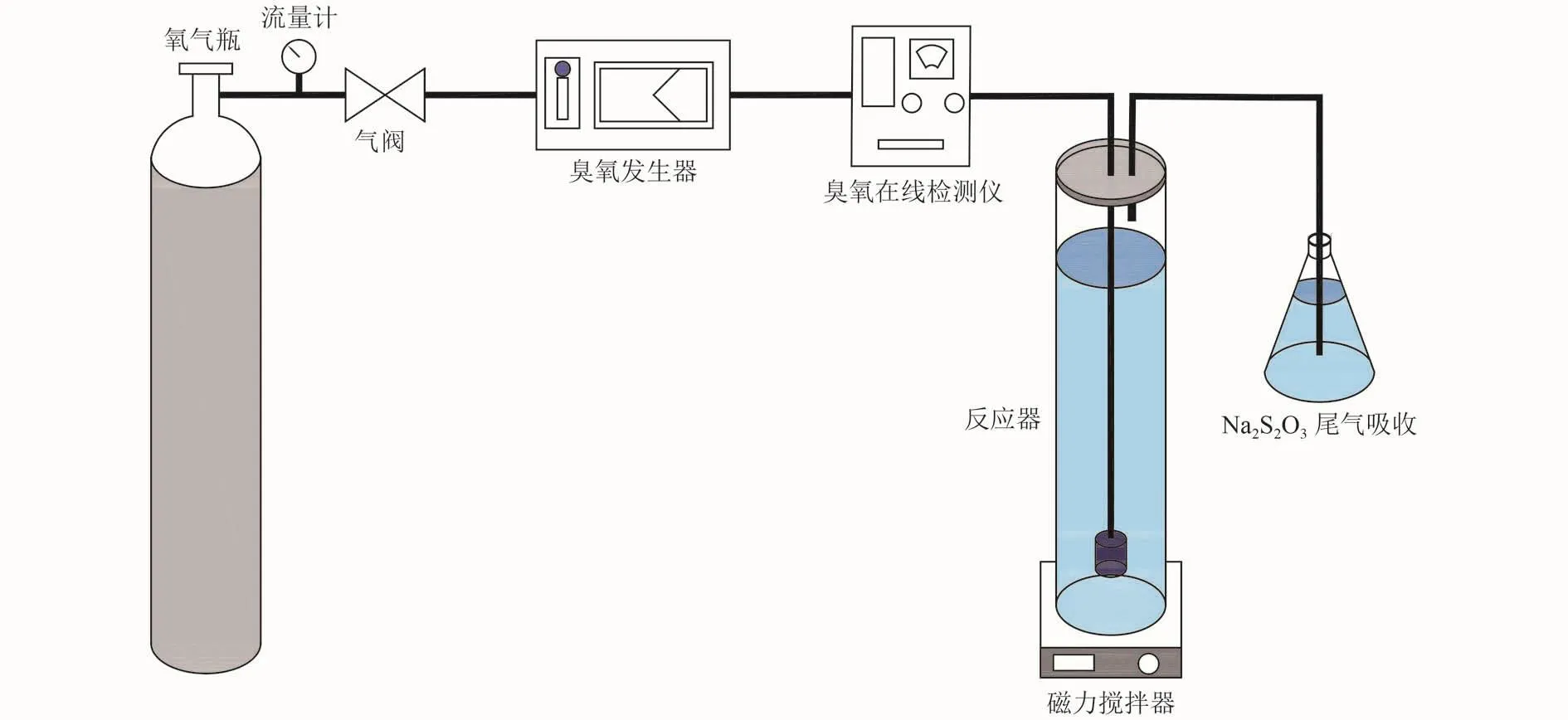
图 1 试验流程Fig.1 Experimental flow chart
1.2 正交试验
为获得优化的反应条件并减少试验次数,以臭氧投加量(A)、催化剂投加量(B)、pH(C)、反应时间(D)为主要因素设计正交试验,每种因素设置4个水平,具体见表1。
1.3 表征及分析方法
通过扫描电子显微镜(SEM,蔡司,evo18,德国)得到催化剂的表面形态和结构,采用LH-3BA型多参数水质测定仪检测水样COD,采用PHS-2F型pH计检测反应介质pH。利用N2-吸附/脱附检测α-Fe2O3的表面结构特性。
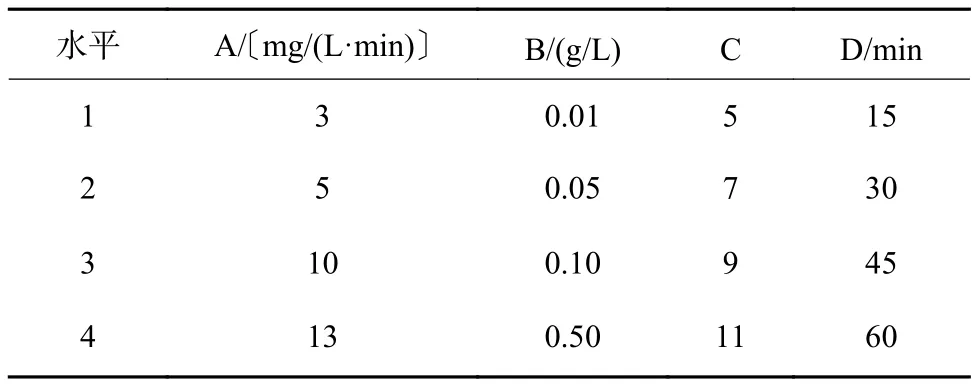
表 1 α-Fe2O3催化臭氧氧化苯酚废水正交试验因素及水平Table 1 Orthogonal experiment factors and level of α-Fe2O3 catalytic ozonation of phenol wastewater
2 结果与讨论
2.1 催化剂表征
图2为α-Fe2O3的SEM图。从图2可以看出,催化剂呈团聚的不规则球状。采用Brunauer-Emmett-Teller(BET)方程及 Barrett-Joyner-Halenda(BJH)吸附模型计算出α-Fe2O3比表面积、孔容及平均孔径,分别为83.38 m²/g、0.135 cm³/g、7.447 nm。

图 2 α-Fe2O3的 SEM 图Fig.2 SEM images of α-Fe2O3
2.2 正交试验
使用SPSS 2021a软件进行正交试验设计,L16(44)正交表及试验结果如表2所示。以试验结束时COD去除率及单位臭氧COD降解量作为研究指标。从表2可以看出,编号9和13的COD去除率最大,为82.56%,该条件下催化剂投加量为最低水平,同时,编号8、10、12的COD去除率均超过70%。单位臭氧COD降解量表征了试验过程中臭氧利用率,数值越高,则臭氧的利用情况越好。编号3的单位臭氧COD降解量最大,为0.41 g/mg,此时臭氧投加量仅为3 mg/(L·min),其次为7号和8号,臭氧投加量均为 5 mg/(L·min)。
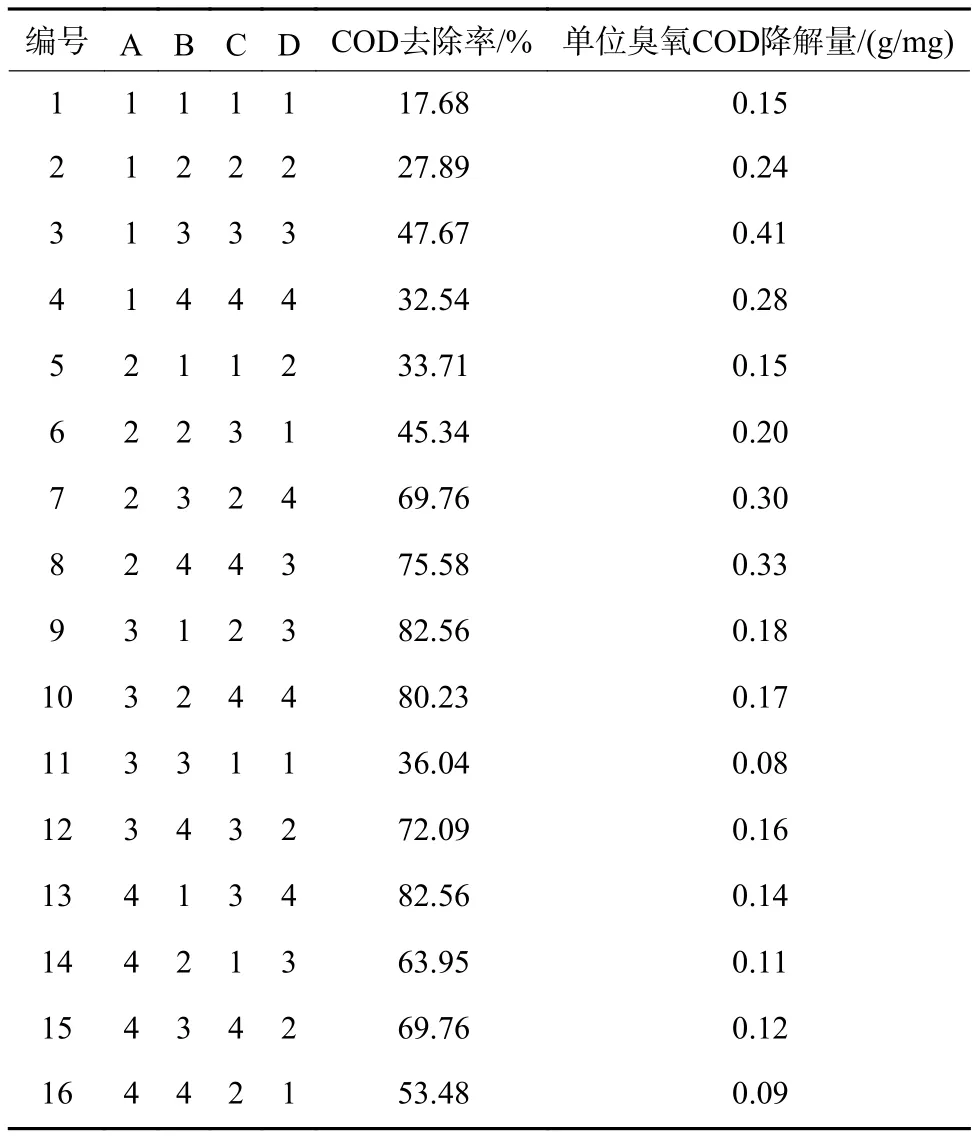
表 2 正交试验设计及试验结果Table 2 Orthogonal experimental design and experimental results
通过极差分析[15]得到极差Ki和Zi(表 3),Ki和Zi表示任一列上水平i(i=1,2,...,4)所对应的试验结果之和,ki及zi表示各极差均值。绘制COD去除率、单位臭氧COD降解量正交试验效应曲线图(图3),各因素水平最高值组合为优化后的反应条件。从图3可以看出,COD去除率优化后的条件为A3B4C3D3,即臭氧投加量为10 mg/(L·min),催化剂投加量为0.50 g/L,pH为9,反应时间为 45 min。单位臭氧COD降解量优化后条件为A1B3C3D3,即臭氧投加量为 3 mg/(L·min),催化剂投加量为 0.10 g/L,pH 为 9,反应时间为45 min。根据各因素的方差Ri得到2种考察指标权重顺序分别为A>D>C>B和A>D>B>C。
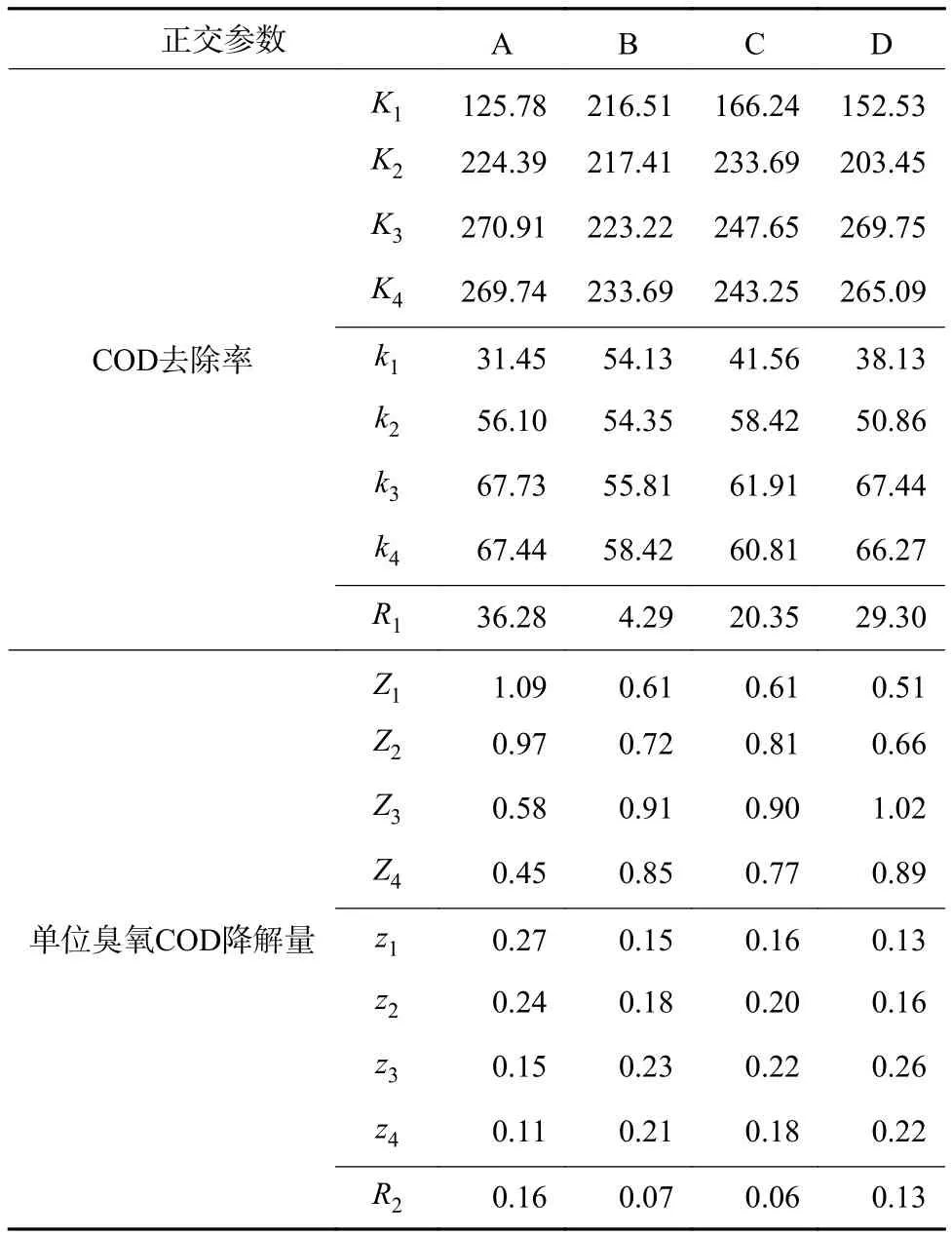
表 3 正交试验方差分析Table 3 Orthogonal test variance analysis
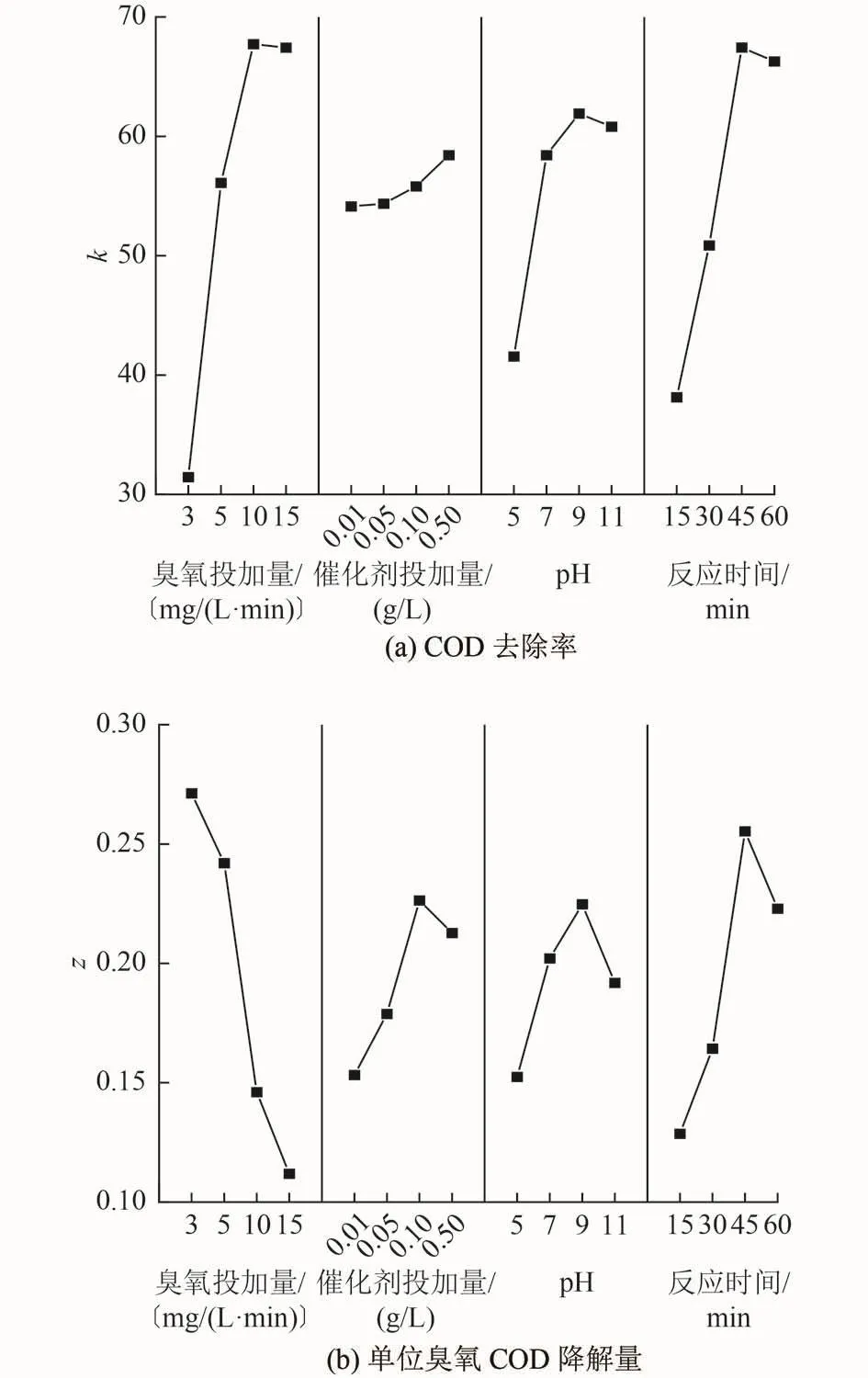
图 3 COD去除率和单位臭氧COD降解量正交试验效应曲线Fig.3 Orthogonal test effect curve of COD removal rate and COD degradation per unit ozone
2.3 权重矩阵计算
实际应用时,需同时考虑污染物去除效果和臭氧利用情况,因此需讨论各因素对COD去除率和单位臭氧COD降解量2项指标的共同影响。采用矩阵分析法[16-17],分别计算出影响试验结果的各因素各水平的权重,将权重矩阵取均值后,通过权重大小确定各因素优化组合及对指标影响的主次关系。对COD去除率采用矩阵分析法,其权重矩阵(ω1)的计算过程如下:

式中:M1为权重矩阵的标层矩阵;T1为权重矩阵的因素层矩阵;S1为权重矩阵的水平层矩阵。


使用相同方法计算单位臭氧COD降解量的权重矩阵(ω2):
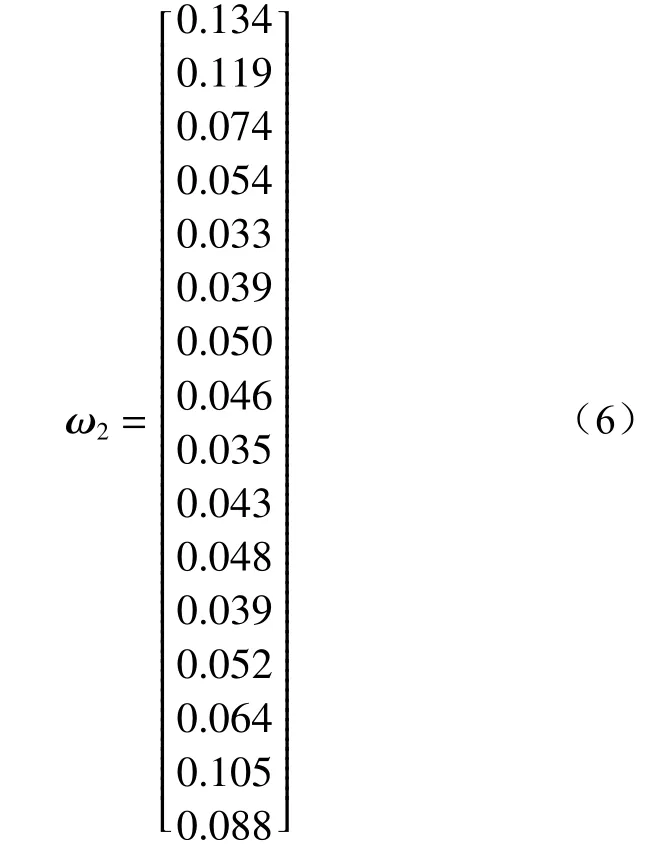
总权重矩阵(ω)由式(7)计算得出。将各因素权重加和后,可得到综合2项指标的各因素影响的主次顺序,即 A(0.391)>D(0.317)>C(0.191)>B(0.107)。各因素取最高权重得到优化后的试验组合,即A2B3C3D3,此时的臭氧投加量为 5 mg/(L·min),催化剂投加量为0.05 g/L,pH为9,反应时间为45 min。

2.4 方差分析
为避免上述试验误差,检验正交试验结果的真实性,进一步采用方差分析法考察各影响因素的显著性水平[18-19],结果见表4。COD去除率与单位臭氧COD 降解量显著性依次为A>C>D>B、A>D>B>C。臭氧投加量与反应时间对2项指标同时表现出显著的影响,而催化剂投加量对COD去除率影响不显著,pH对单位臭氧COD降解量影响不显著。
2.5 验证试验
根据2.4节的结论,臭氧投加量、催化剂投加量、反应时间、pH对催化氧化过程产生了不同程度的影响,通过单因素试验考察4个变量对废水处理过程的实际影响情况。
以B3C3D3为条件参数,控制臭氧投加量(A)作为单一变量进行试验,结果如图4所示。从图4可以看出,COD去除率随臭氧投加量增大而提高。臭氧投加量为5和10 mg/(L·min)条件下,均在反应45 min达到平衡,而臭氧投加量为15 mg/(L·min)时仅提前了5 min,且COD去除效果相差不大,均达到97%以上,远高于臭氧投加量为3 mg/(L·min)时。单位臭氧COD降解量与臭氧投加量呈负相关,最低臭氧投加量水平即达到单位臭氧COD降解量最高值(0.62 g/mg),高于最低值 233%。
以催化剂投加量(B)为单一变量,以A2C3D3作为条件参数进行试验,结果如图5所示。从图5可以看出,催化剂投加量的增加对COD去除率的影响并不明显。单位臭氧COD降解量在催化剂投加量为0.10 g/L时达到最高,为0.55 g/mg;催化剂投加量为0.05与0.50 g/L时表现持平;最低投加量较其他水平有一定差距,单位臭氧COD降解量为最高值的94.4%。这可能是由于·OH的存在时间短(约为10-9s),催化剂的增加并未明显提高参与反应的·OH水平[20],一部分·OH未被有效利用;另一方面,随着催化剂投加量的增加,反应位点和表面积增加[21],将获得更高的催化臭氧表观反应速率常数。然而,考虑到初始污染物浓度恒定,过量的催化剂会降低单位面积污染物和臭氧的浓度,从而降低催化效率[22]。因此,催化剂投加量的增加与污染物的去除效果不一定呈正相关。Wang等[9]通过制备的纳米MgO催化臭氧氧化苯酚时得出了相似的结论,催化剂投加量为40、60、80 mg/L时的苯酚去除率近乎相同。
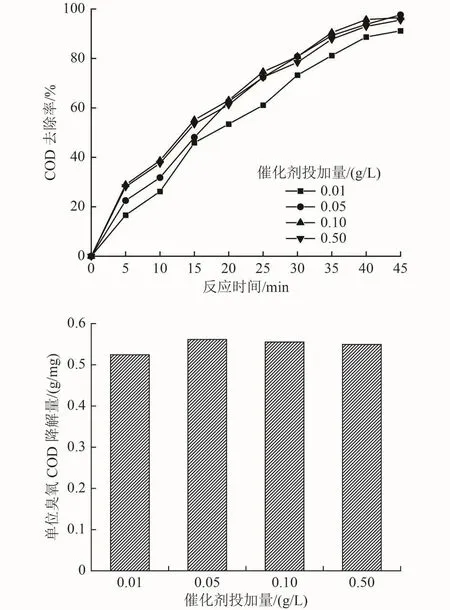
图 5 催化剂投加量对2项指标影响Fig.5 Impact of catalyst dosage on two indicators
控制初始pH(C)作为唯一变量,以A2B3D3作为条件参数进行试验,结果如图6所示。从图6可以看出,2项指标水平随pH的改变表现了相似的规律,pH为9时表现了最佳的COD去除率及单位臭氧COD降解量。Wang等[23]认为弱碱性介质环境有助于臭氧的自分解,促进·OH的生成;另一方面,可能是由于此时介质pH更接近α-Fe2O3零点点位,中性带电表面表现了更强的臭氧催化活性[24],有利于催化氧化过程的进行,同时保证了较高的臭氧利用情况。
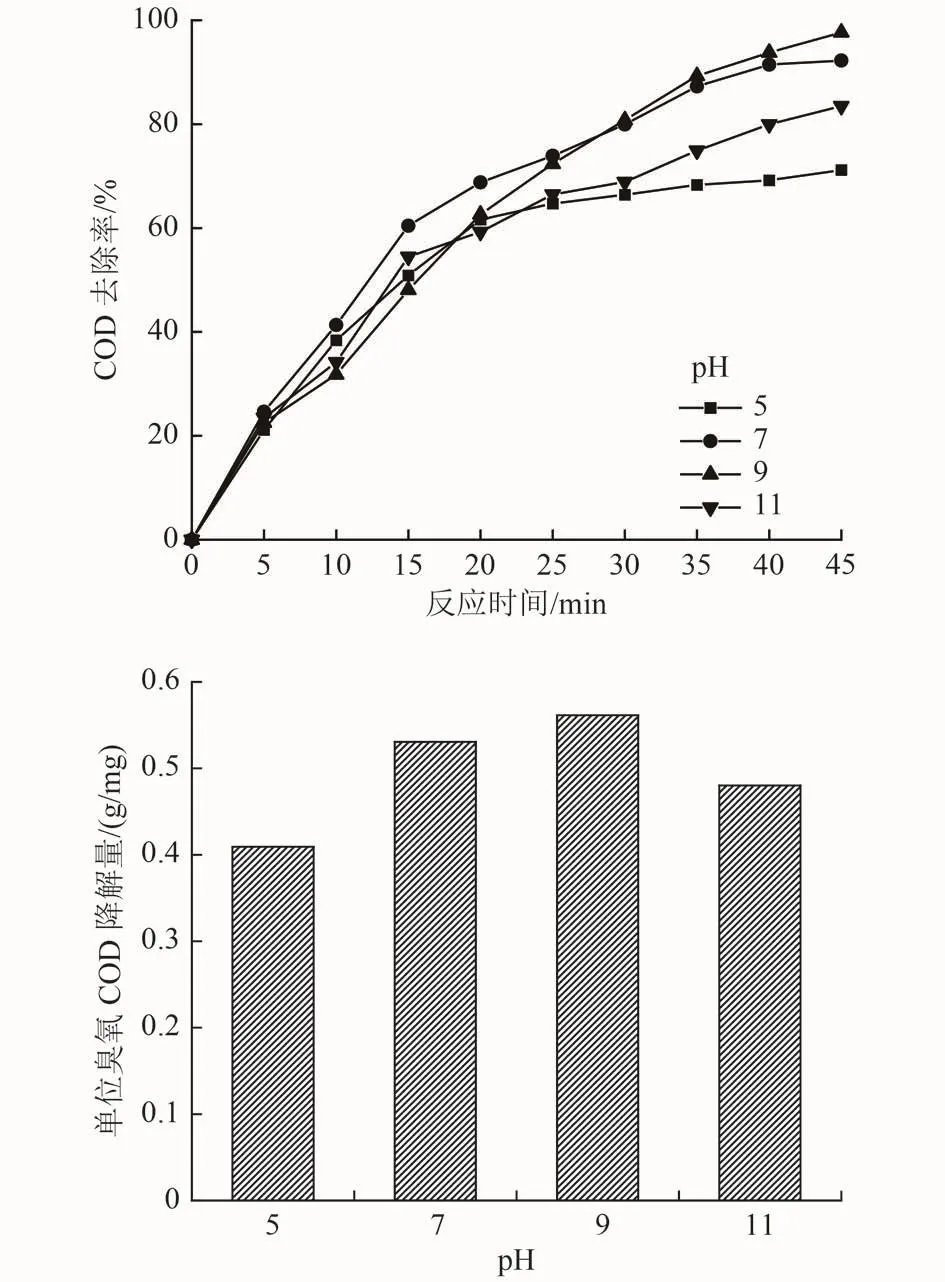
图 6 pH对2项指标影响Fig.6 Influence of pH on two indicators
上述试验结论与2.4节中各因素对指标影响程度相同,臭氧投加量与反应时间对2项指标均有重要意义,应在实际工程中着重考虑,催化剂能有效促进自由基的生成和污染物的降解,但其投加量水平的改变并未明显影响COD的去除效果,且pH的变化对单位臭氧COD降解量影响程度较小。
以优化后的过程参数(A2B3C3D3)为反应条件进行试验,催化氧化体系在3次试验中的平均COD去除率与单位臭氧COD降解量分别达到了97.31%和0.56 g/mg(表5),2项指标均达到了较高水平。
2.6 催化机理
单独臭氧对难降解有机物的直接反应具有选择性,难以将其完全氧化[25]。臭氧在催化剂作用下极易分解,促进产生活性氧自由基(ROS)[26]。ROS中的·OH(2.85 eV)具有高氧化电位,是催化氧化过程中重要的氧化剂,可使臭氧难以破坏的有机分子结构完全矿化,提高污染物的去除效果与臭氧利用率[27-28]。叔丁醇(TBA)是常见的·OH屏蔽剂,反应常数为 6×108L/(mol·s),通过在反应中投加 TBA 可考察·OH对污染物去除的贡献情况[29]。臭氧投加量为5 mg/(L·min),催化剂投加量为 0.10 g/L,pH 为 9,TBA投加量为50 mg/L时,苯酚废水COD去除效果见图7(a)。从图7(a)可以看出,投加TBA的催化氧化过程较只投加臭氧与投加臭氧和催化剂2种情况对COD去除率具有显著优势,反应45 min达到平衡,最大COD去除率为97.64%。单独投加臭氧对COD去除率最低。表明臭氧在α-Fe2O3催化作用下产生的·OH显著增强了氧化效果,COD去除率提升了25%以上。
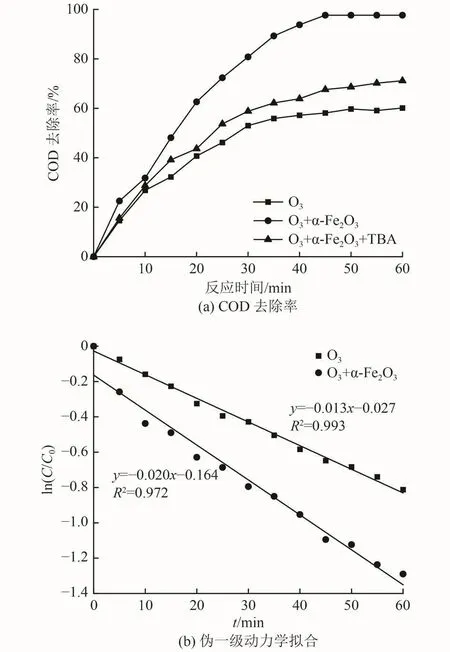
图 7 臭氧氧化技术处理苯酚废水的降解过程Fig.7 Degradation process of phenol wastewater by ozone oxidation
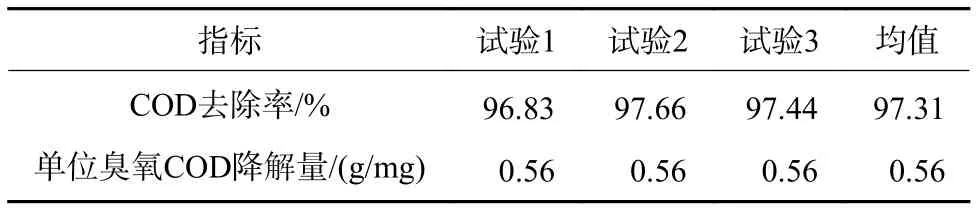
表 5 优化参数条件下试验结果Table 5 Experimental results under optimized parameters
臭氧的快速分解可促进其充分转化为·OH[30],进而提高臭氧利用率。为进一步评估α-Fe2O3对臭氧分解的促进效果,比较了单独臭氧体系与催化氧化体系的臭氧分解伪一级动力学拟合情况,结果如图7(b)所示。从图7(b)可以看出,拟合R2均大于0.97,2种体系的表观反应速率常数分别为0.013和0.020 s-1,催化剂的加入显著提高了臭氧的分解速率。
3 结论
(1)以臭氧投加量(A)、催化剂投加量(B)、pH(C)、反应时间(D)为试验的主要影响因素,设计了基于L16(44)的苯酚废水α-Fe2O3催化臭氧氧化正交试验。极差分析表明,各影响因素对COD去除率与单位臭氧COD降解量的影响权重分别为A>D>C>B和 A>D>B>C。
(2)方差分析表明,臭氧投加量与反应时间对催化氧化过程影响显著,以臭氧投加量为单一变量的试验中,COD去除率与单位臭氧COD降解量2项指标最大值较最小值分别提高了50.49%和232.73%。
(3)通过权重矩阵计算,得到同时考察COD去除率与单位臭氧COD降解量时优化后的反应条件:臭氧投加量为5 mg/(L·min),催化剂投加量为0.10 g/L,pH为9,反应时间为45 min。综合影响权重为A(0.391 5)>D(0.317 1)>C(0.195 0)>B(0.107 2),在工程应用中应着重考虑臭氧投加量与反应时间的控制。
(4)以优化后的反应条件进行试验时,COD去除率与单位臭氧COD降解量2项指标均表现了较高水平,分别为97.31%和0.56 g/mg。催化机理试验表明,·OH是提高污染物去除效果与臭氧利用率的主要原因。
