基于微生物生物完整性指数的北京市城市河道生态系统健康评价
2022-09-27董婧卢少奇伍娟丽王子康王恒嘉徐菲
董婧,卢少奇,伍娟丽,王子康,王恒嘉,徐菲
1.北京市环境保护科学研究院
2.国家城市环境污染控制工程技术研究中心
3.首都师范大学
河流生态系统涵盖饮用水、灌溉用水、景观用水、养殖用水等与人类生活密切相关的多种功能[1]。然而经济的快速发展及城市人口的增长,使河流生态系统遭受到一定的破坏,导致河流生态环境退化,敏感物种减少,甚至制约当地经济的发展[2]。开展河流生态系统健康评价体系研究,选取有效的指标和科学的方法对河流生态系统健康状况进行准确诊断,进而开展可持续利用与管理,对于促进河流生态系统健康发展具有重大意义[3]。
目前,关于水体生态系统健康评价的研究已有很多,采用的评价方法也不尽相同。其中,应用较多的方法为生物完整性指数( index of biotic integrity,IBI)。IBI评价法是基于多种参数来完成的,通过生物群落组成结构反映生态系统的健康情况。该方法通过建立环境因子与生物参数的定量关系,筛选对环境因子敏感的生物参数,基于比较参数值与系统标准值对生态系统的健康状况进行评价[4]。
美国学者Karr等[4]在1981年基于鱼类群落对IBI体系进行了构建,并对河流健康状况进行了评价。国内对IBI的研究相对稍晚,20世纪90年代,王备新[5]以底栖动物构建了IBI体系,对黄山地区的溪流进行了健康评价。经过众多学者对IBI的应用和研究,目前IBI已广泛应用于水体生态系统健康评价中[6]。
生产者、消费者与分解者的存在组成了完整的水体生态系统。在目前的大多数研究中,对生产者与消费者的关注度较高,虽然分解者也是生态系统的重要组成部分,但其在构建IBI时却往往被忽略[7]。水体中的分解者主要由微生物构成,同时微生物也是整个生态系统中数量最多的物种[8]。微生物处于食物网的基础营养级,对生态系统的反应速度往往高于生产者与消费者,因此在生态系统健康状况发生改变时,微生物的指示要早于处于较高营养级的生产者与消费者[9]。另外,随着污染程度的加深,生产者与消费者的数量往往会大幅衰减,从而影响了采集样品的丰富度,导致无法以生产者与消费者作为合适的生物指标。而分解者则不受此影响,在受污染的水体中,以微生物为主体的分解者往往会更加活跃,群落结构也具有相当的丰富性。因此,以分解者——微生物群落作为主要对象构建IBI指数体系用于评估水体生态系统健康是值得关注的重要研究方向[10]。Kondratieff等[11]研究发现,微生物种群结构会明显受到人类活动的影响,远离工业源和人为源的地区以自养微生物为主,人类活动和工业源较多地区异养微生物显著增加。Garrido等[12]对比了地下水和污水处理厂二级、三级出水微生物种群结构,结果表明,拟杆菌门、γ-变形杆菌门、硝化螺旋门相对丰度与β-变形菌门相对丰度之比存在显著差别。因此,微生物可以作为指示生物对河流健康状况起到指示和预警作用。Lau等[13]应用细菌群落结构指数(bacterial community index,BCI),成功评价了溪流生态健康情况。安新丽等[14-17]通过Illumina高通量测序技术,构建了微生物的生物完整性指数(microbial index of biotic integrity,M-IBI)的指标体系,并将其成功应用于地下水、湿地、城市河流的健康状况评价中。
中国北方城市多为缺水城市,城市河道大多以城镇再生水厂出水为补水,不同于自然水补水的河道,以再生水补水的河道往往受人为干扰较大。尽管再生水的常规水质指标与天然水体无明显差别,但以再生水补水的河道的生态系统较天然水体补水的河道显著不同。城市河道受人为干扰较大,其健康状况通常会成为制约城市发展的重要因素。因此探求城市河道的生态健康状况,并采用准确有效的方法对其进行评价,对城市河道管理具有重要意义。笔者以北京市4条河流为研究对象,设置15个代表性采样点,分析其微生物群落结构和水环境理化因子特征,比较微生物群落结构的差异性;以微生物为指示生物,运用M-IBI评价体系对4条河流进行生态系统健康评价,以期为北京市河流生态系统健康维护与管理提供支撑,同时为其他地区河流生态系统健康评价提供参考。
1 研究区与研究方法
1.1 研究区概况与采样点设置
选取北京市4条具有代表性的城市河道作为研究对象。其中,永定河以自然水体为河道补给水源,经门头沟区、石景山区、丰台区、房山区、大兴区,自大兴区崔指挥营村东出市境域。在永定河设置2个采样点(YDH1、YDH2)。清河、凉水河、大龙河3条城市河道以再生水厂出水作为补给水源,自西向东流经人类活动密集的城区。清河从北京市海淀区颐和园西北角的安河闸起〔北长河(京密引水渠)与北旱河汇合处〕向东北流,经肖家河、朱房村、清河、河北村、立水桥、沈家村、沙子营后,在立水桥以东入温榆河。在清河设置4个采样点(QH1、QH2、QH3、QH4)。凉水河流经石景山、丰台、朝阳、大兴、通州等区,于榆林庄闸上游汇入北运河。在凉水河设置5 个采样点(LSH1、LSH2、LSH3、LSH4、LSH5)。大龙河为北京市境内的河流,起自黄村南铁道口闸,从西北向东南流经大兴县的4个乡镇,至白塔村东与小龙河汇合。在大龙河设置4个采样点(DLH1、DLH2、DLH3、DLH4)。河流采样点如图 1所示。
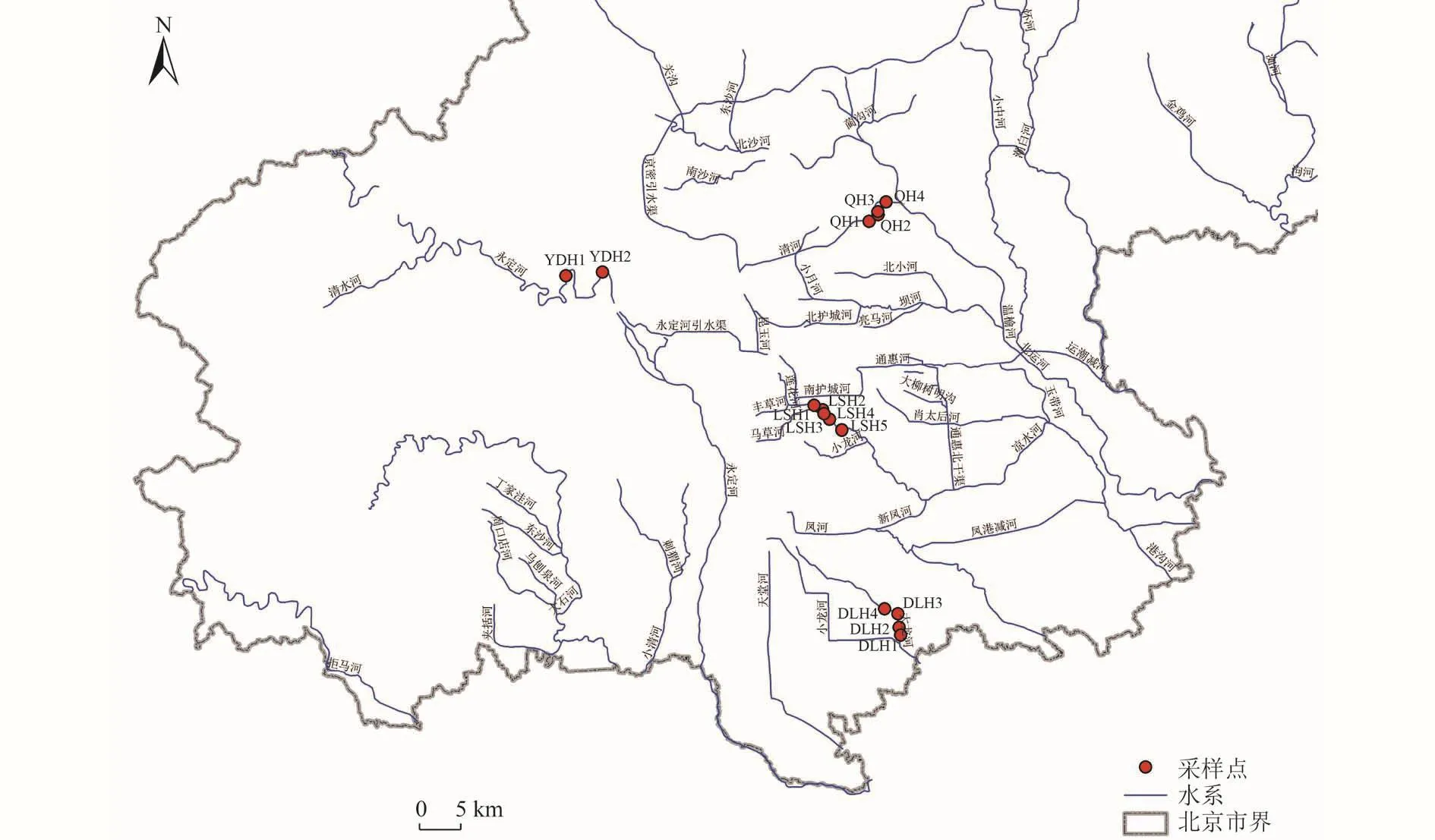
图 1 4条城市河道采样点位置Fig.1 Location of 4 urban river sampling points
1.2 样品采集与分析
1.2.1 样本采集和水质分析
于2020年9月—2021年3月进行样品的采集。每个点位各采样3次(冬季有的河道结冰未采样)。水样和沉积物样品的采集与分析参照《水与废水监测分析方法》[18]进行,同时测定化学需氧量(CODCr)、总磷(TP)、石油类、氨氮(NH3-N)、溶解氧(DO)、生化需氧量(BOD5)、总氮(TN)、As、pH等指标。
1.2.2 DNA 抽提和 PCR 扩增
根据FastDNA® Spin Kit for Soil (MP Biomedicals,美国)说明书进行微生物群落总DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA浓度和纯度;使用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和 806R (5’-GGACTACHVGGGTWTCTAAT-3’)对 16S rRNA 基因V3~V4 可变区进行PCR扩增,扩增程序如下:95℃ 预变性 3 min,27 个循环(95 ℃ 变性 30 s,55 ℃退火 30 s, 72 ℃延伸 30 s),然后 72 ℃稳定延伸 10 min,最后在 4 ℃ 进行保存(PCR 仪:ABI GeneAmp®9700 型)。PCR 反应体系:5×TransStart FastPfu缓冲液 4 μL,2.5 mmol/L dNTPs 2 μL,上游引物(5 μmol/L)0.8 μL , 下 游 引 物 (5 μmol/L )0.8 μL ,TransStart FastPfu DNA 聚合酶 0.4 μL,模板 DNA 10 ng,补足至20 μL。每个样本3个重复,取平均值。
1.2.3 Illumina Miseq测序
将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, 美国)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus™Fluorometer (Promega, 美国) 对回收产物进行检测定量。使用NEXTFLEX Rapid DNA-Seq Kit进行建库:1)接头链接;2)使用磁珠筛选去除接头自连片段;3)利用PCR扩增进行文库模板的富集;4)磁珠回收PCR产物得到最终的文库。利用Illumina公司的Miseq PE300平台进行测序。
1.2.4 数据处理
使用Fastp(version 0.20.0)软件对原始测序序列进行质控,使用Flash(version 1.2.7)软件进行拼接:1)过滤序列(reads)尾部质量20 bp以下的碱基,设置50 bp的窗口,如果窗口内的平均质量低于20 bp,从窗口开始截去后端碱基,过滤质控后50 bp以下的序列(reads),去除含氮碱基的序列(reads);2)根据PE 序列之间的重叠(overlap)关系,将成对序列拼接(merge)成 1 条序列,最小重叠(overlap)长度为 10 bp;3)拼接序列的重叠区允许的最大错配比率为0.2,筛选不符合序列;4)根据序列首尾两端的标签序列(barcode)和引物区分样品,并调整序列方标签序列(barcode)允许的错配数为0,最大引物错配数为2。
使用UPARSE(version 7.1)软件根据97%的相似度对序列进行OTU聚类并剔除嵌合体。利用RDP classifier (version 2.2)软件对每条序列进行物种分类注释,比对Silva 16S rRNA数据库,设置比对阈值为70%。
1.3 M-IBI 评价体系的构建
1.3.1 参考点与污染点的区分
基于GB 3838—2002《地表水环境质量标准》对水样TP、石油类、NH3-N、DO、CODCr、BOD5、TN、As、pH这9项因子进行赋分,即达到Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ类水质标准,分别记为5、4、3、2、1分,未达Ⅴ类水质标准,计为0分,对各指标求平均值即可得到该采样点水质总得分。水质总得分大于90%分位数的采样点为参考点,其他采样点为受人类影响较大的干扰位点。其中,水质总得分小于10%分位数的采样点为高度受干扰位点,10%~90%分位数的采样点为中度受干扰位点[19]。
1.3.2 备选指标的确定与筛选
选取与微生物群落丰富度、结构、组成和功能相关的参数作为计算M-IBI的备选指标。其中,与群落组成相关的参数选择主要涉及优势种分布及与水质变化密切相关的微生物组成;与功能相关的微生物主要包括致病菌、污染物降解菌和参与营养物质代谢循环的菌属。通过RDA分析筛选关键的环境因子,利用加权平均回归的方法计算各分类单元的最适值,运算方法参照文献[1]。通过采用典型相关分析和Spearman相关性分析,明确显著影响河道微生物群落组成的水质指标及其与各类微生物间的相关系数和显著性。其中,与关键水质指标显著相关的微生物组成可作为备选指标。参照文献[20-24]对备选指标进行干扰反应、判别能力分析和相关性分析,筛选出用以计算M-IBI的生物参数指标。其中,判别能力分析对备选指标进行Pearson相关性分析,若2个指标的相关性系数(R)≥0.70,表明二者所反映的信息重叠性较大,选择其中之一用于构建MIBI评价体系。
1.3.3 M-IBI的计分及评价标准
采用比值法计算M-IBI。其中,对随干扰增大而减小的指标,各指标的分值等于指标值除以所有采样点的95%分位数;对随干扰增大而增大的指标,以所有采样点的5%分位数为最佳期望值进行计算。计算方法:(最大值-指标值)/(最大值-5%分位数)。该方法规定,经计算后的分值分布为0~1,若大于1,则记为1。以参考点IBI的95%分位数作为健康评价的最佳值,低于该值的分布范围进行五等分,靠近95%分位数的一等分代表被测样点处于健康状态,随后依次是亚健康、一般、较差和极差的划分标准。
2 结果与分析
2.1 关键因子的确认
研究区各采样点微生物信息通过高通量测序进行分析,共获得 986 148条序列,选择Shannon、Simpson、Ace、Chao、Coverage和PD 多样性指数进行分析,各采样点微生物多样性指数分析结果如表1所示。Shannon、Simpson和PD指数反映群落多样性,Ace和Chao指数反映群落丰富度,Coverage指数反映群落覆盖度。由表1可知,永定河的Shannon、Ace、Chao、Coverage和PD多样性指数与清河、凉水河和大龙河存在显著差异。
各河道采样点主要水质指标测定及得分计算结果如表2所示。15个采样点的水质总得分为3.22~4.22,50%和95%分位数分别为3.56和4.00。因此,水质总得分大于4.00的采样点(YDH1、YDH2)为低干扰点,即参考点;水质总得分为3.56~4.00和小于3.56的采样点分别为中等(9个)和较高(3个)干扰强度点,均为污染点。

表 1 4条城市河道各采样点水体微生物多样性指数Table 1 Microbial diversity index of water bodies at sampling points of four urban rivers

表 2 4 条城市河道各采样点主要水质参数及其得分Table 2 Main chemical and physical properties and scores at sampling point of four urban rivers
采用RDA分析微生物群落结构变化与水质指标间的关系,结果如图2所示。由图2可知,TN、TP、NH3-N、NO3-N和NO2-N与微生物群落分布具有显著相关关系(P<0.05)。氮和磷浓度均是影响微生物群落结构的重要因素,不同微生物对氮和磷的耐受程度存在差别。
分析存在显著相关性的水质指标(TN、TP、NH3-N、NO3-N和NO2-N)与微生物群落之间的Spearman相关性,结果如图3所示。由图3可知,放线菌门(Actinobacteriota)的相对丰度与TP、NO3-N和NO2-N浓度呈负相关,Patescibateria(新物种)的相对丰度与NH3-N和NO2-N浓度呈负相关,Acidobacteriota的相对丰度与TP、NO2-N浓度呈正相关,绿弯菌门(Chloroflexi)的相对丰度与NO3-N浓度呈正相关,Bacteroidota的相对丰度与NH3-N浓度呈正相关,蓝藻门(Cyanobacteria)的相对丰度与NO3-N浓度呈正相关,Proteobacteria的相对丰度与TP浓度呈负相关,与NH3-N浓度呈正相关,厚壁菌门(Firmicutes)的相对丰度与NH3-N浓度呈正相关,脱硫杆菌门(Desulfobacterota)的相对丰度与NH3-N浓度呈正相关。因此,将这些与主要水质指标呈显著相关性的微生物组成纳入后续评价的备选指标中。

图 2 各采样点微生物门水平群落结构与环境因子相关的RDA分析Fig.2 Redundancy analysis (RDA) of microbial community structure and environmental factors

图 3 微生物门水平组成(相对丰度排名前10)与水质指标的Spearman相关性分析结果Fig.3 Spearman correlation analysis between microbial community phylum composition (top10) and water quality index
2.2 备选指标的筛选
选用可以反映河道微生物群落多样性、结构和功能,同时可反映水质变化的相关微生物组成作为河道M-IBI的备选指标,共确立15个备选指标(表3)。
通过对15个备选指标进行判别能力分析,筛选出Shannon指数、Bacteroidota相对丰度、Chloroflexi相对丰度、Cyanobacteria相对丰度、CODCr耐受属相对丰度和NH3-N清洁属相对丰度6个指标进行Pearson相关性分析,结果发现,6个指标的|R|<0.75(表4),说明指标之间差异性显著,并且具有统计学意义。因此,可以将这6个指标用于M-IBI评价体系的计算。

表 3 M-IBI 备选指标描述及对干扰的反应Table 3 Description of candidate metrics for M-IBI and their direction of response to disturbance
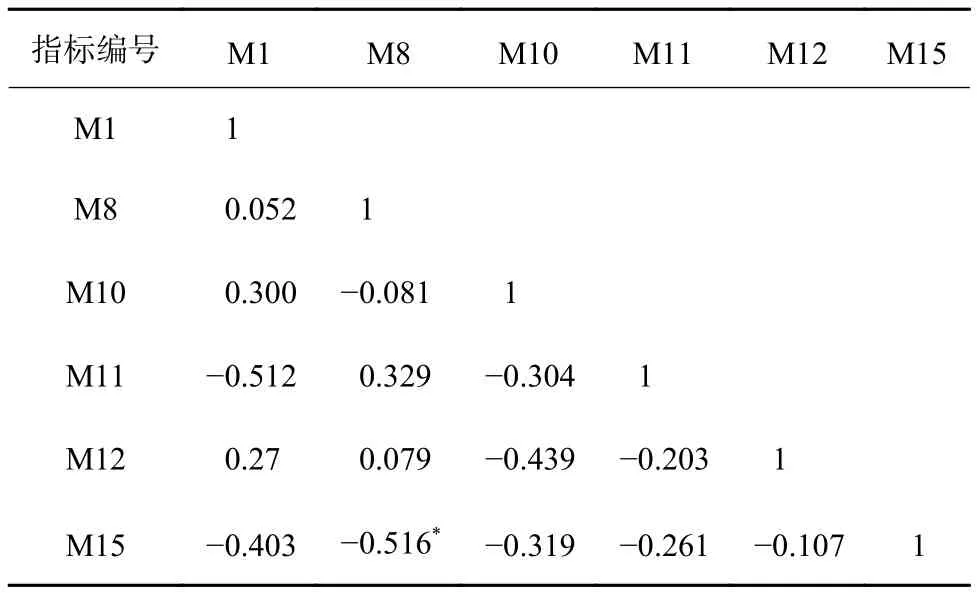
表 4 M-IBI指标的Pearson相关性分析结果Table 4 Pearson's correlation analysis results of M-IBI index
2.3 M-IBI指标体系评价及评价结果
将筛选出的指标采用比值法计算各指标分值(表5),确定比值法的M-IBI指标体系评价标准(表6),进而得出所有采样点M-IBI评分及健康评价结果(表7)。结果表明:根据水质得分选定的YDH1、YDH2 2个参考点均为健康状态;清河有2个采样点为健康,2个采样点为亚健康;凉水河有2个采样点为健康,2个采样点为亚健康,1个采样点为一般;大龙河有3个采样点为亚健康,1个采样点为一般。评价结果为一般的采样点处于凉水河和大龙河中段区域,位于城市地区,受人为活动干扰较大,尽管其水质条件较其他采样点无本质区别,但生境条件和生态系统健康水平状况较其他采样点略差。

表 5 6个M-IBI指标在各采样点的分布及其生物指数计算公式Table 5 Distribution of six M-IBI indexes at all sampling points and formulas for calculating biological index
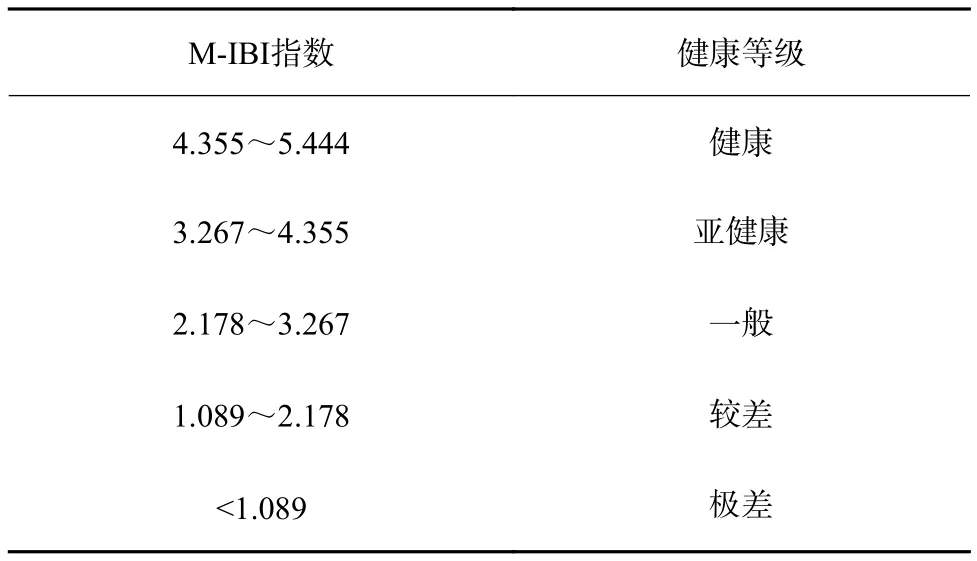
表 6 基于 M-IBI 指数的城市河道生态系统健康评价标准Table 6 Urban river ecosystem health assessment criteria based on M-IBI index

表 7 各采样点M-IBI评价结果Table 7 M-IBI evaluation results of each sampling point
3 讨论
3.1 M-IBI评价结果的可行性
本研究通过Illumina高通量测序计算获得河道中微生物的信息,使用M-IBI对河道健康状况进行分析,评价结果基本符合现实河道水体生境状态,即以自然水体为补水的城市河道健康程度较高,而以再生水为补水的城市河道大多处于亚健康水平,说明M-IBI可以有效区分不同河道的生态健康情况。何晨凤[24]分别利用微生物和浮游植物评价湖泊生态系统健康状况,发现2种评价结果整体变化趋势一致,但小范围内存在一定差异,其原因为2种评价方法的采样点不完全一致,同时由于环境因子的解释度较低,需要获取更多对微生物群落结构产生重要影响的环境因子信息。朱文婷等[16]利用M-IBI评价苏州市湿地健康水平,其评价的有效性也综合考虑了主要环境因子、土地利用方式及河道类型等的响应,并开展了相应的验证,说明M-IBI可以反映湿地水生态系统的状况。安新丽等[14]应用M-IBI对尾矿库周边地下水生态系统进行评价,评价结果可较好地区分不同采样点的水质优劣状况。尽管M-IBI已经被应用于河流、湖泊、地下水等健康状况的评估,但由于研究尚不够完善,相关的环境因子和微生物候选指标的选择需要进一步标准化。
3.2 微生物作为指示生物的潜力
城市河道生态系统与自然水体生态系统存在显著区别,尤其是以再生水为补水的城市河道。尽管大型城镇再生水厂出水CODCr、NH3-N等指标与自然水体并没有显著差异,但河道中微生物种类却显著不同,以M-IBI比对城市河道和自然水体,可以综合评估水质和生物对水体生态系统健康的影响,同时可以筛选出典型污染的耐受种和敏感种,其在水生态系统中的丰度对水体条件有着良好的指示作用。
通过对CODCr、NH3-N、TP等主要指标耐受种和敏感种的筛选分析发现,Modulibacteria被评定为NH3-N耐受种,其仅存在于健康状态一般的采样点,而在其余采样点的相对丰度均为0;Fibrobacterota也被评定为NH3-N耐受种,其在参考点永定河中相对丰度为0,在凉水河和大龙河中沿程相对丰度逐渐增加,在健康状况为亚健康和一般的采样点相对丰度较高。这2个细菌门也被报道与黑臭水体中硝酸盐和NH3-N存在显著的相关性[25],因此有可能作为水体变差的指示物种。
4 结论
(1)构建了城市河道生态系统健康评价的MIBI指标体系,包括Shannon指数、Bacteroidota相对丰度、Chloroflexi相对丰度、Cyanobacteria相对丰度、CODCr耐受属相对丰度和NH3-N清洁属相对丰度6个指标,通过M-IBI指标体系对永定河、清河、大龙河、凉水河生态系统健康进行评价。结果表明,永定河2个采样点均为健康状态;清河4个采样点为健康至亚健康;凉水河5个采样点为健康至一般;大龙河4个采样点为亚健康至一般,无较差或极差的情况。
(2)永定河以自然水体作为补水,其生态系统处于健康状态;凉水河、清河、大龙河以再生水厂出水作为补水,大多数采样点处于亚健康状态。
(3)以微生物作为指示生物,应用IBI方法可以较好地评价城市河道生态系统健康情况,但由于微生物鉴定结果的局限性以及研究的区域性,其结果的适用性有待进一步调查和验证。
