两株海绵放线菌产生的抗菌活性产物研究
2022-09-27郭志凯王蓉吴炜城黎明何汪桂周石林
郭志凯,王蓉,吴炜城,黎明,何汪桂,,周石林,
1)海南省热带微生物资源重点实验室,中国热带农业科学院热带生物技术研究所,海南海口 571101;2)海南省热带农业生物资源保护与利用重点实验室,中国热带农业科学院海南热带农业资源研究院,海南海口 571101;3)海南省热带海水养殖技术重点实验室,海南省海洋与渔业科学院,海南海口 571126;4)海南热带海洋学院水产与生命学院,海南三亚572022
放线菌来源的天然产物作为农用抗生素(农药)发展迅速,已成为微生物源农药主体之一,如中生霉素、多抗霉素和阿维霉素等生物农药,已广泛应用于中国农作物病虫害防治,减少或替代了化学农药的使用,减缓了病虫抗药性,保护了生态环境.因此,放线菌来源的活性天然产物自然成为生物农药研发的目标[1-5].海洋放线菌是一类具有重要药用价值的微生物资源[6-9],它们广泛分布于各种海洋环境,其中,引人关注的是与海洋底栖生物共生的一类放线菌资源.许多海洋底栖生物通过瓶腔过滤海水中的营养物质生活.在长期进化过程中,海洋底栖生物与丰富多样的放线菌群形成了密切关系,放线菌可以提高宿主的适应性和生存能力,或产生抑制宿主竞争对手(如病原菌)的化学分子武器,故该类放线菌产生具有特殊结构和活性强的化学物质的几率要高于非共附生海洋微生物和陆地微生物[10-12].因此,挖掘海洋底栖生物共附生放线菌资源的药用潜力是当前海洋微生物研究的热点领域.
近年来,对中国南海海洋微生物活性产物的研究中,发现一些具有新颖结构的活性化合物[13-17].本课题组从中国海南西沙群岛采集的海洋生物样品中分离纯化获得许多放线菌,通过抗农业病原菌活性筛选,发现两株海绵来源的链霉菌菌株Streptomycessp.HMH1 和Streptomycessp.HML1 具有较强拮抗活性.本研究利用大米固体培养基对这两株活性菌株进行发酵,并对其发酵产物进行研究,鉴定代谢产物的化学结构,评价抗菌活性,以期为农业病害防治提供新化合物和菌种资源.
1 实验材料与方法
1.1 实验材料
1.1.1 仪器与试剂
实验所用仪器主要有:旋转蒸发仪N1300、真空控制器EYELA-NVC-3000 及冷却水循环装置CA-111 均购自埃朗科技国际贸易(上海)有限公司;Bruker Avance Ⅲ500 MHz 超导核磁共振波谱(nuclear magnetic resonance spectroscopy,NMR)仪购自德国Bruker公司;质谱仪(6210 TOF LC-MS)购自美国Agilent 公司,由该仪器采集高分辨电喷雾质谱(high resolution electrospray ionization mass spectroscopy,HR-ESI-MS)数据;高效液相色谱仪(1260型)购自美国Agilent 公司,配备分析型色谱柱(XBridge C18,150 mm × 2.1 mm,填料的粒径为3.5 μm);ZF-8型紫外仪购自上海嘉鹏科技有限公司;数控超声波清洁器KQ-500DE 购自东莞市科桥超声波设备有限公司;电恒温鼓风干燥箱购自上海跃进医疗器械有限公司;电子分析天平ME104T 购自瑞士Mettler Toledo集团;恒温摇床(ZQZY-CS8V)购自上海知楚仪器有限公司;分析型薄层层析硅胶板(GF254)和正相层析柱硅胶(硅胶粒径为45~75 μm)购自青岛海洋化工有限公司;Sephadex LH-20购自瑞典Pharmacia Biotech 公司.实验所用试剂主要有:十八烷基硅烷键含硅胶填料(octadecylsilyl,ODS)反相硅胶购自日本Nacalai Tesque 公司;色谱甲醇购自天津康科德科技有限公司;实验中其他试剂均为分析纯.
1.1.2 培养基
改良的国际链霉菌计划培养基2 号(internationalStreptomycesprojects medium 2,ISP2):麦芽浸粉10 g/L,酵母浸粉4 g/L,葡萄糖4 g/L,琼脂20 g/L,17.5 g/L人工海盐,pH值自然.改良的高氏1号液体培养基:KNO31.0 g/L,MgSO40.5 g/L,K2HPO40.5 g/L,NaCl 0.5 g/L,FeSO4·7H2O 0.01 g/L,可溶性淀粉20 g/L,17.5 g/L 人工海盐,自来水1 L,pH 值自然;大米发酵培养基:大米30 g,40 mL海水(NaCl质量分数为35 g/L).
1.1.3 实验菌株
放线菌菌株HMH1和HML1均从中国西沙群岛采集的海绵样品中分离纯化获得,通过16S 核糖体核糖核酸(ribosomal ribonucleic acid,rRNA)序列测定和基于局部比对算法的搜索工具(basic local alignment search tool,BLAST)比对,菌株HMH1 与菌株Streptomycessp.MCG2746 的16S rRNA 序列(GenBank 号为MN339818)的相似度为99.93%,菌株HML1 与菌株Streptomycessp.S1-SC17 的16S rRNA 序列(GenBank 号为KM677994)的相似度为99.93%.结合它们的形态学特征,均鉴定为链霉菌Streptomycessp..菌株Streptomycessp.HMH1 和Streptomycessp.HML1 的16S rRNA 序列在GenBank中的注册号分别为OL872209和OL872206,并保存于中国热带农业科学院热带生物技术研究所.
供试病原菌菌株:香蕉枯萎菌(Fusarium oxysporum,FOC4)、香蕉炭疽菌(Colletotrichum musae)、木瓜可可毛色二孢霉(Lasiodiplodia theobromae)、木瓜拟茎点霉(Phomopsis caricae-papayaeFetrak&Cif.)、辣椒棒孢霉(Corynespora cassiicola)、辣椒疫霉(Phytophthora capsica)、豇豆瓜果腐霉(Pythium aphanidermatum(Edson)Fitzp)、豇豆棒孢霉(Corynesporasp.)、小麦赤霉菌(Fusarium graminearum)、大丽轮枝菌(Verticillium dahlia)、椰枣小孢拟盘多毛孢(Pestalotiopsis microspore)、水稻白叶枯病菌(Xanthomonas oryzaepv.oryzae)和茄青枯劳尔氏菌(Ralstonia solanacearum)等病原菌均由中国热带农业科学院热带生物技术研究所保存.
1.2 实验方法
1.2.1 菌株的发酵
海洋链霉菌菌株Streptomycessp.HMH1 和Streptomycessp.HML1 分别经ISP2 固体培养基划线活化,28 ℃培养7 d后分别接种至装有100 mL液体高氏1号培养基的三角瓶(500 mL)中,于恒温摇床上振荡培养7 d(180 r/min,28 ℃).取10 mL的液体高氏1号培养基种子液接种到装有30 g大米的组培瓶中进行发酵,在28 ℃下静置培养30 d.
1.2.2 提取与分离纯化
发酵完成后,在大米固体发酵物中加入乙酸乙酯浸提3 遍.从链霉菌菌株Streptomycessp.HMH1的发酵产物中浓缩得到乙酸乙酯粗提物1.6 g,从链霉菌菌株Streptomycessp.HML1 的发酵产物中浓缩得到乙酸乙酯粗提物1.3 g.链霉菌菌株Strepto-mycessp.HMH1的乙酸乙酯粗提物经减压正相硅胶柱层析,采用氯仿-甲醇梯度洗脱(体积比依次为100∶0、100∶1、100∶2、100∶4、100∶8、100∶16、100∶32 和0∶100),经薄层层析分析,合并得到8 个组份,依次记作组份1(Fr.1)—8(Fr.8).组份Fr.4经ODS 反相硅胶柱层析(V(氯仿)∶V(甲醇)=100∶4)、Sephadex LH-20凝胶柱层析(甲醇为流动相)和硅胶柱层析(V(氯仿)∶V(甲醇)=50∶1)纯化,得到化合物1(282.4 mg)、化合物2(10.8 mg)和化合物3(5.1 mg).采用同样方法对链霉菌菌株Streptomycessp.HML1 的乙酸乙酯粗提物进行减压正相硅胶柱层析,采用氯仿-甲醇梯度洗脱得到8 个组份(Fr.1—Fr.8).将Fr.5进行十八烷基硅烷(ostade-cylsilane,ODS)反相硅胶柱层析(V(氯仿)∶V(甲醇)=100∶8)和反复Sephadex LH-20 凝胶柱层析,得到化合物4(3.2 mg).
1.2.3 化合物抗农业病原菌活性测试
化合物抗植物病原真菌活性测试方法:将化合物1 用二甲基亚砜(dimethyl sulfoxide,DMSO)配成质量浓度为20 mg/mL的样品溶液备用.在土豆琼脂培养基平板中央用无菌蓝枪头打孔(直径为7 mm),取20 μL 的化合物溶液注入孔中,然后在两侧距平板2 cm处各接种直径7 mm病原真菌块1块,以只接种病原真菌为对照组,28 ℃恒温培养10 d,每个处理重复3次,当只接种病原真菌的对照组菌长至平板中心位置,计算各时期抑菌率,以DMSO为阴性对照.

化合物抗植物病原细菌活性测试方法:溶菌肉汤(lysogeny broth,LB)液体培养基中加入病原细菌,于28 ℃、160 r/min 振荡培养24 h,吸取100 μL 病原菌液加入900 μL无菌水以1 × 10-1梯度稀释.吸取20 μL 梯度为1 × 10-2的菌液放置空培养皿中,倒入15 mL 温度适中且未凝固的LB 琼脂培养基,菌液与培养基充分混合,待平板内培养基完全凝固后,在平板中央用无菌蓝枪头打孔(直径为7 mm),在孔中滴加10 μL 化合物溶液,以DMSO 为阴性对照,28 ℃恒温培养2 d后,观察并测定抑菌圈大小.
2 实验结果
本研究从两株海绵放线菌Streptomycessp.HMH1 和HML1 的大米固体发酵产物中分离纯化得到3 个放线菌素类化合物和1 个吲哚咔唑生物碱类化合物,分别鉴定为放线菌素D(化合物1)、放线菌素X2(化合物2)、放线菌素Xoβ(化合物3)和K-252d(化合物4),如图1.抗菌活性筛选发现化合物1对多种农业病原真菌和病原细菌具有广谱的抗菌活性.
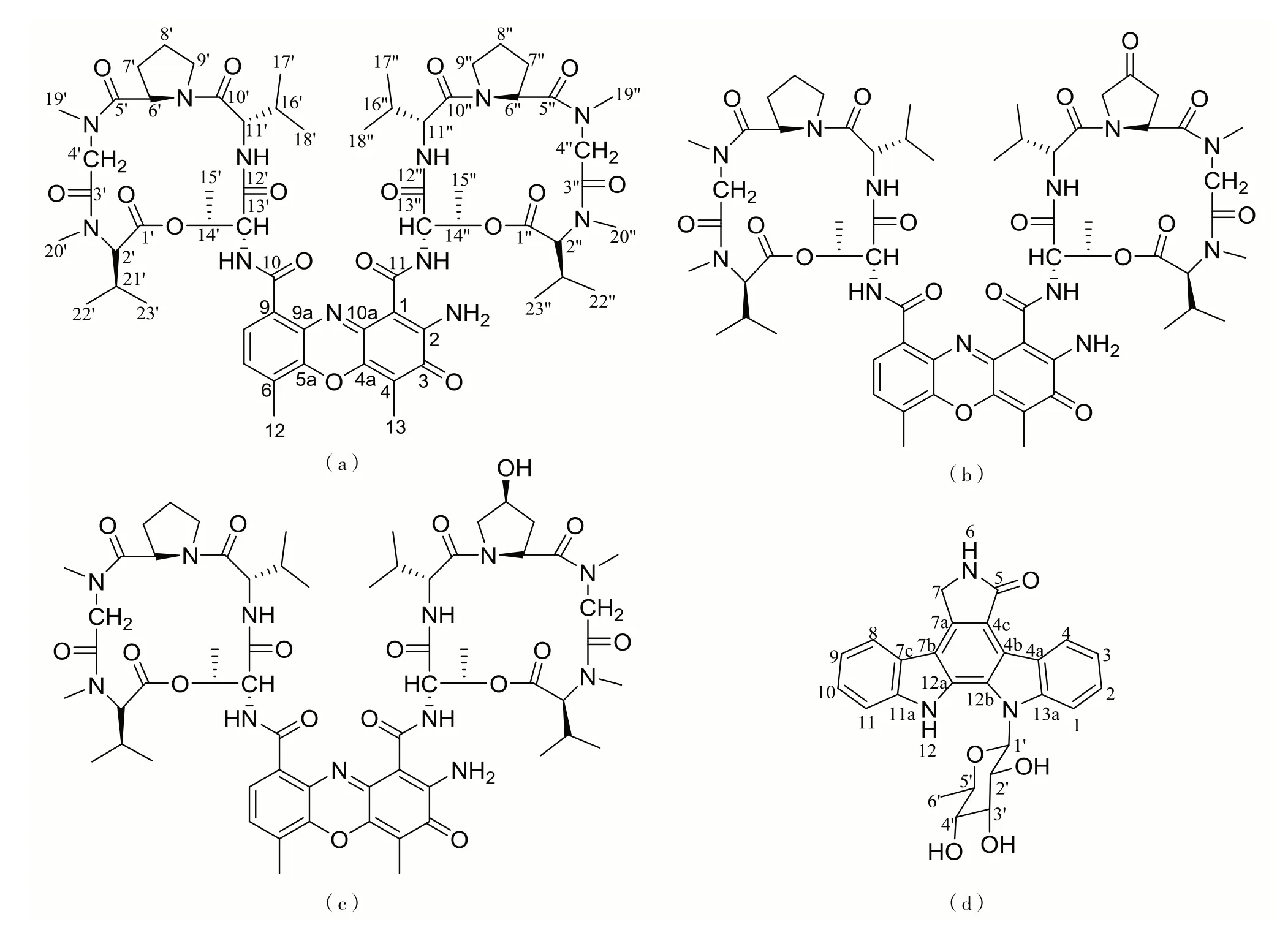
图1 分离出的几种化合物的化学结构式(a)放线菌素D;(b)放线菌素X2;(c)放线菌素Xoβ;(d)K-252dFig.1 The chemical structures of the isolated chemicals with(a)actinomycin D,(b)actinomycin X2,(c)actinomycin Xoβ,and(d)K-252d.
2.1 结构鉴定
化合物1 为红色粉末,分子式为C62H86N12O16,高分辨电喷雾质谱(high resoluation electrospray ionization mass spectrometry,HR-ESI-MS):质荷比(mass-to-charge ratio,m/z)为1 255.636 2[M +H]+.化合物1 的核磁共振(nuclear magnetic resonance,NMR)氢谱(1H-NMR)(500 MHz,CDCl3)的化学位移δ分别为7.36(1H,d,耦合常数J=7.7 Hz,H-7)、7.63(1H,d,J=7.7 Hz,H-8)、7.14(1H,d,J=6.8 Hz,NH-10)、7.74(1H,d,J=6.5 Hz,NH-11)、2.55(3H,s,H-12)、2.25(3H,s,H-13)、2.67(1H,m,H-2′)、4.80(1H,d,J=17.5 Hz,H-4′a)、3.61(1H,d,J=17.5 Hz,H-4′b)、6.01(1H,d,J=9.1 Hz,H-6′)、2.67(1H,m,H-7′a)、1.87(1H,m,H-7′b)、2.27(1H,m,H-8′a)、2.09(1H,m,H-8′b)、3.73(2H,m,H-9′)、3.53(1H,m,H-11′)、8.18(1H,d,J=6.0 Hz,NH-11′)、4.62(1H,dd,J分别为6.4 Hz 和2.3 Hz,H-13′)、5.21(1H,dq,J分别为6.2 Hz 和2.4 Hz,H-14′)、1.26(3H,d,J=2.9 Hz,H-15′)、2.16(1H,m,H-16′)、1.13(3H,d,J=3.8 Hz,H-17′)、0.92(3H,d,J=6.8 Hz,H-18′)、2.88(3H,s,H-19′)、2.91(3H,s,H-20′)、2.67(1H,m,H-21′)、0.74(3H,d,J=6.2 Hz,H-22′)、0.97(3H,d,J=6.4 Hz,H-23′)、2.67(1H,m,H-2″)、4.73(1H,d,J=17.5 Hz,H-4″a)、3.64(1H,d,J=17.5 Hz,H-4″b)、5.95(1H,d,J=9.1 Hz,H-6″)、2.67(1H,m,H-7″a)、1.81(1H,m,H-7″b)、2.27(1H,m,H-8″a)、2.09(1H,m,H-8″b)、3.83(2H,m,H-9″)、3.56(1H,m,H-11″)、8.02(1H,d,J=6.2 Hz,NH-11″)、4.51(1H,dd,J分别为6.8 Hz 和2.4 Hz,H-13″)、5.21(1H,dq,J分别为6.3 Hz 和2.3 Hz,H-14″)、1.26(3H,d,J=2.8 Hz,H-15″)、2.08(1H,m,H-16″)、1.12(3H,d,J=3.9 Hz,H-17″)、0.89(3H,d,J=6.7 Hz,H-18″)、2.88(3H,s,H-19″)、2.94(3H,s,H-20″)、2.67(1H,m,H-21″)、0.74(3H,d,J=6.2 Hz,H-22″)和0.95(3H,d,J=6.3 Hz,H-23″).化合物1 的核磁共振碳谱(13C-NMR)(125 MHz,CDCl3)数据如下:δ分别为101.7(C-1)、147.6(C-2)、179.1(C-3)、113.6(C-4)、145.1(C-4a)、140.5(C-5a)、127.7(C-6)、130.3(C-7)、125.7(C-8)、132.6(C-9)、129.1(C-9a)、145.9(C-10a)、166.6(C-10)、166.5(C-11)、15.1(C-12)、7.8(C-13)、167.6(C-1′)、71.4(C-2′)、166.5(C-3′)、51.4(C-4′)、173.3(C-5′)、56.5(C-6′)、31.0(C-7′)、23.0(C-8′)、47.6(C-9′)、173.7(C-10′)、58.9(C-11′)、169.0(C-12′)、55.2(C-13′)、75.1(C-14′)、17.3(C-15′)、31.8(C-16′)、19.3(C-17′)、19.1(C-18′)、35.0(C-19′)、39.3(C-20′)、27.0(C-21′)、21.7(C-22′)、19.3(C-23′)、167.6(C-1″)、71.2(C-2″)、166.3(C-3″)、51.4(C-4″)、173.3(C-5″)、56.3(C-6″)、31.3(C-7″)、22.9(C-8″)、47.4(C-9″)、173.3(C-10″)、58.8(C-11″)、168.5(C-12″)、54.8(C-13″)、75.0(C-14″)、17.7(C-15″)、31.6(C-16″)、19.1(C-17″)、19.0(C-18″)、34.9(C-19″)、39.2(C-20″)、26.9(C-21″)、21.6(C-22″)和19.1(C-23″).以上数据与文献[18-19]报道一致,故将该化合物鉴定为放线菌素D(actinomycin D).
化合物2 为红色粉末,分子式为C62H84N12O17,HR-ESI-MS:m/z=1 291.613 5[M+Na]+.化合物2的1H-NMR(500 MHz,methanol-d4)数据如下:δ分别为7.46(1H,d,J=7.7 Hz,H-7)、7.52(1H,d,J=7.7 Hz,H-8)、2.59(3H,s,H-12)、2.04(3H,s,H-13)、3.00(1H,d,J=6.7 Hz,H-2′)、4.74(1H,m,H-4′a)、4.04(1H,m,H-4′b)、6.13(1H,d,J=9.0 Hz,H-6′)、2.84(1H,m,H-7′a)、1.92(1H,m,H-7′b)、2.23(2H,m,H-8′)、4.04(1H,m,H-9′a)、3.74(1H,m,H-9′b)、3.84(1H,m,H-11′)、8.16(1H,d,J=5.8 Hz,NH-11′)、4.58(1H,m,H-13′)、5.24(1H,m,H-14′)、1.20(3H,d,J=6.3 Hz,H-15′)、2.13(1H,m,H-16′)、0.90(3H,d,J=6.7 Hz,H-17′)、1.16(3H,d,J=7.2 Hz,H-18′)、2.88(3H,s,H-19′)、2.96(3H,s,H-20′)、2.57(1H,m,H-21′)、0.81(3H,d,J=7.0 Hz,H-22′)、1.00(3H,d,J=6.7 Hz,H-23′)、3.00(1H,d,J=6.7 Hz,H-2″)、4.74(1H,m,H-4″a)、4.04(1H,m,H-4″b)、6.72(1H,d,J=9.6 Hz,H-6″)、3.82(1H,m,H-7″a)、2.37(1H,d,J=18.2 Hz,H-7″b)、4.58(1H,m,H-9″a)、3.93(1H,m,H-9″b)、3.71(1H,m,H-11″)、7.84(1H,d,J=6.5 Hz,NH-11″)、4.73(1H,m,H-13″)、5.24(1H,m,H-14″)、1.32(3H,d,J=6.4 Hz,H-15″)、2.13(1H,m,H-16″)、1.16(3H,d,J=7.2 Hz,H-17″)、0.94(3H,d,J=6.8 Hz,H-18″)、2.88(3H,s,H-19″)、2.96(3H,s,H-20″)、2.57(1H,m,H-21″)、0.81(3H,d,J=7.0 Hz,H-22″)和1.00(3H,d,J=6.7 Hz,H-23″).化合物2 的13C-NMR(125 MHz,methanol-d4)数据如下:δ分别为101.5(C-1)、147.7(C-2)、179.0(C-3)、112.8(C-4)、145.1(C-4a)、140.4(C-5a)、127.8(C-6)、130.0(C-7)、125.4(C-8)、132.1(C-9)、129.2(C-9a)、145.7(C-10a)、166.8(C-10)、166.7(C-11)、13.6(C-12)、6.1(C-13)、168.5(C-1′)、70.4(C-2′)、167.0(C-3′)、51.0(C-4′)、173.8(C-5′)、57.1(C-6′)、30.8(C-7′)、22.6(C-8′)、47.4(C-9′)、173.5(C-10′)、56.8(C-11′)、168.8(C-12′)、54.7(C-13′)、74.4(C-14′)、15.8(C-15′)、31.6(C-16′)、18.4(C-17′)、17.9(C-18′)、34.0(C-19′)、37.9(C-20′)、26.9(C-21′)、18.0(C-22′)、20.3(C-23′)、168.5(C-1″)、70.7(C-2″)、167.1(C-3″)、51.1(C-4″)、174.2(C-5″)、54.6(C-6″)、41.5(C-7″)、208.7(C-8″)、52.6(C-9″)、174.0(C-10″)、58.3(C-11″)、168.9(C-12″)、54.8(C-13″)、74.4(C-14″)、16.7(C-15″)、31.8(C-16″)、18.0(C-17″)、18.4(C-18″)、34.1(C-19″)、38.0(C-20″)、27.0(C-21″)、18.1(C-22″)和20.4(C-23″).以上数据与文献[18-19]报道一致,故将该化合物鉴定为放线菌素X2(actinomycin X2).
化合物3为橙红色粉末,分子式为C62H86N12O17,HR-ESI-MS:m/z=1 271.631 0[M+H]+.化合物3的1H-NMR(500 MHz,acetone-d6)数据如下:δ分别为7.51(1H,d,J=7.7 Hz,H-7)、7.64(1H,d,J=7.7 Hz,H-8)、2.59(3H,s,H-12)、2.19(3H,s,H-13)、7.59(1H,d,J=7.0 Hz,10-NH)、7.81(1H,d,J=6.8 Hz,11-NH)、2.96(1H,overlap,H-2′)、4.62(1H,d,J=17.4 Hz,H-4′a)、4.01(1H,d,J=17.4 Hz,H-4′b)、6.18(1H,d,J=9.2 Hz,H-6′)、2.61(1H,m,H-7′a)、1.78(1H,m,H-7′b)、2.15(1H,m,H-8′a)、2.02(1H,m,H-8′b)、3.70(2H,m,H-9′)、3.62(1H,m,H-11′)、8.12(1H,d,J=6.0 Hz,NH-11′)、4.64(1H,m,H-13′)、5.22(1H,m,H-14′)、1.27(3H,d,J=6.4 Hz,H-15′)、0.84(3H,d,J=6.7 Hz,H-17′)、1.12(3H,d,J=6.4 Hz,H-18′)、2.82(3H,s,H-19′)、2.94(3H,s,H-20′)、0.76(3H,d,J=6.7 Hz,H-22′)、0.96(3H,d,J=6.4 Hz,H-23′)、2.98(1H,overlap,H-2″)、4.70(1H,d,J=17.4 Hz,H-4″a)、4.03(1H,d,J=17.4 Hz,H-4″b)、6.23(1H,d,J=9.7 Hz,H-6″)、2.16(2H,overlap,H-7″)、3.84(1H,m,H-8″)、3.70(2H,m,H-9″)、3.70(1H,m,H-11″)、8.20(1H,d,J=5.8 Hz,NH-11″)、4.72(1H,m,H-13″)、5.22(1H,m,H-14″)、1.30(3H,d,J=6.4 Hz,H-15″)、0.87(3H,d,J=6.7 Hz,H-17″)、1.12(3H,d,J=6.4 Hz,H-18″)、2.83(3H,s,H-19″)、2.97(3H,s,H-20″)、0.77(3H,d,J=6.7 Hz,H-22″)和0.96(3H,d,J=6.4 Hz,H-23″).以上数据与文献[18-19]报道一致,故将该化合物鉴定为放线菌素Xoβ(actinomycin Xoβ).
化合物4 为淡黄色针状晶体,分子式为C26H23N3O5,HR-ESI-MS:m/z=458.171 2[M+H]+.化合物4 的1H-NMR(500 MHz,acetone-d6)数据如下:δ分别为7.71(1H,d,J=8.4 Hz,H-1)、7.45(1H,td,J分别为7.2 Hz 和0.9 Hz,H-2)、7.24(1H,td,J分别为7.7 Hz 和0.6 Hz,H-3)、9.55(1H,d,J=7.9 Hz,H-4)、7.51(1H,br s,NH-6)、5.05(1H,dd,J分别为17.1 Hz 和0.7 Hz,H-7a)、4.97(1H,dd,J分别为17.1 Hz 和0.7 Hz,H-7b)、8.03(1H,d,J=7.7 Hz,H-8)、7.30(1H,td,J分别为7.8 Hz 和0.7 Hz,H-9)、7.47(1H,td,J分别为7.1 Hz 和1.2 Hz,H-10)、7.63(1H,d,J=8.1 Hz,H-11)、11.54(1H,br s,NH-12)、6.59(1H,d,J=9.4 Hz,H-1′)、4.80(1H,dd,J分别为9.5 Hz和3.5 Hz,H-2′)、4.47(1H,t,J=3.0 Hz,H-3′)、4.32(1H,br d,J=3.1 Hz,H-4′)、4.65(1H,q,J=7.2 Hz,H-5′)、1.82(3H,d,J=7.3 Hz,H-6′)、4.55(1H,br s,2′-OH)、4.71(1H,br s,3′-OH)和5.87(1H,br s,4′-OH).化合物4 的13CNMR(125 MHz,acetone-d6)数据如下:δ分别为109.4(C-1)、125.1(C-2)、119.4(C-3)、126.2(C-4)、123.1(C-4a)、118.4(C-4b)、118.7(C-4c)、172.5(C-5)、45.3(C-7)、134.1(C-7a)、115.4(C-7b)、122.5(C-7c)、121.0(C-8)、119.8(C-9)、125.0(C-10)、111.3(C-11)、139.7(C-11a)、128.2(C-12a)、125.0(C-12b)、140.8(C-13a)、77.5(C-1′)、67.5(C-2′)、72.7(C-3′)、71.9(C-4′)、77.0(C-5′)和14.9(C-6′).以上数据与文献[20-21]报道一致,故将该化合物鉴定为吲哚咔唑生物碱K-252d.
2.2 化合物抗菌活性结果
对化合物1和4进行抗菌活性测试,结果显示,化合物1对植物病原真菌具有广谱的抑制作用,它对香蕉枯萎菌FOC4、木瓜可可毛色二孢霉、木瓜拟茎点霉、辣椒棒孢霉、辣椒疫霉、豇豆瓜果腐霉、豇豆棒孢霉、小麦赤霉菌、大丽轮枝菌和椰枣小孢拟盘多毛孢均具有抑菌活性(表1).其中,对木瓜可可毛色二孢霉的抑菌活性最强,抑菌率达到(60.09±0.66)%;其次为木瓜拟茎点霉、小麦赤霉和辣椒疫霉,抑菌率分别为(48.82 ± 0.66)%、(46.47±1.14)%和(44.13±0.66)%;对椰枣小孢拟盘多毛孢霉的抑制活性最弱.而化合物4仅对香蕉炭疽菌具有微弱抑制活性,抑菌率为(12.87 ±0.66)%.同时,化合物1对水稻白叶枯病菌和茄青枯劳尔氏菌也具有较强的抑菌作用,其抑菌直径分别为(36.00±0.82)mm和(15.00±0.47)mm.
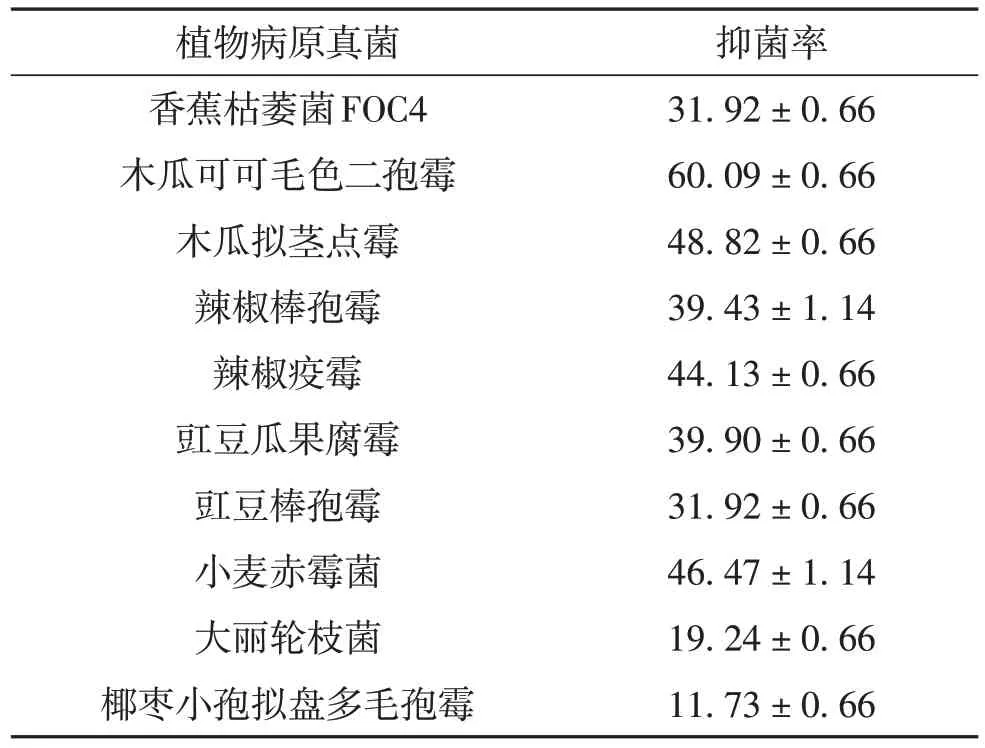
表1 化合物1对10种病原真菌的抑菌率Table 1 Inhibitory rate of compound 1 on ten pathogenic fungies %
3 分析讨论
利用大米固体培养基对两株海绵来源的具有拮抗病原菌活性的链霉菌菌株Streptomycessp.HMH1和HML1 固体发酵产物进行研究.从链霉菌菌株Streptomycessp.HMH1 的大米固体发酵产物中分离得到放线菌素D(化合物1)、放线菌素X2(化合物2)和放线菌素Xoβ(化合物3),它们均属于环肽类化合物抗生素.放线菌素D也叫更生霉素,最早在1940年从放线菌Actinomyces antibioticus中发现.迄今已发现了30 多个该类型的天然产物,主要由链霉菌产生,它们均具有显著的生物活性,如放线菌素D具有显著的抗肿瘤、抗病毒和蛋白酶抑制活性,但由于其具有强烈的毒性,目前仅用于恶性肿瘤的临床治疗[18-19].WANG等[18]曾从沙特沿海沙土的链霉菌中同时分离获得了放线菌素D、放线菌素X2和放线菌素Xoβ,并且发现它们对人肿瘤细胞MCF-7、A549 和K562 均具有强烈的细胞毒活性.其中,放线菌素X2具有最强的活性,而且对人正常胚胎肝细胞L02具有最低的毒性,预示着该化合物可作为一种抗癌药物候选药.同时也发现放线菌素D、放线菌素X2和放线菌素Xoβ对金黄色葡萄球菌、甲氧西林耐药金色葡萄球菌、枯草芽孢杆菌和蜡样芽胞杆菌具有很强的抗菌活性,甚至强过阳性药物盐酸环丙沙星的活性,其中放线菌素X2的活性最强.
天然抗菌化合物因无污染、毒性低和生物相容性好等优点,在植物病害防治和农用药物研发中具有重要潜力.郁蕾等[22]发现分离自海南五指山热带雨林的哥斯达黎加链霉菌的放线菌素D,对香蕉枯萎镰刀菌4号生理小种和金黄色葡萄球菌等有较强的抑制活性.曾羽澈等[23]对土壤链霉菌ZM-16来源的放线菌素D 进行了11 种植物病原真菌活性抑制实验,结果表明,放线菌素D对玉米纹枯病菌、禾谷镰刀菌、玉米小斑病菌、串珠镰刀菌、油菜菌核病菌、烟草赤星病菌、马铃薯早疫病菌、苹果炭疽病菌、玉米大斑病菌、拟般多毛孢菌和灰霉等11种病原真菌均具有抑菌效果.本研究也发现放线菌素D对植物病原菌具有广谱的抑制作用,对供试的10种病原真菌包括香蕉枯萎菌、木瓜可可毛色二孢霉、木瓜拟茎点霉、辣椒棒孢霉、辣椒疫霉、豇豆瓜果腐霉、豇豆棒孢霉、小麦赤霉菌、大丽轮枝菌、椰枣小孢拟盘多毛孢和2 种病原细菌(水稻白叶枯病菌和茄青枯劳尔氏菌)具有抑菌活性,有望成为一种高效、广谱的农用杀菌剂.当前关于放线菌素D的应用研究主要在临床癌症治疗研究,本研究结果为其在农业生产上的病害防治提供了重要参考.
本研究还从海绵链霉菌菌株Streptomycessp.HML1的大米固体发酵产物中分离鉴定出化合物K-252d(化合物4).化合物K-252d 是一种具有抗真菌、抗癌、抗血小板聚集、神经保护活性作用的吲哚咔唑生物碱,该化合物的很多结构衍生物已进入癌症治疗的临床II 和III 期研究[20],最早是从一株土壤来源的拟诺卡氏菌(Nocardiopsissp.K-290)代谢产物中分离出来,具有强烈的蛋白激酶C抑制作用,半抑制浓度(50%inhibiting concentration,IC50)为337 nmol/L,同时,对钙离子/钙调蛋白依赖的磷酸二酯酶(phosphodiesterase,PDE)具有抑制活性,IC50=46.2 μmol/L[21,24].周俊勇等[20,25]分别从南海北部沉积土的链霉菌菌株SCSIO1667和舟山群岛海底沉积土的链霉菌菌株A65中分离到该化合物及其类似物,并且发现它们对人肿瘤细胞PC3和蛋白激酶C具有较强的抑制活性.
结语
本研究结果进一步丰富了我国海洋放线菌天然产物库,为相关农业病害防治提供了新化合物和菌种资源,也为从我国南海热带海洋生物中寻找具有药用和农用价值的放线菌资源提供线索.目前研究仅发现放线菌素D对供试病原菌具有高效、广谱的体外抑菌效果,其体内抑菌效果和应用潜力如何,还有待后续深入研究.
