白介素17A在甲硝唑羧甲基壳聚糖凝胶治疗大鼠牙周炎过程中的变化
2022-09-27周焱祎
陈 东,周焱祎
(1 唐山市第二医院口腔科,唐山 063015;2 唐山市人民医院口腔科;* 通讯作者,E-mail:978359455@qq.com)
IL-17A已被确定为牙周病的关键炎症与免疫细胞因子,因为炎症与免疫反应过程可能主要通过Th17细胞及其主要因子白细胞介素-17A(IL-17)来介导、激活一系列炎症相关级联反应,影响炎症的发生和发展[1]。大鼠牙周炎模型研究发现IL-17能增强牙龈组织的局部炎症反应,可促进牙槽骨丢失和破骨细胞分化[2]。临床研究也提供了一些证据,如慢性牙周炎患者的血浆、龈沟液和牙龈活检样本中的IL-17水平明显高于健康人[3]。针对IL-17A的免疫疗法也开始受到关注,但就特定抗细胞因子的药物研发,口腔药物受到的关注远比不上其他全身系统性疾病,如目前已经开发出特异性抑制IL-17A的靶向治疗单克隆抗体,用于银屑病、关节炎和强直性脊柱炎等自身免疫疾病的治疗,而专业用于牙周炎细胞因子拮抗治疗的药物尚处在实验阶段[4]。因此,干预牙周炎IL-17A的分泌或者中和牙周炎IL-17A抗体的靶向治疗,值得积极探索。
壳聚糖是一种可自体降解、生物相容性好的天然多糖,由于其功能的多样性和易得性,在牙科领域有着广泛的应用。近年来的研究发现,壳聚糖及其衍生物可以作为口腔粘接剂、屏障膜、骨替代物、组织再生和抗菌剂等材料,更好地治疗口腔疾病[5]。国内外也有大量羧甲基壳聚糖用于牙周炎药物辅助剂的报道[5,6],本课题组前期也开展了有关甲硝唑羧甲基壳聚糖凝胶(metronidazole carboxymethyl chitosan topical gel,M/CMCS)治疗动物牙周炎的研究,发现该制剂能够抑制牙周炎大鼠的前列腺素E2(PGE2),具有保护牙槽骨的作用[7]。本项目继续采用大鼠模型来研究牙周炎病理过程中M/CMCS影响炎症因子IL-17A的变化情况。
1 材料与方法
1.1 主要试剂与试药
含0.75%甲硝唑和20%羧甲基壳聚糖的甲硝唑羧甲基壳聚糖复方温敏凝胶依前法[8]自制,醋酸溶解制备的甲基壳聚糖溶液,加甘油磷酸钠混合溶解的甲硝唑液,在4 ℃条件下充分搅匀后加泊洛沙姆p407混匀、定量静置即得;试验药物2%盐酸米诺环素软膏(PERIO®派丽奥,Sunstar INC.,日本)和0.75%甲硝唑凝胶(湖北康正药业有限公司)均本地采购;Western及IP细胞裂解液(无抑制剂)(上海碧云天生物技术有限公司);大鼠IL-17A免疫组化(IHC)检测试剂盒、ELISA试剂盒均购自武汉爱博泰克生物科技有限公司。
1.2 SD大鼠牙周炎模型制备
选择华北理工大学医学动物实验中心培育的75只2月龄SD大鼠[实验动物许可证号:SYXK(冀)2015-0038],称重、适应性饲养后将大鼠2%戊巴比妥钠腹腔麻醉,直径0.3 mm的牙科专用细丝结扎大鼠双侧上颌第一磨牙颈部,然后采用密度为1×109CFU/ml的ATCC 33277牙龈卟啉单胞菌(P.gingivalis)标准菌株扩增培养的菌液200 μl进行牙周接种,每日1次、计3次;饮水为10%葡萄糖糖水。
结扎造模满6周后,75只中随机抽取3只作为检测牙周炎模型成功与否的判定。结合文献和本课题组过去的造模方法[7-9],牙周检查记录牙龈指数、结扎牙松动度、牙周袋深度;然后动物安乐死,截取上颌骨,先X线摄片,检查牙槽骨吸收情况,再常规制作牙周牙体联合组织块进行HE染色,光镜下观察病理形态改变。结果显示造模均成功,达到进一步实验要求。
1.3 大鼠分组与处置
将剩余72只模型大鼠随机分为4组,每组18只。模型组(model),局部不涂布任何药物;甲硝唑羧甲基壳聚糖凝胶(M/CMCS)组,结扎牙四面牙周局部早晚各涂布自制的甲硝唑羧甲基壳聚糖复方温敏凝;2%盐酸米诺环素软膏(PERIO)组,涂布派丽奥软膏;0.75%甲硝唑凝胶(MNZ)组,涂布甲硝唑凝胶;每日治疗2次,治疗过程中如果发现结扎丝脱落则立即重新结扎。
每组18只大鼠,在治疗的第8,22,36天分别取6只大鼠,先腹腔麻醉,采集龈沟液和腹主动脉全血样本,再安乐死,然后分离截取上颌骨及牙周组织块,一侧组织块供ELISA实验,后续蛋白提取处理见1.4.3;对侧组织块供免疫组化实验,具体方法见1.5的免疫组化实验。
简略的实验技术路线和流程示意图见图1。
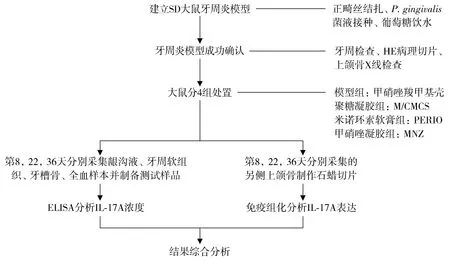
图1 技术路线和实验流程示意图Figure 1 Schematic diagram of technology roadmap and experimental process
1.4 ELISA法检测组织样本IL-17A浓度
1.4.1 龈沟液测试样本采集与制备 3次龈沟液采样分别在各组动物涂药治疗的第8,22,36天的上午8时开始。对每次各组需要龈沟液采样的6只大鼠,2%戊巴比妥钠腹腔麻醉后暴露结扎牙,隔湿后用干棉球擦拭干净牙龈缘部位,然后钝性分离结扎磨牙远中牙龈沟,将预先准备好的1根吸潮滤纸尖沿牙根面轻轻推入龈沟并停留30 s后取出(若有血迹则弃置并重新在腭侧取样),置EP管中放-80 ℃冰箱冻存。ELISA检测前,常温解冻、加PBS缓冲液、震荡后低温离心,收集上清液后供ELISA法检测IL-17A浓度。
1.4.2 全血血清样本采集与制备 接1.4.1步骤,每组6只大鼠的龈沟液采集完成后,立即无菌开腹、抗凝管采集腹主动脉血5 ml,低温离心准备上清液放-80 ℃冰箱,供ELISA法测定IL-17A浓度。
1.4.3 牙周软组织和牙槽骨的总蛋白裂解与提取制备 前述1.3处获得的上颌骨,正中截断为左右两段,一侧用于制备牙体牙周联合标本切片供免疫组织化学实验,具体见1.5.1。另一侧拔牙后将牙槽窝周围2 mm范围的软组织截取,拔除出来的牙体用无菌手术刀刮取根面附着的牙周膜等软组织,同时搔刮牙槽窝牙周软组织至牙槽骨硬表面,将两处所得软组织尽量剪碎、滤纸吸干、精确称重(每样本不低于50 mg)后放入无菌冻存管、标记后立即置液氮冷冻;同时将牙槽窝用预冷PBS液冲洗并除净软组织残渣后,用骨凿和挖匙剥取牙槽窝周边厚约2 mm范围的牙槽骨,同样收集称重(每样本不低于30 mg)标记后也立即液氮冷冻,供裂解蛋白提取。ELISA测定前先分别进行组织裂解与牙槽骨总蛋白提取,将软组织或者骨组织在液氮钵中加液氮快速磨成细粉末,然后在离心管中按照20 mg组织加200 μl标准加入Western及IP细胞裂解液进行裂解,再通过冰浴、振荡、低温离心,获得上清液并转移,即分别得牙周软组织与牙槽骨总蛋白提取物,置-80 ℃冰箱供ELISA法测定IL-17A浓度。
1.4.4 ELISA测定IL-17A浓度 将上述制备好的大鼠龈沟液、全血、牙周组织与牙槽骨总蛋白提取上清液的待测标本,采用双抗体夹心ABC-ELISA法检测各样品IL-17A的浓度。实验过程遵照试剂盒说明书操作,终止反应后在酶标仪450 nm波长处空白调零后测各孔OD值,绘制曲线并进行计算。
1.5 免疫组化实验检测IL-17A的表达
1.5.1 切片制备 将1.3处获得的供免疫组织化学实验的半侧上颌骨,立即放入4%多聚甲醛-磷酸盐缓冲液中,4 ℃固定48 h,10% EDTA-2Na脱钙液处理,常规梯度浓度乙醇脱水、石蜡包埋、切片,4 μm SP法常规免疫组化染色操作,实验按照本课题组在文献中提到的方法[7,8],步骤严格遵照大鼠IL-17A免疫组化检测试剂盒说明书进行。
1.5.2 阳性判定 封片后先低倍镜下观察,以细胞质有棕黄色颗粒着色为阳性标准、细胞质无棕黄色颗粒着色为阴性标准。每张切片中各选取5个面积相同的视野拍摄图片,然后电脑端采用Image-Pro Plus 6.0图像分析系统(美国Media Cybernetics公司)处理,计算平均光密度值(mean optical density,MOD)。
所有动物实验均在华北理工大学医学实验中心进行,并得到动物伦理委员会批准(批准号:DW20170902)。
1.6 统计学方法
2 结果
2.1 不同组织样本中IL-17A浓度比较
2.1.1 龈沟液 模型组大鼠龈沟液IL-17A浓度值最高,在第8,22,36天各时间点分别为(65.89 ±7.44)pg/ml、(65.86 ±7.68)pg/ml和(63.56 ±7.62)pg/ml,不同时间点差异无统计学意义(P>0.05)。与模型组相比,3个治疗组的IL-17A浓度在第8天即明显下降,且在第8,22,36天与模型组相比均降低(P<0.05)。在第8,22,36天,M/CMCS组和PERIO组的IL-17A水平均低于MNZ组(P<0.05);M/CMCS组和PERIO组在第8,22天差异尚未见有统计学意义(P>0.05),但在第36天时,M/CMCS组比PERIO组降低(P<0.05,见图2)。

同组与第8天比较,* P <0.05;与模型组比较,#P <0.05;与MNZ组比较,Δ P <0.05;与PERIO组比较,& P <0.05
将各组不同样本组织的IL-17A浓度结果进行比较,发现同组龈沟液的数值均低于牙周软组织(P<0.05),且显著低于全血水平(P<0.01);只有M/CMCS组龈沟液的IL-17A浓度高于牙槽骨,差异有统计学意义(P<0.05),其他各组的差异无统计学意义(P>0.05,见表1)。
2.1.2 牙周软组织 模型组在第8,22,36天IL-17A浓度呈现较高水平表达,不同时间点间差异没有统计学意义(P>0.05)。与模型组比较,M/CMCS组、PERIO组和MNZ组在第8,22,36天的IL-17A浓度均降低(P<0.05)。在第8,22,36天,M/CMCS组、PERIO组与MNZ组比较IL-17A的浓度均明显下降(P<0.05);在第36天,M/CMCS组IL-17A浓度比PERIO组低(P<0.05,见图3)。同组牙周软组织IL-17A的浓度均明显高于龈沟液(P<0.05,见表1)。
与第8天比较,* P <0.05;与模型组比较,# P <0.05;与MNZ组比较,Δ P <0.05;与PERIO组比较,& P <0.05

表1 各组不同样本组织的IL-17A浓度结果比较
2.1.3 牙槽骨 模型组的IL-17A浓度在第8,22,36天不同时间点的差异无统计学意义(P>0.05)。与模型组比较,M/CMCS组、PERIO组和MNZ组在第8,22,36天IL-17A浓度均降低(P<0.05)。在第8,22,36天,M/CMCS组与PERIO组间IL-17A浓度差异无统计学意义(P>0.05),但该两组IL-17A浓度在第8,22,36天均较MNZ组降低(P<0.05,见图4)。

与第8天比较,* P <0.05;与模型组比较,# P <0.05;与MNZ组比较,Δ P <0.05
在第8,22,36天,M/CMCS组、PERIO组和MNZ组牙槽骨的IL-17A浓度值均比牙周软组织低(P<0.05),但M/CMCS组牙槽骨的IL-17A浓度值在第36天时比同时期该组的龈沟液高,且差异有统计学意义(P<0.05,见表1)。
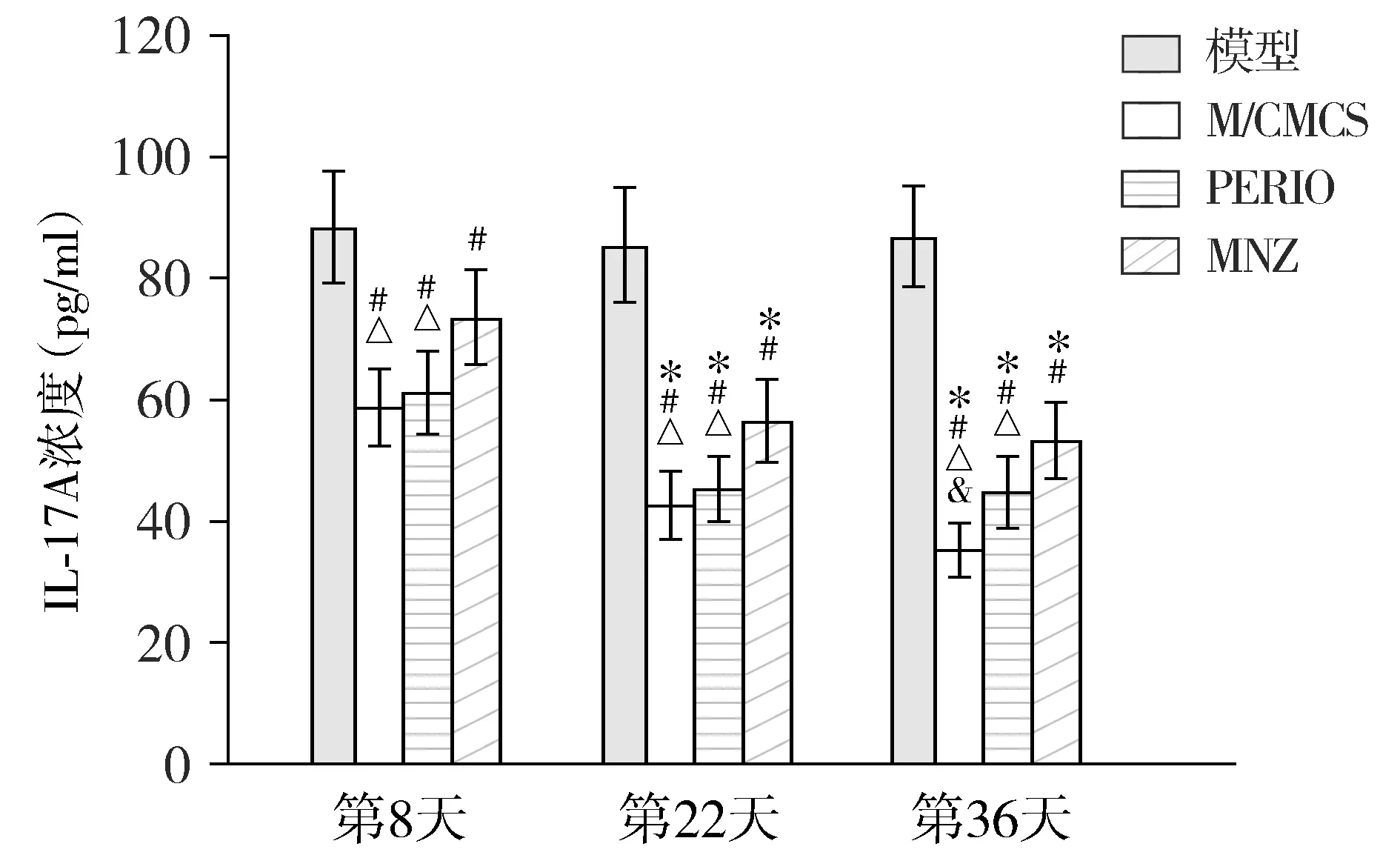
2.1.4 全血 模型组全血的IL-17A浓度,在第8,22,36天均较高,不同时间点间差异无统计学意义(P>0.05);M/CMCS组、PERIO组和MNZ组全血的IL-17A浓度在第22,36天较第8天均下降(P<0.05),且3个药物治疗组在第8,22,36天较模型组明显降低(P<0.05),但M/CMCS组、PERIO组和MNZ组间在相同时间点均未见差异有统计学意义(P>0.05,见图5)。
与第8天比较,* P <0.05;与模型组比较,# P <0.05
在各相同时间点,同组全血IL-17A浓度均比龈沟液、牙周软组织、牙槽骨为低,差异有统计学意义(P<0.01,见表1)。
2.2 牙周组织IL-17A的免疫组织化学结果
各组牙周组织的IL-17A免疫组化结果,在组织形态和阳性表达程度方面均呈现一定差异。模型组大鼠正常牙周组织的基本形态严重破坏,龈附着点向根方严重退缩,牙根大部分暴露,龈乳头上皮严重溃破且出现组织缺损,牙槽骨严重不规则吸收已经接近根尖(见图6A);M/CMCS组在高倍镜下可见龈附着点位置几乎没有发生根方位移,牙龈乳头上皮下龈纤维致密完整、走向正常,牙周袋浅,结合上皮和上皮钉突完整,龈纤维下牙槽嵴顶发生少许不规则骨吸收,但形态基本正常,牙周韧带未见明显破坏(见图6B);PERIO组牙周软组织形态与M/CMCS组相似,但牙周袋略宽略深且牙槽嵴水平型和垂直型吸收较M/CMCS组稍多(见图6C);MNZ组牙龈组织受损比M/CMCS组和PERIO组均严重,牙龈乳头下纤维少许紊乱,牙槽嵴水平型吸收明显且出现多个骨吸收陷窝(见图6D)。

A.模型组(×100) B. M/CMCS组(×200) C. PERIO组(×100) D. MNZ组(×200)浅黄色、棕黄色表示阳性细胞的染色强度;B:牙槽骨;P:牙周膜;R:牙根
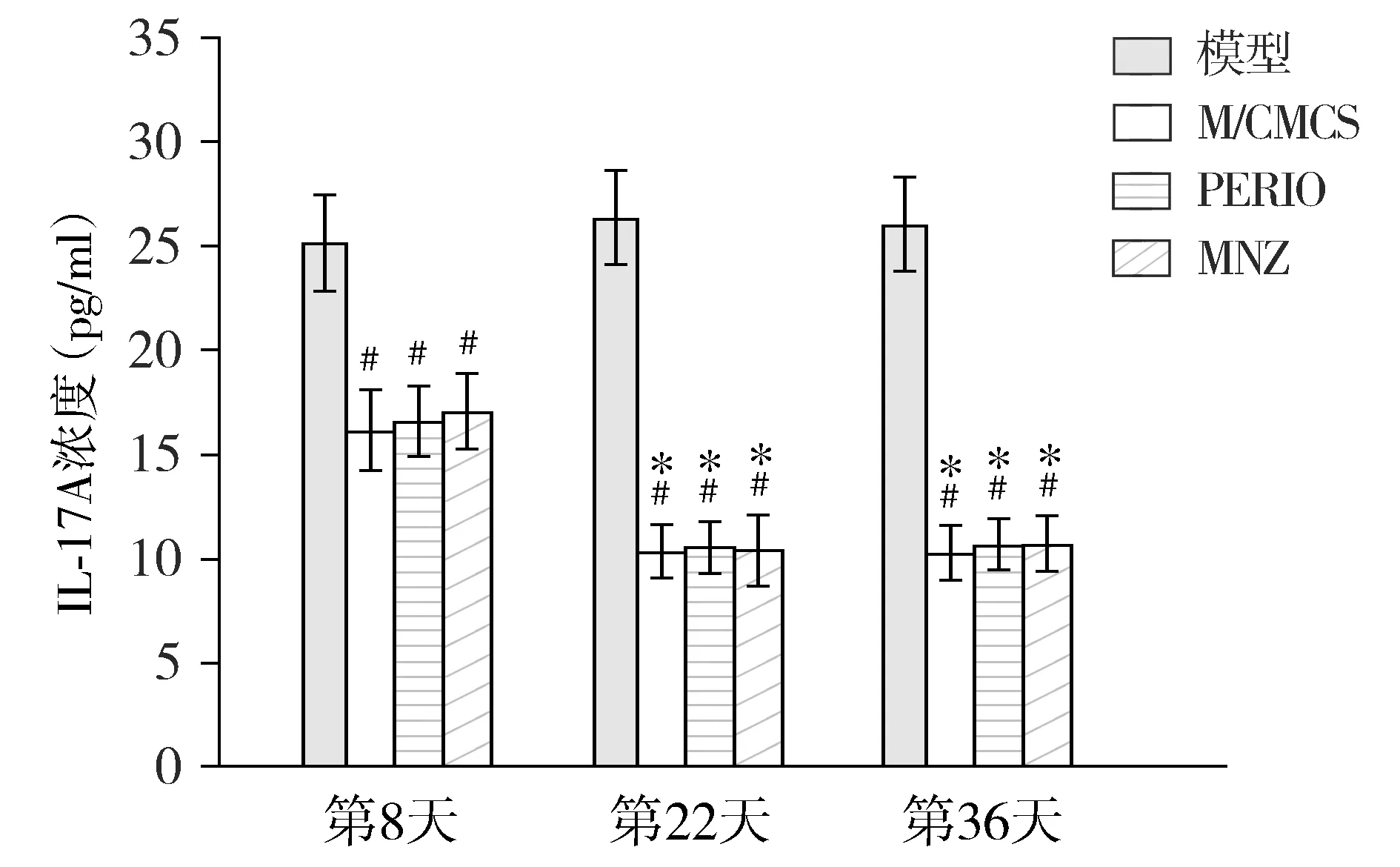
不同时间点牙周组织IHC结果显示,与模型组比较,M/CMCS组、PERIO组和MNZ组在第8,22,36天IL-17A平均光密度(MOD)值均低(P<0.05);MNZ组的MOD值在第8,22,36天均明显高于M/CMCS组和PERIO组(P<0.05);在第36天时,PERIO组也高于M/CMCS组(P<0.05,见图7)。
与第8天比较,* P <0.05;与模型组比较,# P <0.05;与MNZ组比较,Δ P <0.05;与PERIO组比较,& P <0.05
3 讨论
IL-17A在牙周炎的发生发展过程中有着重要的保护和破坏双重作用。目前研究发现,IL-17A通过不同的信号转导途径和级联反应作用于不同的效应细胞,产生不同的生理或病理效应,介导牙周炎的发生和发展[10,11]。IL-17A通过诱导成骨细胞分泌RANKL,提高RANKL的表达,从而促进破骨细胞中的RANK信号转导,参与破骨细胞分化,介导牙周炎的牙槽骨吸收[1,12];IL-17A也可以在没有RANKL的情况下诱导破骨细胞生成[1]。动物研究表明,在局部注射IL-17A干预的牙周炎大鼠模型中,破骨细胞数量和牙槽骨吸收增加[13]。最近的研究发现,在局部牙周区域持续输送IL-17A中和抗体可以限制实验性牙周炎小鼠的炎症性骨丢失[14]。在该项动物实验中,研究者开发出一种局部持续给药系统,通过在聚乳酸-乙醇酸微粒中加入中和抗IL-17A抗体,该制剂系统在结扎诱导的牙周炎小鼠牙周组织中控制释放抗IL-17A抗体,抑制牙周组织中的IL-17A活性。结果发现小鼠牙周炎诱导后局部注射抗IL-17A聚乳酸-乙醇酸微粒可抑制牙槽骨丢失和破骨细胞活性;抗IL-17A聚乳酸-乙醇酸微粒配方还降低了IL-6的表达,而IL-6则是已知的可诱导牙周组织骨吸收的IL-17A靶基因。研究结果提示IL-17A单克隆抗体的局部和持续释放是一种有希望的牙周炎治疗策略[14]。因此,有理由期待更多的研究来确定IL-17A抑制剂是否可以局部用于治疗牙周炎,以及在牙周炎的哪个发展阶段应该使用IL-17A抑制剂。
关于牙周炎过程中IL-17A的组织分布,许多研究表明,IL-17A存在于牙周病患者的牙周组织[15]、龈沟液[15-17]、唾液[18]和血浆[19]中,而且均较健康牙周者显著增高。此外,慢性牙周炎患者牙龈组织中IL-17A mRNA的表达水平高于牙龈炎患者[20]。据此IL-17A被认为是牙周炎病理过程中一个重要的生物学标志因子。本次动物模型实验,牙周炎大鼠的IL-17A检测结果与有关文献相同[15-19]。大鼠牙周炎发病过程中,IL-17A在龈沟液、牙周软组织和牙槽骨包括全血发生表达变化。在未经治疗的模型组,都出现了IL-17A相对稳定的高浓度表达,而且随着时间变化,各组织样本中的IL-17A水平趋于稳定且没有出现大的波动,可能与牙周慢性炎症持续状态有关。因为牙周炎作为一种慢性炎症持续病理状态,在没有新的干预因素作用下,机体在一定时间内会达到一种与感染诱导和免疫关联的细胞因子间平衡。结合牙周检查结果和形态学观察,可以肯定IL-17A高表达与牙周组织的破坏有密切关系,因为3种药物局部治疗后,都出现了不同程度的IL-17A表达抑制,再结合IHC的MOD值分析,可以肯定药物干预后牙周组织健康状况的好转与IL-17A的低表达有密切关系,尤其在M/CMCS组的表现更为明显。
牙周炎治疗的总体目标是消除菌斑微生物及其他促进因素,消除炎症,控制牙周炎进展并防止复发。现在临床广泛采用的局部龈下刮治、根面平整后予以抗菌药物和辅助剂治疗,特别是龈下控释与缓释制剂的应用,有一定的效果。甲硝唑因为具备专性厌氧菌的杀菌活性,多年来一直是临床牙周炎抗生素治疗的首选药物,而派丽奥软膏的主要成分为二甲胺四环素(又称米诺环素,minocycline),也是目前临床牙周治疗中局部给药最多的药物之一,但是这些药物的耐药问题日益严重,疗效面临挑战[21,22]。为了提高牙周炎的疗效,现在临床倾向于开发以较低药物剂量置入牙周袋的缓释和/或控释的靶向装置,其中可以作为牙周药物缓释控载体的羧甲基壳聚糖,因为具有独特的抗菌、抗炎、促进组织愈合和诱导成骨的作用而为牙周病学界所重视[5,6]。因此,利用甲壳素作为药物输送载体,与具有抗厌氧菌效果的甲硝唑制成复方制剂便是一种理想的开发思路。关于甲壳素与甲硝唑组成复方制剂后的细胞毒性和药物释放效果,相关研究也证实甲壳素/明胶/β-甘油磷酸酯温敏水凝胶是一种无细胞毒性作用的药物载体[23]。选择低分子的甲硝唑和高分子的盐酸万古霉素进行药物释放比较研究,结果甲硝唑的体外初始释放量和总释放量分别为13%和67%,明显优于盐酸万古霉素的3%和23%,表明甲壳素/明胶/β-甘油磷酸盐可以形成并维持甲硝唑的持续释放,其浓度随着时间的推移可有效消除病原菌[23]。一项研究制备了可生物降解的壳聚糖包被甲硝唑和左氧氟沙星的药物薄膜,体外抗菌效果测试表明该膜具有良好的抗金黄色葡萄球菌和大肠杆菌的活性,临床治疗试验将药膜置入患者牙周袋后,结果显著降低了牙周炎的牙龈指数、菌斑指数和牙周袋深度,成为一种治疗牙周炎的良好药剂[24]。本实验采用甲硝唑羧甲基壳聚糖凝胶和对照药物对大鼠牙周炎干预治疗,对龈沟液、牙周软硬组织和全血的IL-17A的分析,发现动物在牙周炎持续状态下,均存在高表达,而在药物干预后均有下降,自制的M/CMCS凝胶效果要优于另外两种对照抗生素药物,通过龈沟液与牙周软组织的结果可以看出,M/CMCS凝胶抑制IL-17A的分泌在第36天时不但优于甲硝唑凝胶,而且也好过派丽奥软膏。特别是如果将M/CMCS凝胶与单纯的甲硝唑凝胶进行比较,无论是对IL-17A的表达抑制还是在形态学方面,M/CMCS凝胶的优势更明显,其中M/CMCS凝胶在第36天影响牙槽骨的IL-17A的表达与同时期龈沟液的比较,结果具有明显差异,而派丽奥软膏和单纯的甲硝唑凝胶组均没有出现此种现象,再结合免疫组化实验IL-17A的阳性表达结果和牙周组织的形态学变化特别是牙槽骨吸收的情况,可以初步说明羧甲基壳聚糖联合甲硝唑在抑制牙槽骨吸收方面有较好的作用,可能与IL-17A的表达抑制存在一定的关联性。因为M/CMCS凝胶制剂所含的羧甲基壳聚糖,除固有的抗炎、抑菌、促进组织修复等生物学效应外,尚具备缓释控释作用。其治疗大鼠牙周炎良好的效果与缓释制剂在牙周袋局部释放甲硝唑的持久和增效相关,表现出了较好的抗感染和抑制口腔厌氧菌的作用。
总之,M/CMCS凝胶治疗大鼠牙周炎的效应可能与M/CMCS能够抑制炎症细胞因子IL-17A的分泌密切关联,在目前抗生素治疗牙周炎广泛耐药的情况下,是一种值得进一步研究和开发的复方制剂。
致谢:本研究在唐山市人民医院工作期间完成,感谢唐山市人民医院中心实验室刘艳坤主任技术支持。
