乳酸脱氢酶测定试剂(盒)国家监督抽验质量分析
2022-09-26李胜民王会如
杨 忠,续 勇,李胜民,李 达,王会如
(北京市医疗器械检验研究院,国家药品监督管理局体外诊断试剂质量评价重点实验室,北京 101111)
0 引言
乳酸脱氢酶(lactate dehydrogenase,LDH)是一种结合蛋白,具有催化乳酸脱氢变成丙酮酸的作用,为糖代谢不可缺少的酶类。LDH存在于组织细胞内,正常人血内含有少量来自组织细胞或红细胞渗出的LDH。当组织器官受损时,LDH释入血内,血清中LDH浓度水平升高,其在肺炎、烧伤、肿瘤等很多疾病中表达明显增高,因此可以作为疾病评估的生物标志物[1-3]。正常生理情况下,组织或细胞LDH浓度水平远高于血清LDH浓度水平。当遭到肿瘤细胞侵袭作用时,LDH可从细胞内释放到循环系统中,因此血清LDH浓度水平可反映LDH浓度水平丰富的细胞的增殖及生理代谢等情况,并可准确反映肿瘤细胞的增殖情况。据报道,LDH浓度水平升高与肿瘤恶性程度及预后不良有关[4]。Yan等[5]报道了新型冠状病毒肺炎患者血清中LDH浓度水平与病情严重程度、预后不良呈正相关,LDH浓度水平对患者严重程度进行分类的能力优于其他生化指标。
LDH活性的测定方法目前主要有LDH催化L-乳酸到丙酮酸的乳酸底物法和催化丙酮酸生成乳酸的丙酮酸底物法,1994年国际临床化学联合会将乳酸底物法定为参考方法。在碱性条件下,LDH催化L-乳酸生成丙酮酸,同时将NAD+(氧化型烟酰胺腺嘌呤二核苷酸)还原成NADH(还原型烟酰胺腺嘌呤二核苷酸)。因NADH生成的速率与血清中LDH的活性成正比,所以可通过在340 nm波长处监测NADH吸光度上升时的变化速率计算LDH的活性[6-7]。目前,临床使用最广泛的LDH测定试剂(盒)产品绝大多数适用于全自动生化分析仪和半自动生化分析仪,其中部分国产试剂盒没有自主建立完整的量值溯源体系,常常使用市场上主流品牌的商品化校准品对自己的试剂定标后再进行样本测定,缺乏完整的溯源链,可能会导致临床检测中产生不准确的结果,对临床诊断、疗效监测和预后判断造成不良影响。为了掌握LDH测定试剂(盒)产品的质量情况,确保产品安全有效,国家药品监督管理局于2020年制定了该产品的国家监督抽验计划,并组织实施。北京市医疗器械检验研究院作为技术牵头单位承担了方案制订和抽验全过程的工作,天津市医疗器械质量监督检验中心、河北省医疗器械与药品包装材料检验研究院、湖北省医疗器械质量监督检验研究院、四川省医疗器械检测中心作为参与单位承担了抽验任务,并针对产品抽验质量情况提出意见和建议。现对产品的抽验质量情况进行分析。
1 材料与方法
1.1 材料
仪器:日立7180型、日立7100型、贝克曼DXC800pro型、东芝TBA-40FR型、贝克曼AU680型全自动生化分析仪。
检测对象:2020年从北京、浙江、天津、吉林、贵州、河北、河南、湖北、湖南、广西等地抽取到49家生产企业(见表1)的共50批次(其中浙江世纪康大医疗科技股份有限公司抽取了2批次)国产LDH测定试剂(盒)。

表1 49家LDH测定试剂(盒)生产企业
样本:各试剂盒配套或指定的质控品和校准品;有证参考物质[如GBW(E)090350人血清中LDH活性浓度标准物质];人血清样本。
1.2 方法
1.2.1 法定检验
按照各试剂盒说明书进行操作,在试剂盒适用的全自动生化分析仪上设置反应条件,采用试剂盒配套或指定的校准品进行校准,检测试剂盒配套或指定质控品,结果在质控品范围内则可正常开展检测。依据生产企业备案的医疗器械产品注册标准或技术要求,按照其中规定的方法对监督抽验方案中规定的准确度、线性、重复性指标进行法定检验,根据产品注册标准或技术要求中的指标参数要求进行符合性判定。(1)准确度检验。
根据各生产企业的产品注册标准或技术要求可采用以下3种方法中的一种进行检验:①测试可用于评价常规方法的有证参考物质或其他公认的参考物质3次,计算3次检测结果与参考物质标称值的相对偏差。参考物质范围较广,标准物质、校准品、质控品都属于此范围,本文中的参考物质均为标准物质。②采用比对试验,用待测试剂和选定的比对试剂分别检测40份人血清样本,计算2个试剂检测结果间的相关系数、绝对偏差和相对偏差。③做回收实验,计算回收率(R)。
(2)线性检验。
首先用接近各试剂盒声称的线性区间下限的低浓度样本(低浓度血清或样本缓冲液等)稀释接近线性区间上限的高浓度样本(血清),混合成至少5个稀释浓度。然后用试剂盒分别测试以上样本,根据生产企业各自的规定,每个稀释浓度测试2~3次,分别求出每个稀释浓度检测结果的均值。再以稀释度为自变量,以检测结果均值为因变量,用最小二乘法进行直线拟合,求出线性回归方程,计算线性回归的相关系数(r)。最后将稀释浓度代入方程,求出每个稀释浓度对应的估计值,计算每个稀释浓度检测结果均值与估计值的绝对偏差和相对偏差。
(3)重复性检验。
根据各产品注册标准或技术要求的规定,用试剂盒测试至少1~2个浓度水平的样本,各重复测试10次或20次,计算测量值的平均值(xˉ)和标准差(s),计算变异系数。
1.2.2 探索性研究
对抽检的50批次产品采用GBW(E)090350人血清中LDH活性浓度标准物质进行准确度检测,每批次的试剂盒测试3次,计算平均值及与标准物质标示值的相对偏差。依据行业标准YY/T 1241—2014《乳酸脱氢酶测定试剂(盒)》中准确度的要求进行判定,相对偏差应不超过±10%[8]。
对各产品注册标准或技术要求与行业标准的符合情况、产品量值溯源情况以及产品命名是否符合YY/T 1227—2014《临床化学体外诊断试剂(盒)命名》行业标准的规范性要求[9]等进行调查。
2 结果
2.1 法定检验
本次LDH测定试剂(盒)抽验有效样品50批次,法定检验结果:50批次全部合格,抽验合格率为100%;0批次不合格,抽验不合格率为0%。1家生产企业未提供浓度在规定的线性范围内的线性样本,未检验线性指标;由于标准物质断货,7家生产企业未能提供规定的准确度检验用标准物质,未检验准确度。具体检验结果见表2。

表2 法定检验结果
2.2 探索性研究
49家生产企业的50批次的LDH测定试剂(盒)检测GBW(E)090350人血清中LDH活性浓度标准物质,其中有41家企业共42个批次产品检验结果符合YY/T 1241—2014中准确度的要求,与标准物质标示值的相对偏差不超过±10%,合格率为84.0%。有8家企业8个批次的产品准确度检验结果不符合行业标准要求,不合格率为16.0%,测量结果正偏差范围为1.0%~26.8%,测量结果负偏差范围为-30.4%~-0.2%,最大偏差为-30.4%,如图1所示。
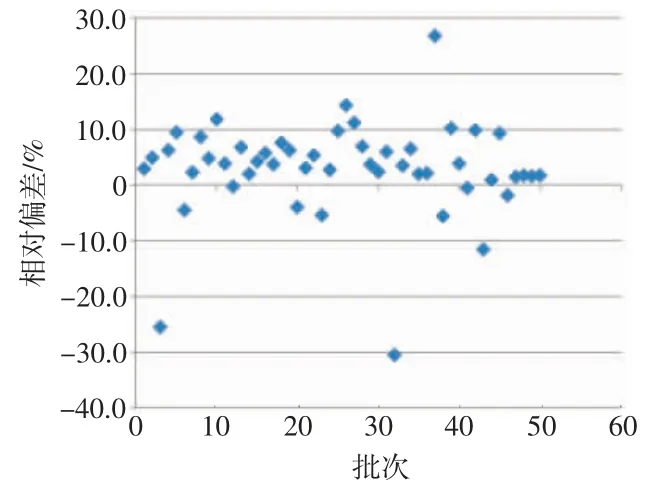
图1 探索性研究准确度结果
在对与行业标准的符合情况等方面的调查中发现,部分生产企业的产品注册标准或技术要求存在与行业标准要求不符合的情况:尺度过宽;50批次试剂盒中有38批次试剂盒没有自主建立完整的量值溯源链;部分产品的命名不规范,与关于临床化学体外诊断试剂命名的行业标准要求不相符。
3 讨论
国家药品监督管理局曾于2014年组织了对LDH测定试剂盒产品的监督抽验。在法定检验中,有效抽样的28个批次的产品中有5个批次产品不合格,抽检合格率为82.1%,不合格率为17.9%。不合格项目均为线性范围检验。2020年,该产品注册证在有效期内的LDH测定试剂(盒)产品有156种,测定原理普遍采用国际临床化学联合会推荐的乳酸底物法。本次有效抽样的50批次试剂盒,约占注册证在有效期内产品的三分之一,抽验结果表明:50批次试剂盒均符合企业产品注册标准或产品技术要求,证明经过几年的整顿,LDH测定试剂(盒)产品质量整体水平较以前显著提高。
同时应注意,在本次抽验中发现部分生产企业的产品注册标准或产品技术要求与行业标准相比在检验要求或方法上有所放松。例如,行业标准中对于准确度的要求为相对偏差不超过±10%,某企业的产品技术要求中规定最大偏差不超过±16%,尺度过于宽泛;部分企业准确度检验使用质控品,与行业标准规定的标准物质不符,质控品的不确定度大于标准物质,不适用于准确度检验;行业标准中对于重复性的要求为变异系数不超过5%,部分企业为6%甚至8%,降低了要求。生产企业应依据行业标准内容及时更新产品技术要求,以保证其产品符合行业标准的要求,保证产品质量符合临床需要。
本次国家监督抽验的50批次产品中只有12批次的产品使用企业生产的校准品,具备完整的量值溯源链,其余38批次的产品均没有自己的校准品,多数使用市场上大品牌的商品化校准品,部分产品的技术要求和说明书中均没有明确说明该产品的溯源路径,其产品溯源性不够明确。探索性研究的结果表明,50批次试剂盒检测同一标准物质,8批次产品不符合要求,均在上述38批次产品之列,原因在于其自身没有建立完整的量值溯源链,不能保证其产品与商品化校准品组合检测标准物质或临床样本时具有良好的互换性,可能会导致临床检测中产生不准确的结果。因此,生产企业应加强产品的量值溯源性研究,建立自己的溯源体系,以保证产品的检测结果准确、可溯源。如果有国家或国际参考品,建议以国家或国际参考品作为溯源的源头,此类参考品大多是经过参考方法定值或经多个实验室、多种方法协作标定,并在均匀性、互换性、稳定性等方面通过了严格的验证,标示值的不确定度也较为合理[10-11]。
依据YY/T 1227—2014行业标准,LDH测定试剂(盒)的产品命名包括LDH测定试剂盒(乳酸底物法)、LDH测定试剂盒(丙酮酸底物法)2种。本次抽检产品包括多种名称,如LDH测定试剂盒(DGKC推荐法)、LDH测定试剂盒(连续监测法)、LDH测定试剂盒(速率法)等,企业应按照行业标准的要求规范产品命名[9]。分析上述现象产生的原因,主要为相关生产企业对与产品对应的行业标准和与量值溯源有关的国家和行业标准不熟悉,或者一些早期获得注册证的产品在国家和行业标准发布实施前没有明确具体的规定可以参照,技术要求既不规范又不统一,在国家和行业标准实施后没有在到期换证时对产品和技术要求进行相应变更,没有按照标准要求开展研发、生产等。
针对监督抽验中发现的问题,建议对此类体外诊断试剂产品延续开展国家监督抽验和省级监督抽验工作,对在抽验工作中发现问题的产品后续进行重点监督,通过产品质量分析报告、产品风险提示等多种方式对诸如量值溯源、产品命名等方面的问题进行规范要求;提示生产企业重视标准学习,标准化技术委员会继续加强标准宣贯与培训,使生产企业加深标准理解,提高产品质量[12];在监管工作中可以依据与产品相关的国家和行业标准、说明书编写指导原则等文件,针对已获证上市产品的技术要求、量值溯源文件、说明书规范性等进行风险监测专项检查,采取多种措施提高产品的规范性、科学性,以进一步提升产品的质量水平。
