基于个体化靶向建模的前列腺肿瘤不可逆电穿孔术前消融仿真预测研究
2022-09-26江远亮季振宇
张 亮,徐 帆,王 威,江远亮,季振宇*
(1.空军军医大学生物电磁检测与智能感知陕西省重点实验室,西安 710032;2.解放军95825部队,湖北孝感 432000;3.中部战区总医院,武汉 430070)
0 引言
目前,前列腺癌已成为男性人群中第二大癌症类型[1],根治性前列腺肿瘤切除术是当前治愈前列腺癌的主要手段。前列腺周围包绕着丰富的对泌尿和性功能起重要调控作用的血管和神经系统,因此对肿瘤切除手术的精细程度要求较高,否则容易造成术后性功能和尿控功能障碍,进而给患者的生活质量造成巨大的影响。尽管常规肿瘤消融技术(例如射频微波消融术)已证实可以有效地消除肿瘤目标[2-4],但由于术中的热传导效应容易导致周边组织损伤、消融边界不明显等问题[5],其在前列腺肿瘤切除手术中的应用具有一定的局限性。因此,临床迫切需要新的前列腺肿瘤消融技术。
近几年,利用高压超短脉冲电场治疗肿瘤的消融技术引起了广泛关注[6],该技术可以对细胞膜造成不可修复的损伤,也就是不可逆电穿孔(irreversible electroporation,IRE),从而达到杀死肿瘤细胞的效果[7]。在治疗过程中,该消融技术无热损伤,且对血管、神经和细胞外基质的损伤显著低于肿瘤细胞,能够对功能性结构进行保留,对前列腺肿瘤这一类精度要求较高的消融手术具有较高的适用性。IRE消融肿瘤有效性的关键在于高压电脉冲作用靶器官区域范围的场强是否达到消融场强阈值,所以术前制订手术计划,确定治疗参数动态调控、治疗电极针排布方案十分关键[8-9]。但是由于组织器官结构的复杂性、组织介电特性参数的异质性以及电极针排布的多样性等因素,制订IRE消融术前治疗计划并不容易,因此如何进行IRE术前手术规划和如何有效进行消融预测备受研究者关注。Zhao等[10]针对生物活性组织在高频IRE治疗过程中电导率的变化规律进行研究,对IRE治疗过程中的动态参数调控具有指导意义。Stillström等[11]基于CT成像技术对IRE手术中电极阵列排布的精度进行分析研究。姚成果团队从IRE手术过程中的动态数值模拟到基于优化算法的IRE手术计划优化对IRE肿瘤消融技术进行了较为系统的研究探讨[12-14]。既往研究表明,通过进行术前消融电磁仿真模拟,可为IRE手术治疗规划提供有效参考,但现有基于电磁仿真进行IRE手术规划的研究主要集中在IRE手术过程中参数指标的变化规律分析,对于仿真过程中模型的构建关注较少。由于生物个体的差异性,不同手术对象的组织形态、组织指标参数会发生变化,使得基于电磁仿真进行IRE手术规划中的仿真模型也需要随手术个体发生相应改变。现有研究多采用特定对象作为分析模型,使得仿真分析结果与实际情况会产生一定差异,进而影响IRE手术规划。
基于此,本文针对前列腺IRE术前手术规划临床应用需求,主要通过构建个体化前列腺器官电磁仿真模型进行IRE消融仿真预测研究。首先利用CT/MRI影像断层数据通过Mimics、Geomagic等软件重建出患者个体前列腺组织的三维几何模型,对几何模型设置相应的组织介电特性参数构建个体化前列腺电磁模型,然后对该模型配置高压脉冲、电极排布等射频消融参数,最后对构建的电磁模型进行网格划分、有限元计算仿真。通过仿真结果对消融区域进行预测分析,从而提高IRE术前治疗方案的可靠性,降低手术风险。
1 消融区域仿真预测原理及方法
作为医学模拟形态学基础的生物组织几何模型,其真实性、单元质量和可操作性将直接影响仿真模拟结果,因此建立完整可靠的个体化器官靶向模型是前列腺肿瘤IRE术前消融仿真预测的关键。根据IRE治疗的物理原理,个体化器官靶向模型应结合患者的CT/MRI影像数据及前列腺组织的介电特性参数进行构建。构建完成后,根据模型中肿瘤的特征对消融参数进行配置并对IRE治疗方案进行术前消融仿真预测。如果仿真结果表明可以实现预期目标,则可以实施该方案;否则,需要一个新的预设方案。IRE治疗方案术前仿真预测基本流程如图1所示。其中电磁仿真的内容主要包含:消融目标组织的区域大小确定、电极阵列排布、消融电场阈值Eirrev确定、脉冲激励参数设置、肿瘤组织消融情况和肿瘤组织周围正常组织的损伤情况。其中,消融目标组织的区域大小已反映在模型中;肿瘤组织的消融情况可以通过肿瘤组织区域和有效消融区域的体积比来进行分析;肿瘤组织周围正常组织的损伤可以用模拟结果中正常组织损伤与肿瘤组织损伤的体积比来分析;消融电场阈值Eirrev和脉冲激励参数可参考相关实验结果和文献数据[10];电极阵列则需要根据患者个体自身情况进行排布。
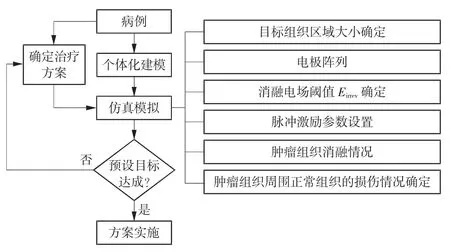
图1 IRE治疗方案术前仿真预测基本流程
电极阵列的排布放置可根据消融靶组织的区域大小和单对电极的有效作用区域来确定。基于消融电场阈值Eirrev和激励脉冲参数,先通过仿真确定目标组织中单对电极的有效作用区域,再根据电极的有效作用区域确定电极间距和插入深度。如果单对电极不能覆盖整个肿瘤组织,可以使用多对电极进行消融:根据单对电极的有效作用区域将消融目标组织划分为多个区域。根据消融目标组织区域的划分结果,将电极对填充到不同的划分区域单元中,并基于仿真观察消融效果。图2给出了电极阵列排布优化方法关键步骤示例。
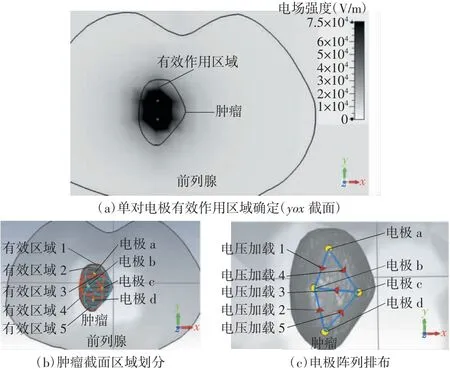
图2 电极阵列排布优化方法关键步骤示例
2 基于活性组织介电特性的个体化前列腺模型构建及电磁仿真
2.1 个体化前列腺电磁仿真模型构建
本文首先基于患者个体前列腺的CT/MRI图像数据构建了个体靶向模型,构建流程如图3所示。根据图3所示流程,本文采用前列腺肿瘤患者的CT/MRI图像进行三维重建。首先,在Mimics软件中导入患者前列腺组织的MRI序列扫描图像。除了感兴趣区(region of interest,ROI),序列扫描图像还包含大量需要处理的冗余区域,因此,一方面需要对扫描图像进行裁剪以突出需要处理的ROI,另一方面去除图像中多余部分以减少系统占用内存。其次,根据前列腺肿瘤与周围正常组织像素灰度值的差异,选择灰度阈值进行分割,进一步区分不同组织部位的区域。由于生物组织的异质性,CT/MRI成像得到的图像灰度分布也不均匀,导致灰度阈值在分割后建立的图像蒙板中出现许多空洞,通过这种蒙板重建的实体组织模型是不连续的。因此,需要在形态学操作中使用闭运算来消除图像蒙板中的孔洞,填充轮廓线中的裂缝,消除图像中的不连续区域,以保证组织模型在空间上的连续性。最后,使用Geomagic软件对处理后的前列腺区域曲面(.stl文件)进行优化,进一步使用精密曲面、自动曲面、等高线、构造曲面片、修复曲面片、构造网格、拟合曲面等命令生成最终的个体化靶向前列腺模型(包含肿瘤实体模型)。图4给出了整个模型构建过程中关键步骤示例。
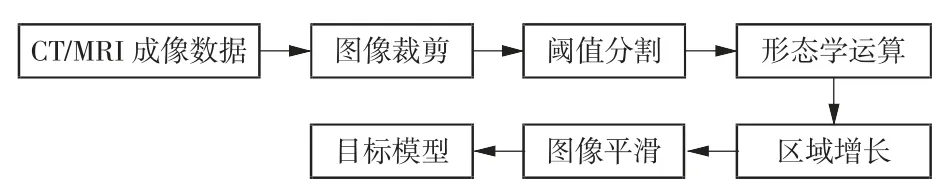
图3 个体靶向模型构建流程示意图
靶向模型中组织的介电特性参数是IRE术前消融预测的重要参数,也是构建前列腺器官电磁仿真模型的重要参数。在仿真研究过程中,可以采用文献中的组织介电特性参数[10],并将其导入之前构建的实体模型中,最终完成包括组织形态结构和介电特性参数在内的个体化靶向电磁模型的构建。图5为基于个体病例的MRI成像数据构建的个体化前列腺组织三维仿真模型。

注:(a)~(c)箭头所示为前列腺。
2.2 电磁仿真配置
(1)IRE消融物理场描述。
IRE消融过程中,组织内部的物理场可以使用如下公式进行描述:

式中,j为组织内部电流密度矢量;q0为组织内电荷量;E为组织内部电场矢量;σ为组织的电导率;φ为组织的电位。通过对公式(1)进行数值离散化处理,即可在软件中实现IRE消融过程的物理场仿真模拟。
(2)仿真参数设置。
在COMSOL软件中,对图5(b)所示的前列腺仿真模型中组织、消融电极针、脉冲电压源进行仿真参数设置,主要包括介电特性、消融电极针的尺寸及介电参数、高压电脉冲参数。本文利用1例临床实施前列腺肿瘤IRE治疗患者的病例资料进行建模(如图5所示),根据其MRI图像构建个体化前列腺组织器官模型,肿瘤形态呈不规则哑铃型分布于前列腺内侧2块区域。采用IRE治疗的消融区即为肿瘤区域。消融电极针外形根据临床消融针(即圆柱体与圆锥体组合而成)的外形进行建模,尺寸初始值如下:电极针直径d=1 mm,电极针插入组织的暴露长度h=20 mm,电极材料为不锈钢。仿真时根据肿瘤的尺寸确定消融电极针的布针方式,布针规则方法如图2所示。本研究中,根据前列腺肿瘤模型尺寸,共设置了5根消融电极针,前列腺组织及消融电极针的介电特性参数见表1。
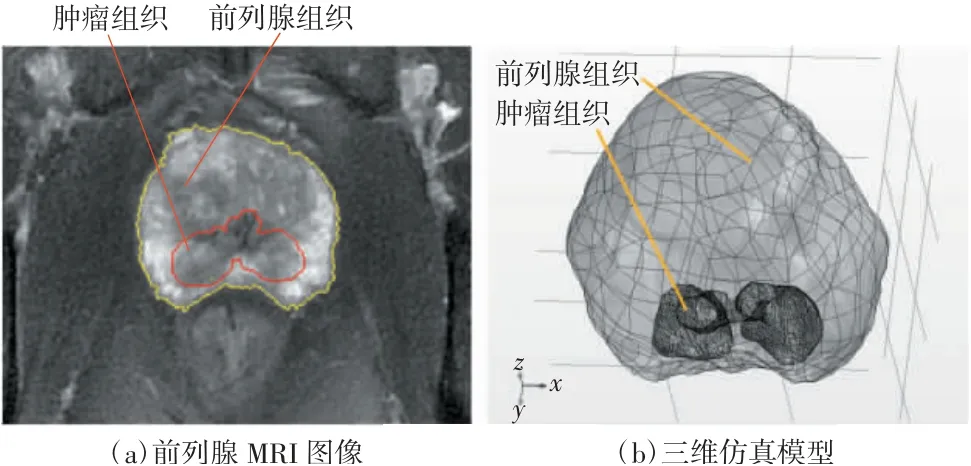
图5 个体前列腺组织三维仿真模型
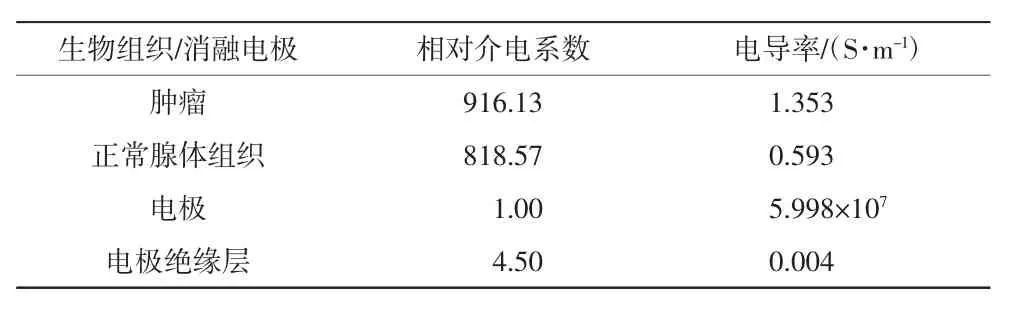
表1 激励电压在125 kHz时,生物组织和消融电极的模型介电特性参数设定
电极激励端口采用复合电极脉冲电压激励,其工作频率为125 kHz,脉冲峰值为±2 kV,子脉冲宽度为3 μs。仿真时将复合脉冲的一个周期定义为分段函数pw1(t),子脉冲宽度为3 μs,同时在过渡区进行平滑处理,使复合脉冲更接近实际脉冲效果。公式(2)给出了仿真中采用的符合电极脉冲的脉冲函数,具体如下:
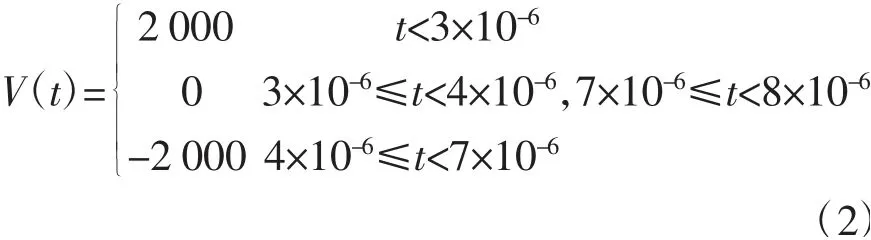
式中,V(t)为脉冲电压。同时,图6给出了仿真中采用的电极脉冲的脉冲信号。
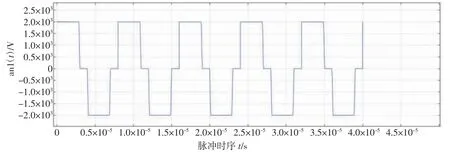
图6 软件中设定的复合脉冲
(3)电磁场仿真边界条件。
如公式(3)所示,脉冲电场下组织内部的电场分布控制方程满足Laplace方程:

设电极针中呈正极性的电极针的电位φ+为U0(U0为所施加的脉冲电压),电极中呈负极性的电极针的电位φ-为0(负极接地)。未与电极接触的肿瘤组织外部边界条件为电绝缘。肿瘤组织及正常组织的初始电位值均为0。
(4)MATLAB联合COMSOL的仿真分析。
根据实际需要,仿真中电极脉冲电压加载主要通过MATLAB联调进行,以实现电极对同步馈电以及脉冲电场叠加效果。通过MATLAB软件对复合脉冲电压激励源参数的输入端进行控制,实现不同消融电极针两两间施加脉冲电压,同时在最终的仿真结果中呈现所有施加电压共同作用下的组织内部电场强度分布结果。本文通过两两配对分别加载复合脉冲电压激励,形成7组电场叠加的复合电场分布作用于肿瘤区域,得到最终7组电场叠加后组织的电场分布。
2.3 消融区域观测指标
(1)电场分布。
IRE技术主要是基于电极针激励的电场对肿瘤进行消融,因此组织内部的电场区域分布是观测并确定消融区域的主要因素之一。单对电极作用下可以结合消融电场阈值和电场分布直接确定肿瘤消融区域。而多对电极作用下的电场区域分布则是每一对激励电极施加电压后共同作用下形成的组织内部的合电场区域分布。图7给出了5对电极作用下的每对电极激励电场分布、消融有效区和最终的电场分布示意。其中图7(a)~(e)分别为不同电极对应于图2单独配对下激励的电场分布,根据消融电场阈值Eirrev可确定单对电极的消融区域。图7(f)为图7(a)~(e)中所有单对电极激励的电场进行叠加后的合电场分布。当需要消融的肿瘤组织区域超过单对电极消融区域时,需要用多对电极组合完成消融,此时消融区域主要由图7(f)所示的合电场分布来确定。
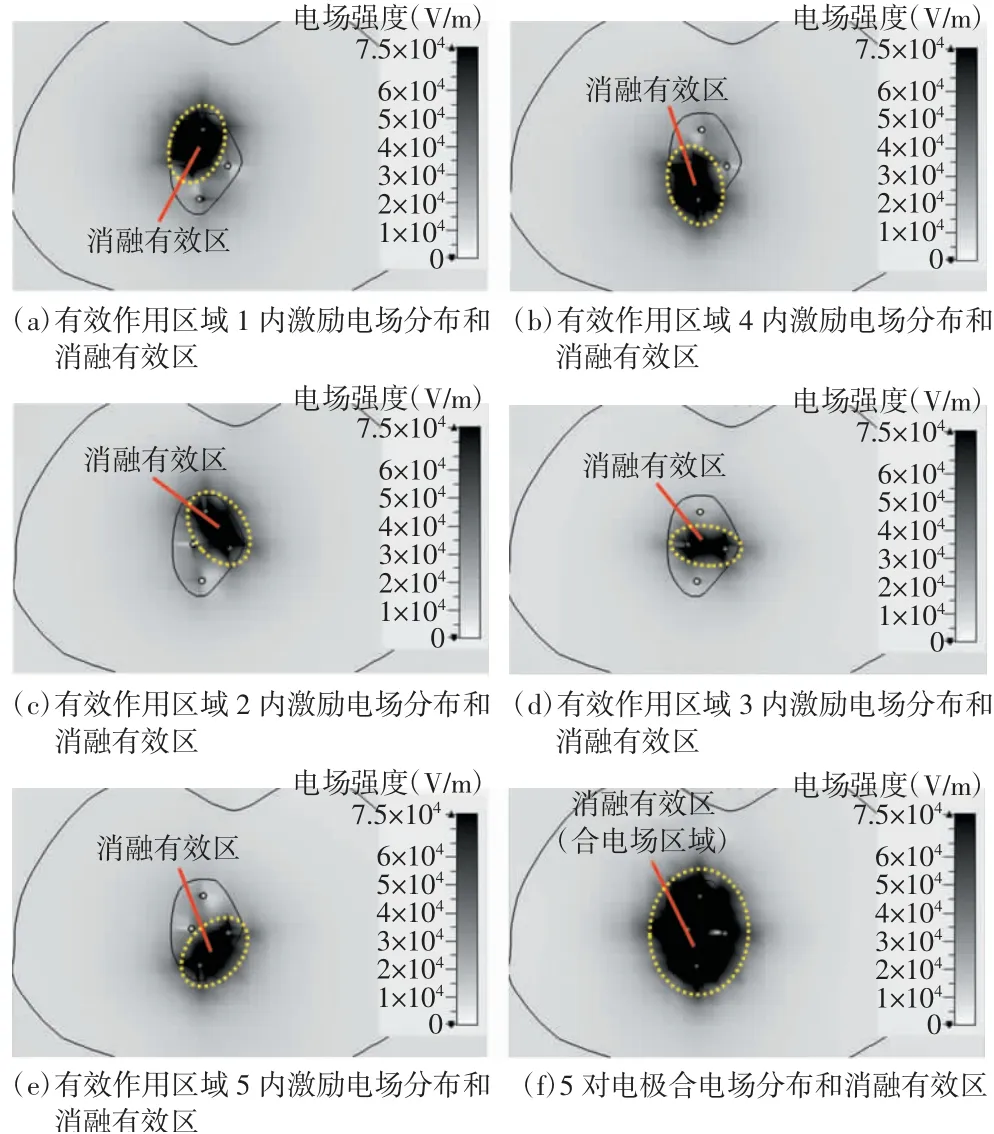
图7 5对电极作用下的每对电极激励电场分布、消融有效区(黄色虚线区域)和最终的消融有效区(合电场区域)
(2)消融电场阈值Eirrev。
消融电场阈值Eirrev是进行消融预测的关键观测指标,消融区域通常根据消融电场阈值Eirrev进行划定,高于消融电场阈值则为消融有效区,反之则为消融无效区,如图7所示。当组织内电场强度大于电场阈值时,认为组织细胞会形成IRE,从而达到组织消融的目的。由于恶性肿瘤通常呈现浸润性生长,具有边界不清的特征,所以进行IRE消融时,应适当扩大肿瘤包块的消融区域。本文依据临床数据选择消融电场阈值Eirrev为1 500 V/cm。
3 结果
3.1 前列腺肿瘤区域消融电极排布仿真
3.1.1 单对电极电场分布
基于消融电场阈值Eirrev,首先确定单对电极在个体病例中的消融区域。图8给出了不同电极间距d下单对电极的有效消融范围。通过对比图8中各图片可以发现,适当增加电极间距d有利于扩大有效消融范围,但随着d的不断增加,有效消融区域会产生分裂。当电极间距d≤12 mm时,可保证其消融范围的完整性。因此,当肿瘤最大截面上的边界间距≤12 mm时,可根据肿瘤区域范围选择合适的电极间距d;当肿瘤最大截面上的边界间距>12 mm时,电极间距的选择需要综合考虑有效消融区域的完整性和有效性。基于图8的仿真结果可以确定电极间距d的最佳取值为12 mm。
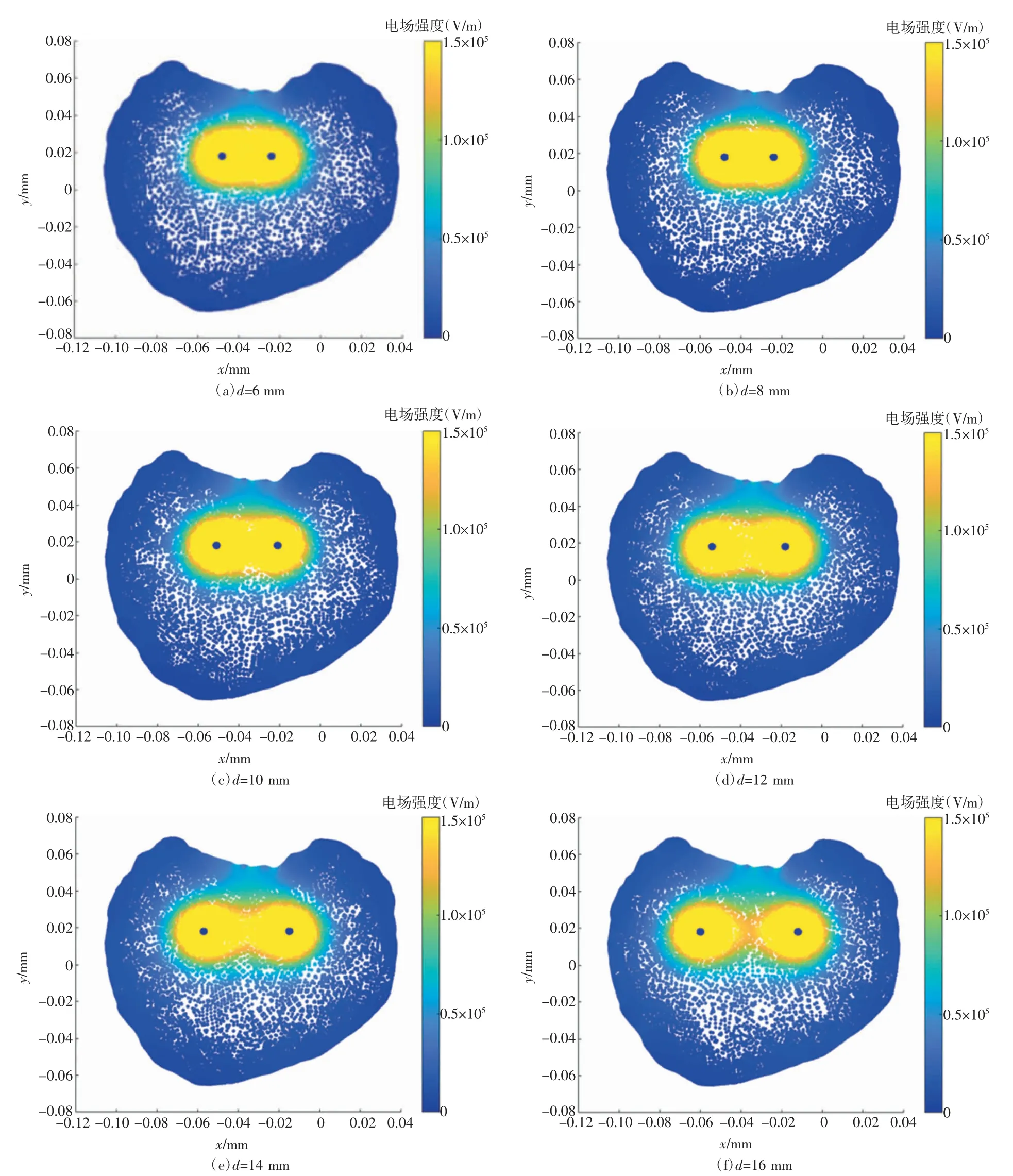
图8 不同电极间距d下单对电极的有效消融范围示意图
3.1.2 多对电极电场分布
根据单对电极最佳间距d和有效消融范围仿真结果,本文个体病例模型中的肿瘤区域需要多对电极进行作用才能覆盖。因此,基于单对电极有效消融范围对模型中的肿瘤区域进行多对电极排布。图9给出了基于手术实践的多针排布模型仿真后的电场仿真分布结果。从图9中可以看出,对1~5号电极进行排布后激励的有效消融区域能够较好地覆盖肿瘤区域且不会过度损伤正常组织,表明了该电极排布方案的可行性。
3.2 前列腺肿瘤区域消融仿真验证
图10给出了本文中的个体病例实施IRE手术前以及术后1周前列腺组织区域的MRI成像结果,其中图10(a)是消融手术前肿瘤的最大截面MRI图层,图10(b)是消融手术后同一MRI图层的消融区域,可以看到术后的消融区域基本覆盖了原肿瘤区域,消融手术结果良好。同时对比图10(a)、(b)发现消融后的前列腺组织和消融区域较消融前有所扩张,主要是由于术后消融边缘处的组织会产生水肿,在MRI图层上会形成阴影,从而扩大了相应的图像区域。
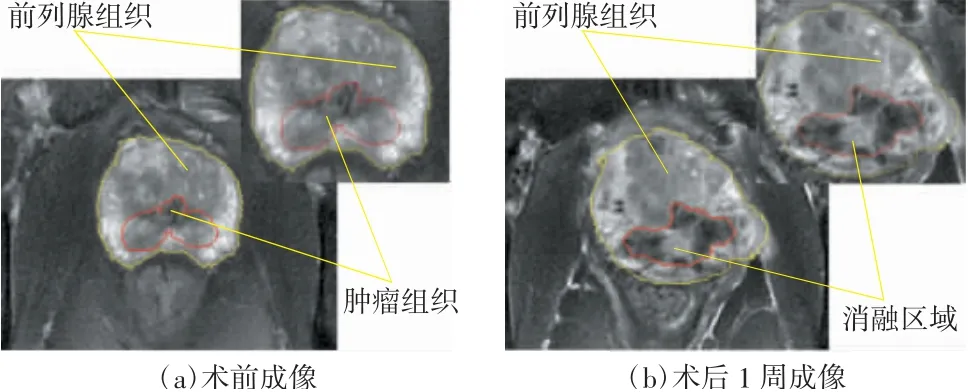
图10 个体病例IRE术前和术后1周前列腺组织区域的MRI成像结果
为了便于进一步对比,根据IRE术后的前列腺部位MRI成像结果,在COMSOL中构建前列腺肿瘤IRE术后模型。根据多对电极排布后的术前模型仿真结果,分别在术前模型和术后模型中截取不同深度的截面进行对比,如图11所示。通过对比可知,术前模型中基于电场分布的消融有效区域(黄色区域)和术后模型中的消融区域(红色区域)基本一致,表明通过仿真可以较好地对IRE手术消融区域进行预测评估,基于仿真模型的预测和评估方法的可行性和有效性得到验证。
4 结语
构建精确的个体化病例模型是对前列腺肿瘤IRE术前消融进行准确仿真预测的一个重要因素,因此要重点关注以下两方面:一是基于MRI/CT成像数据构建的模型要足够精确。根据图4所示步骤,个体化病例模型主要根据成像结果中前列腺肿瘤与周围正常组织像素灰度值的差异来进行构建,因此首先需要准确识别病例MRI/CT成像结果中各阴影部分所代表的具体含义,然后根据识别内容进行阈值分割。二是模型中各组织的介电特性参数要足够准确。目前前列腺肿瘤消融模型中各组织的介电特性参数主要依据于文献和个体组织离体测量,其中,离体测量对组织样本的采样时间和采样尺寸有一定要求,且在进行前列腺肿瘤IRE手术过程中,组织的介电特性也可能会发生相应变化,导致最终术后结果偏离预测。因此,探寻一种合适的组织介电特性参数实时在体测量方法,对于进一步提高IRE术前仿真预测准确度具有十分重要的意义。
本文提出了一种基于个体化靶向建模的前列腺肿瘤IRE术前消融仿真预测方法并开展了相关研究。该方法首先基于CT/MRI的成像数据构建个体化前列腺肿瘤消融模型;然后依据消融阈值在模型上进行电极阵列排布:先确定单对电极的有效作用区域和作用效果,如果需要多个电极对进行消融,应根据单个电极对的有效作用区域划分肿瘤截面,并根据区域划分结果确定电极阵列排布方案;最后对模型进行仿真,依据仿真结果中的电场分布确定最终消融有效区域并进行消融效果预测。运用该方法对前列腺肿瘤IRE消融病例进行仿真预测并与术后结果进行对比,表明了该预测方法的准确性与可靠性。本文在进行仿真预测时,个体化靶向模型的介电特性参数默认为定值,而实际在IRE手术过程中,组织的介电特性可能会随着癌变组织的破坏而发生相应改变,进而影响预测结果。因此,在今后的研究中将着重研究IRE过程中组织介电特性的测量与表征,并将其融入个体化靶向模型构建中,以进一步完善仿真预测方法并推动其向实践应用发展。
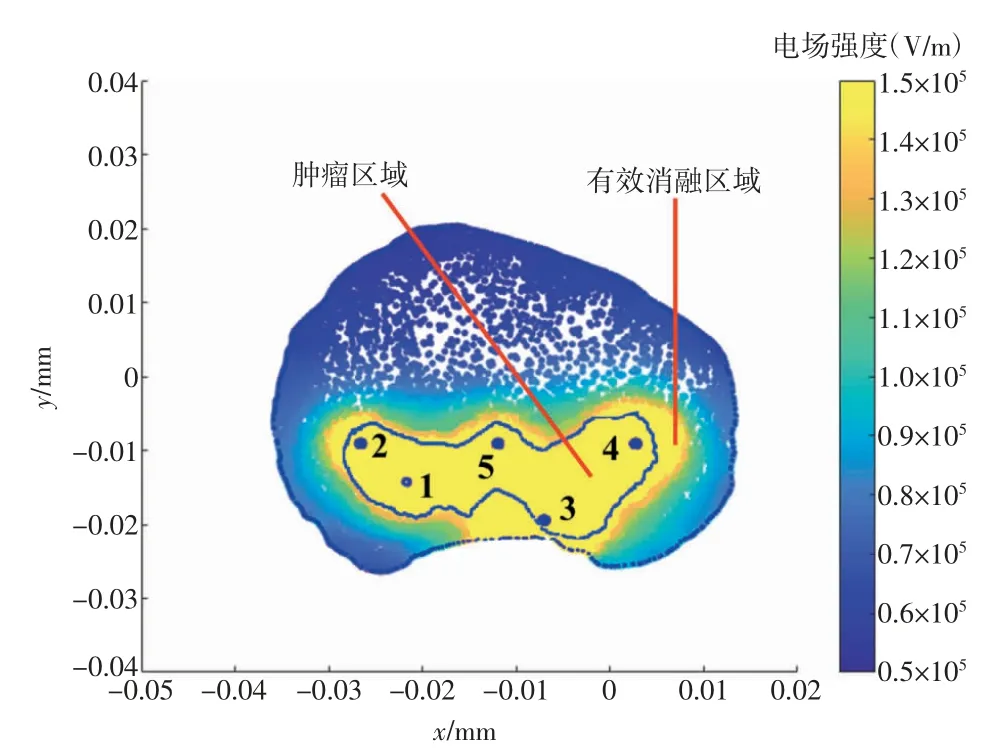
注:1~5对应1~5号电极。
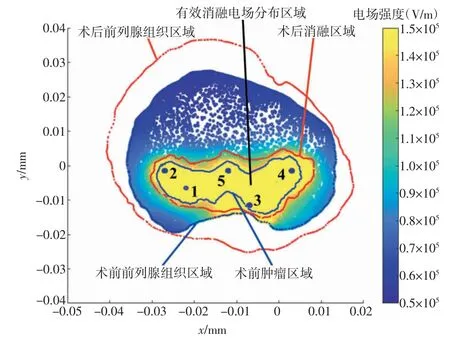
注:1~5对应1~5号电极。
