真实胆管弧度下胆道支架联合125I粒子条治疗恶性梗阻性黄疸的剂量学研究
2022-09-26贾鹏飞
贾鹏飞,赵 辉
恶性梗阻性黄疸(malignant obstructive jaundice,MOJ)是胆管、胆囊、胰腺及壶腹部晚期恶性肿瘤的常见并发症,尽管手术切除是MOJ的主要治疗方法,但大多数患者在诊断时已失去了手术的机会[1]。因此胆道支架是目前被广泛认可和接受的治疗方法,但肿瘤生长或胆管内皮细胞增生会导致支架闭塞或狭窄,支架通畅时间相对较短是该方法的主要问题[2-4]。125I粒子条可持续杀灭肿瘤组织并抑制胆管内皮细胞的增生,因此胆道支架联合125I粒子条技术不仅可以解除胆道梗阻,还可以延长支架的通畅时间[5-6]。目前大部分关于粒子条剂量学的研究均将粒子条定义为直线排列,尚无关于真实胆道弧度对胆道支架联合粒子条剂量学影响的报道,本研究通过评估真实胆管弧度下粒子条与直线排列粒子条的剂量学差异,为胆道支架联合粒子条治疗MOJ的有效性及安全性提供参考。
1 材料与方法
1.1 研究对象
本研究回顾性分析南通大学附属医院临床诊断为MOJ且行胆道支架联合125I粒子条置入术的患者18例。收集的一般资料主要包括性别、年龄、原发病、植入粒子数、支架长度、粒子条推算弧度及靶区体积。
1.2 主要仪器设备
放射性粒子源植入治疗计划系统KL-SIRPS-3D V6.0(北京天航科霖科技发展有限公司);三维治疗计划系统Eclipse10.0.42(美国瓦里安公司);数字减影血管造影机Innova IGS540(美国通用电气公司);16排螺旋CT Discovery CT590RT(美国通用电气公司);放射性125I密闭籽源6711型(中国原子高科股份有限公司);自膨式镍钛记忆合金编制网状胆道支架ZBS08060、ZBS08080[巴德医疗科技(上海)有限公司]。
1.3 靶区及危及器官的勾画
1.3.1 真实胆管组 患者在术后1~4周行腹部CT扫描,并将CT图像导入放射性粒子源植入TPS,利用TPS在CT图像上勾画出靶区一、靶区二、肝动脉、肝门静脉、下腔静脉、主动脉、右肾动脉、右肾静脉、左肾动脉、左肾静脉、肝、胃、十二指肠、胰腺、脊髓、右肾、左肾。靶区一的勾画方法:以支架表面为外界,在CT图像上逐层进行勾画,勾画范围为胆管梗阻段;靶区二的勾画方法:以支架表面为内界,外放5 mm为外界,在CT图像上逐层勾画,勾画范围也为胆管梗阻段。见图1。

图1 靶区及危及器官勾画示意图
1.3.2 直线模型组 利用三维治疗计划系统Eclipse制作30 cm×30 cm×30 cm的水模体,CT值定义为0 Hu。然后将水模体以DICOM格式导入至放射性粒子源植入TPS,利用该TPS制作出18个直线模型,每个模型均包含两个靶区,靶区一为直径8 mm,长度为对应患者的胆管梗阻段长度的圆柱体;靶区二为靶区一外放5 mm的空心圆柱体。且每个模型装载的粒子数均为对应患者的植入粒子数。见图2。

图2 直线模型示意图
1.4 计划设计
参考外放疗剂量及放射性粒子植入剂量转换经验公式[7-8],均将处方剂量定义为72 Gy。将真实胆管组的18例患者及直线模型组的18个模型的粒子活度分别设置为0.5、0.6、0.7、0.8、0.9、1.0 mCi,计算生成剂量体积直方图(dose volume histograms,DVH)。
1.5 数据采集
1.5.1 推算弧度:
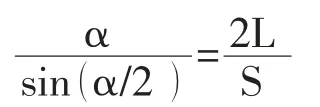
先将患者的术后CT图像进行三维重建,后根据解超越方程求得推算弧度α,式中L为粒子条长度,S为粒子条两端粒子的直线距离。
1.5.2 靶区 剂量体积参数:D80%、D90%、D100%、V80%、V90%、V100%、V200%;其中,DX%是指X%靶区体积接受的剂量;VΧ%是指靶区接受X%处方剂量的体积百分比。
适形指数(conformity index,CI)[9]评价剂量分布的适形度:CI=(VT,ref/VT)×(VT,ref/Vref),式中VT、VT,ref和Vref分别为靶区体积、靶区接受处方剂量的体积和处方剂量包含的总体积,最理想的CI是1,适形指数为1时,说明处方剂量正好覆盖靶区,而靶区外体积接受的剂量均低于处方剂量,CI越大说明靶区内接受处方剂量体积越大而靶区外接受处方剂量的体积越小。
靶区外体积指数(external index,EI)[10]描述靶区外接受超过处方剂量体积占靶区体积的百分比,最理想的EI是0,EI为0时,说明靶区外组织接受剂量均小于处方剂量;EI越大,说明靶区外接受处方剂量体积越大。
均匀指数(homogeneity index,HI)[10]描述剂量分布 均 匀 性,HI(VT,ref-VT,1.5ref)/VT,ref×100%,式 中VT,1.5ref为靶区接受150%处方剂量的体积,最理想的HI为100%,HI越大说明靶区剂量分布越均匀。
1.5.3 危及器官 危及器官一般被分为串行和并行器官,本研究中所涉及的串行器官为各类血管和脊髓;并行器官包括肝、胃、十二指肠、胰腺、右肾、左肾。采用最大剂量(maximum dose,Dmax)评价串行器官。肝、左肾和右肾采用平均剂量(mean dose,Dmean)进行评估。胃和胰腺的评价指标分别为Dmax和D33%。十二指肠的评价指标为V30Gy及V50Gy。其中,DX%是指危及器官体积接受的剂量,VΧGy是指危及器官接受超过ΧGy照射剂量的体积。
1.6 统计学分析
统计学分析采用SPSS22.0软件。正态性分布的计量资料以(±s)表示,组间比较使用配对t检验。若不满足正态性,组间样本比较使用非参数Nemenyi检验。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料
18例患者中,女10例,男8例,平均年龄为68.6岁。平均植入粒子数为14颗;11例患者采用8 mm×60 mm胆道支架,7例患者采用8 mm×80 mm胆道支架;平均推算弧度为115.60°;靶区一、靶区二的体积分别为(7.56±1.31)cm3、(11.71±2.19)cm3。患者的一般资料见表1。
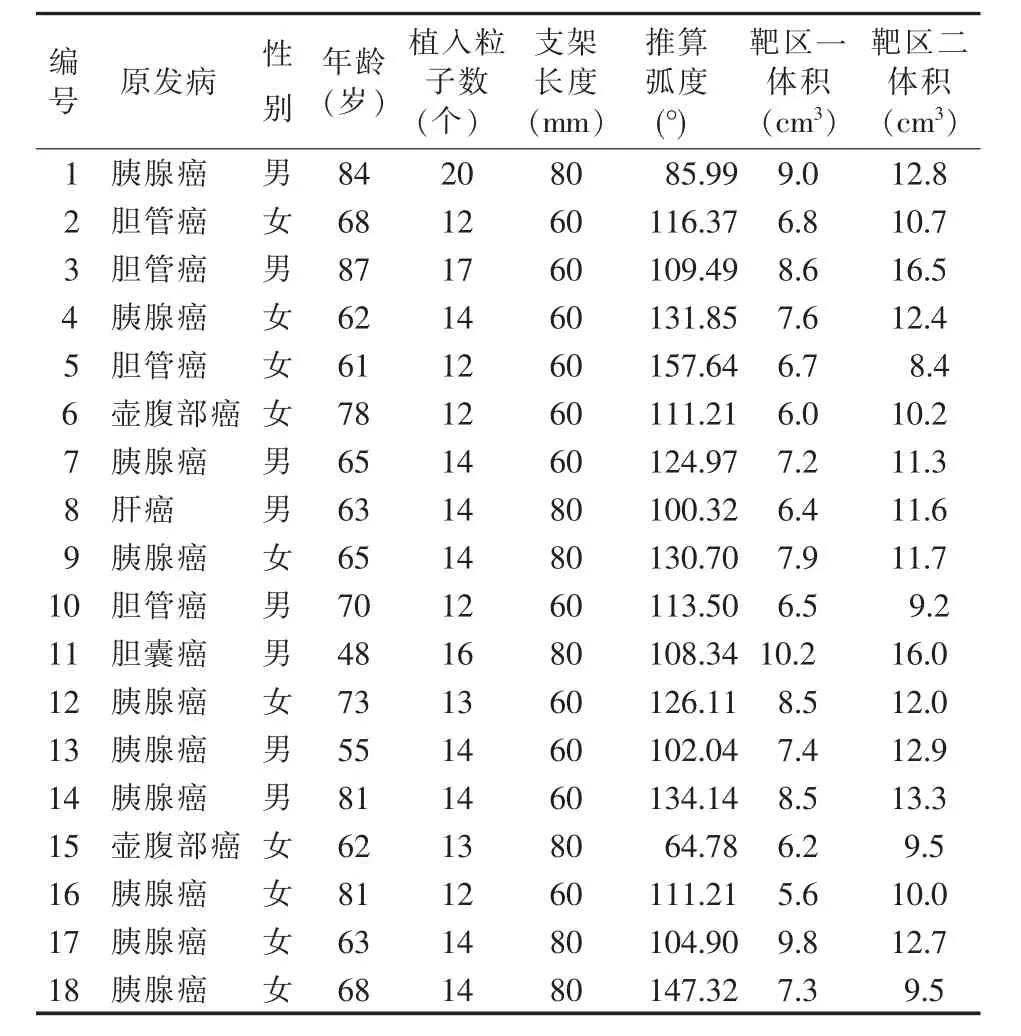
表1 18例患者的一般资料
2.2 靶区的剂量学比较
见表2至表7。

表2 靶区剂量参数比较(粒子活度1.0 mCi)
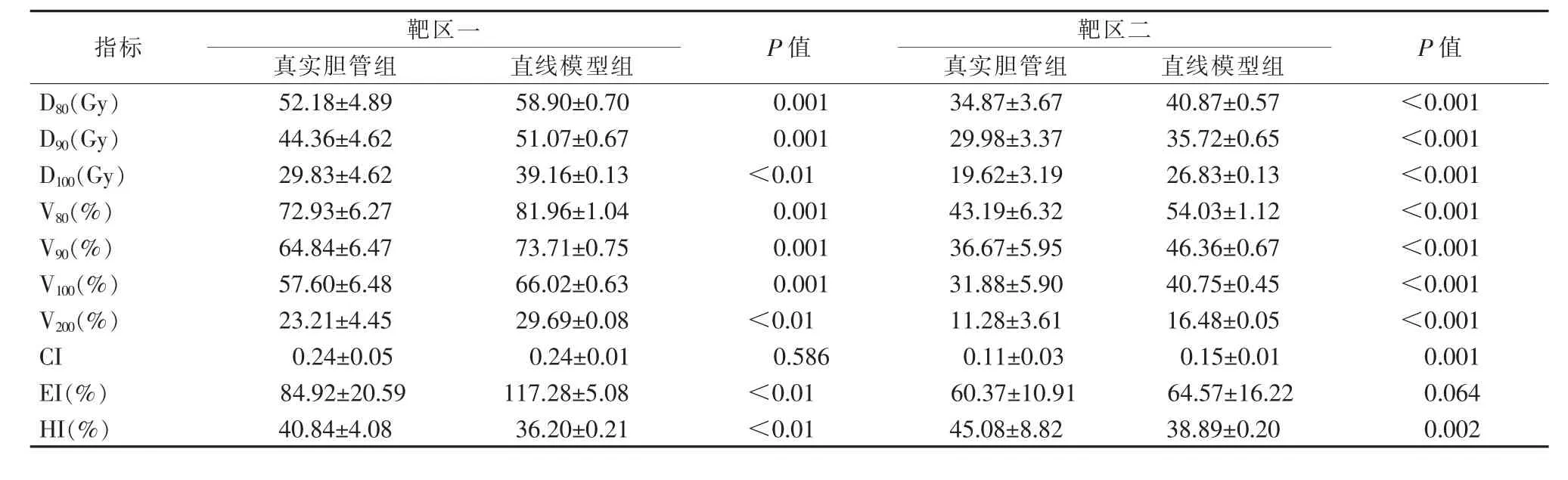
表7 靶区剂量参数比较(粒子活度0.5 mCi)
2.2.1 剂量体积参数 真胆管弧度对胆道支架联合125I粒子条的剂量差异统计结果表明靶区的D80%、D90%、D100%、V80%、V90%、V100%、V200%差异均有统计学意义(P<0.05),胆管弧度会导致靶区剂量指标(D80%、D90%、D100%)及体积指标(V80%、V90%、V100%、V200%)有一定程度的下降。
对于靶区一,胆管弧度会导致D80%、D90%、D100%分别下降6.72~13.43 Gy、6.71~13.4 Gy、9.33~18.67 Gy,且下降幅度随粒子活度的增加而增大;V80%、V90%、V100%分别下降0.38%~9.03%、1.11%~8.87%、2.57%~8.89%,且下降幅度随粒子活度的降低而增大;V200%下降6.48%~9.90%,粒子活度为0.8 mCi时,V200%的下降幅度最大。
对于靶区二,胆管弧度会导致D80%、D90%、D100%分别下降6~12 Gy、5.74~11.48 Gy、7.21~14.4 Gy,且下降幅度随粒子活度的增加而增大;V80%、V90%、V100%、V200%分别下降8.21%~12.95%、9.69%~13.04%、8.87%~12.97%、5.2%~8.87%,且下降幅度波动较小,与粒子活度无明显相关。
2.2.2 适形指数CI两靶区的CI均较低。真实胆管组的靶区一CI为0.24~0.27,且粒子活度为0.5~0.8 mCi时,两组差异无统计学意义(P>0.05);当粒子活度为0.9 mCi或1.0 mCi时,两组虽有差异,但差异较小。真实胆管组的靶区二CI为0.11~0.23,且与直线模型组的差异均有统计学意义(P<0.05),真实胆管弧度会一定程度地降低靶区二的适形度。
2.2.3 靶区外体积指数EI两靶区的EI均较差,真实胆管组的靶区一EI为84.92%~306.29%,EI随粒子活度的增加而增加,且两组间差异有统计学意义(P<0.05);胆管弧度会降低靶区外接受超过处方剂量体积,EI下降幅度为32.36%~101.73%,且下降幅度随粒子活度的增加而增大。对于靶区二,真实胆管组的EI为60.37%~184.65%,EI随粒子活度的增加而增加,且粒子活度在0.6~1.0 mCi时,两组差异有统计学意义(P<0.05),EI下降范围为12.42%~27.61%,下降幅度不大。
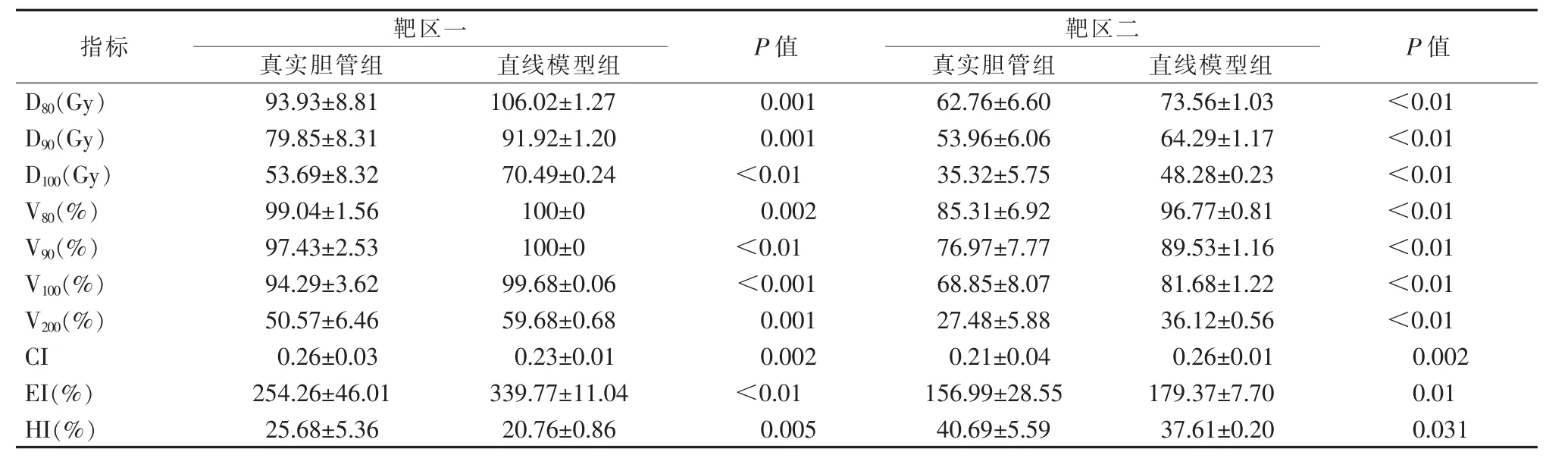
表3 靶区剂量参数比较(粒子活度0.9 mCi)

表4 靶区剂量参数比较(粒子活度0.8 mCi)

表5 靶区剂量参数比较(粒子活度0.7 mCi)
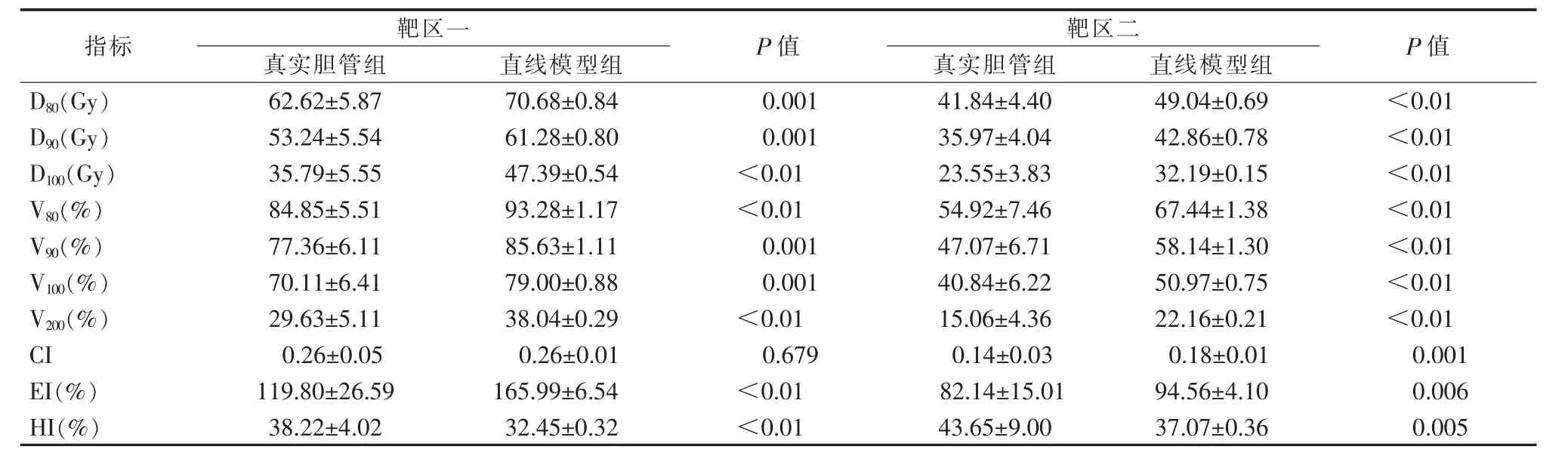
表6 靶区剂量参数比较(粒子活度0.6 mCi)
2.2.4 均匀指数HI两靶区的HI均较差,真实胆管组的靶区一HI为20.66%~40.84%,HI随粒子活度的增加而减小,且两组差异有统计学意义(P<0.05);真实胆管弧度能一定程度的提高靶区一的HI,升高幅度为3.99%~6.27%。对于靶区二,真实胆管组的HI为38.93%~45.08%,HI也随粒子活度的增加而减小;当粒子活度为0.5、0.6、0.9、1.0 mCi时,两组间差异均有统计学意义(P<0.05),且升高幅度均在7%以下。
2.3 危及器官的剂量学分布
2.3.1 串行器官 肝动脉及肝门静脉的照射受量较 高,Dmax分 别 为105.28~210.56 Gy、257.53~515.05 Gy。当粒子活度为0.8 mCi时,有1例患者的肝动脉Dmax为1 894.47 Gy,而V200Gy仅为0.1 cm3;有2例患者的肝门静脉Dmax分别为1 952.48 Gy、1 832.74 Gy,而V200Gy分别为0.5 cm3、0.1 cm3。当粒子活度为0.7 mCi时,有1例患者的肝动脉Dmax为1 657.66 Gy;有2例患者的肝门静脉Dmax分别为1 708.42 Gy、1 603.65 Gy。下腔静脉、主动脉、肾动脉及肾静脉的照射受量较低,均低于90 Gy。脊髓的照射受量更低,平均照射受量均低于1 Gy。
2.3.2 并行器官 胃的Dmax为80.25~160.50 Gy,且随粒子活度的增大而增加;当粒子活度为0.8 mCi时,有2例患者的Dmax分别为1 850.79 Gy、194.64 Gy,而V74Gy分别为2.2 cm3、0.7 cm3;当粒子活度为0.7 mCi时,2例患者的Dmax分别为1 619.38 Gy、170.32 Gy,而V74Gy分别为1.8 cm3、0.5 cm3。十二指肠的V30Gy、V50Gy分别为5.29~13.81 cm3、2.11~7.09 cm3,其中当粒子活度为0.7 mC和0.8 mCi时,仅有1例患者的十二指肠V50Gy超过10 cm3。胰腺的D33%为9.00~17.99 Gy;当粒子活度为0.7 mCi、0.8 mCi时,D33%超过10 Gy的患者分别为7、8例,D33%超过40 Gy的患者均为1例。肝肾的照射受量较低,其中左肾受量几乎为0 Gy。见表8、9。
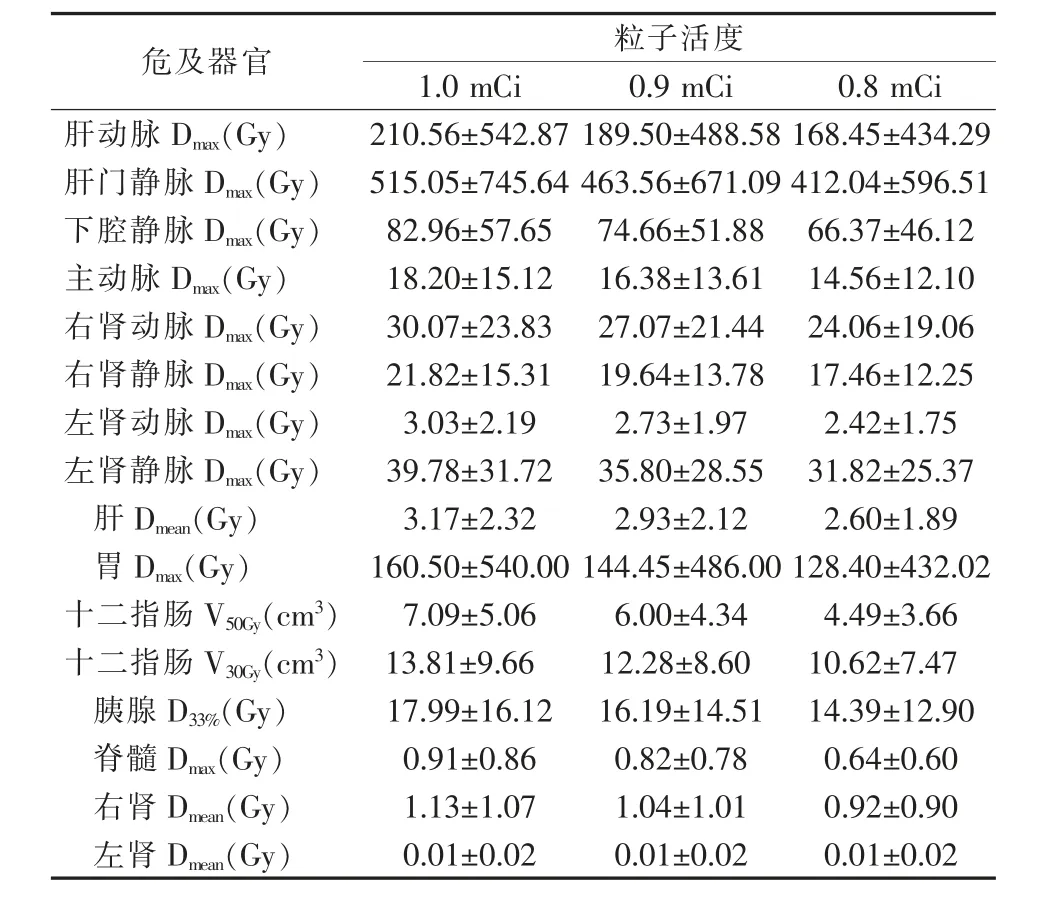
表8 危及器官的剂量参数(一)
3 讨论
放置金属支架可缓解MOJ,时因胆道梗阻引起的症状,但肿瘤生长或胆管内皮增生导致支架再狭窄。有专家认为在对MOJ恶性梗阻性黄疸患者行PTCD后,在引流管内置入铱-192粒子源行内放疗,有助于延长胆道支架的通畅时间[11]。表明应用胆道支架联合125I粒子条、粒子支架技术及在粒子支架置入的基础上联合药物灌注与光动力治疗也有一定的疗效[12]。
当患者出现MOJ时,若不能行手术治疗或为转移性胆管癌可行姑息性放疗。其中原发病灶及淋巴引流区给予45.0~50.4 Gy,单次剂量为1.8~2.0 Gy,若患者一般状况良好,耐受程度高,可将处方剂量增至60 Gy甚至更高,但治疗中要考虑到正常组织的耐受量[7]。本研究将处方剂量定义为72 Gy,与专家共识中的处方量相同。单颗粒子的高剂量分布图形似一颗苹果[13],当粒子条成直线排布时,粒子与粒子之间只有较少的剂量重叠。在临床上,由于胆管梗阻形态复杂或生理弧度的存在,导致植入后的粒子条存在一定的弧度,甚至存在多处弯曲的情况出现,且这种弯曲程度无法预测。而当粒子排布出现角度时,必然会导致粒子间的剂量重叠,且重叠范围的大小与角度相关。本研究通过术后CT图像的三维重建,复现真实胆管弧度下粒子条的弯曲情况,且在剂量计算后与直线排布粒子条模型进行剂量比较,从而评估真实胆管弧度对粒子条剂量学的影响。
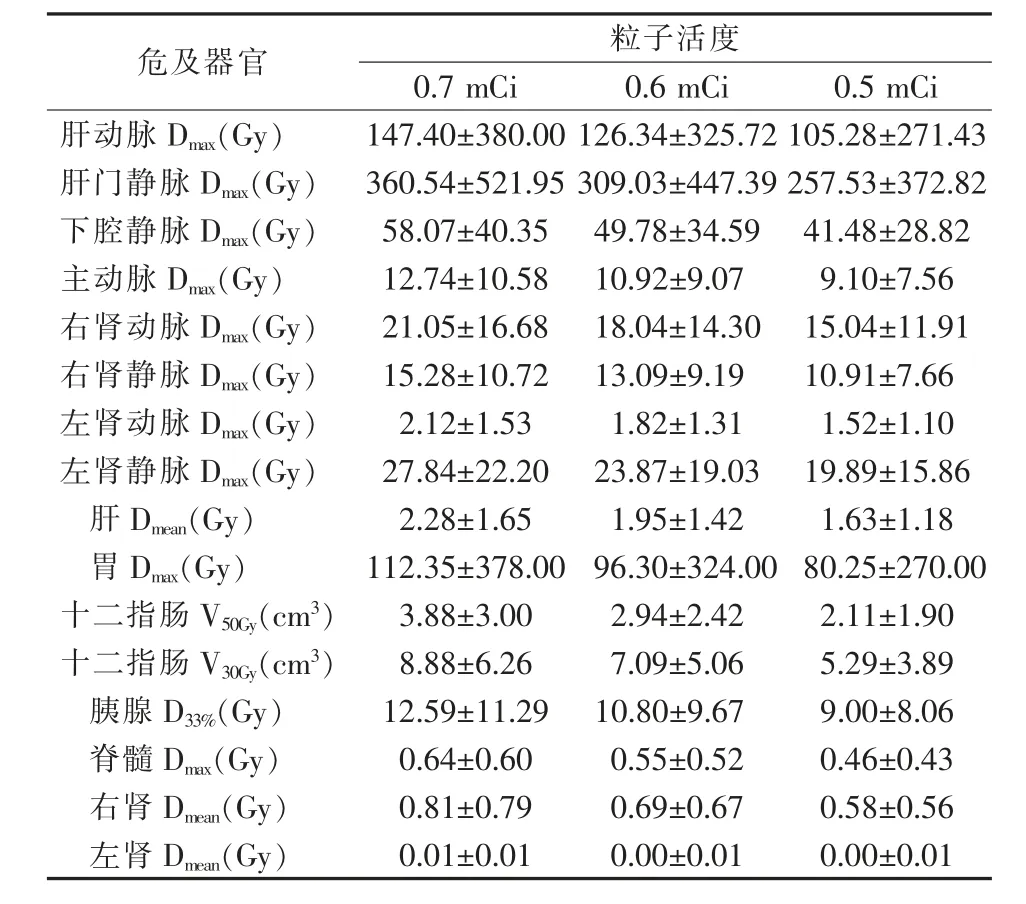
表9 危及器官的剂量参数(二)
本研究沿支架表面进行勾画梗阻段胆管,并定义为靶区一,主要是为了评估在胆管壁无明显增厚或明显占位的情况下靶区的照射受量情况;后以支架表面为内界,外放5 mm为外界,对胆管梗阻段进行勾画,并定义为靶区二,主要是为了评估在胆管壁有明显增厚或占位的情况下靶区的照射受量情况,其中靶区二的外放边界参考了胆管癌外放疗临床靶区勾画方法及食道粒子支架靶区勾画方法[14-16]。结果显示,与直线模型组相比,胆管弧度会降低两靶区的D80%、D90%、D100%,且下降幅度与粒子活度成正比,也会降低两靶区的V80%、V90%、V100%、V200%。郝亮等[17]研究了模拟胆管内不同弧度125I粒子链的剂量学分布情况,结果发现粒子条弧度改变对剂量分布的影响较大,与本研究结果类似。本研究结果发现,当使用粒子活度为0.8 mCi的粒子条时,真实胆管组靶区一的D90、V90分别为70.98 Gy、93.81%,能满足美国近距离治疗协会推荐的双90%定律[18]。而即使使用活度最大(1.0 mCi)的粒子条,靶区二的照射受量也不能满足最低标准。本研究还增加了对适形指数CI、靶区外体积指数EI、均匀指数HI的统计,结果发现胆管弧度虽然会降低靶区的适形度,但也能改善靶区的均匀度及靶区外的受照体积,出现这种现象可能是由于粒子条的弯曲使粒子与粒子的剂量有了更多的重叠。两靶区的CI、EI、HI均较差,主要原因为粒子条位于支架壁的一侧,而非自梗阻段中央通过,且粒子的照射范围较为有限。
胆道支架联合125I粒子条技术是一项较为安全的技术[19]。粒子条常位于胆道支架壁的一侧,从而导致粒子条同侧的胆管壁累积剂量明显高于对侧,但在本研究的随访过程中并未发生因过量照射而导致的胆道穿孔或瘘。王娟等[20]的动物实验也证实了在放射损伤方面该技术是较为安全的,他们将不同剂量的125I粒子植入家兔胆总管鞘内,在处方剂量定为80、120、160 Gy时,60 d内家兔均未出现胆管穿孔、出血、胆漏,管腔无增厚、缩窄,周围组织及脏器未见明显的放射性损伤,仅有胆管黏膜上皮层不同程度的损伤。本研究还收集了各个粒子活度下危及器官的照射受量。所有剂量限值依据2010年美国医学物理师协会Task Group101报告进行评价[21],并通过经验公式EQD2≈D/2(晚反应组织)[18]将报告中的剂量限值转换成放射性粒子植入的剂量限值。结果显示所有串行器官(肝动脉、肝门静脉、下腔静脉、主动脉、肾动脉、肾静脉、脊髓)的Dmax平均值均未超过剂量限值(720 Gy)。其有1例患者肝动脉、2例患者肝门静脉的Dmax超过720 Gy,有发生血管瘤的风险,但另一评价指标V200Gy均低于10 cm3。本研究中肝血管出现最大剂量过高的主要原因是肿瘤已经侵犯至肝左、右胆管,粒子条也置放入肝左、右胆管内,因此粒子条紧邻肝血管,但在随后的随访过程中,这些患者均未出现血管瘤的并发症。并行器官中胃的Dmax为80.25~160.50 Gy,当粒子活度为0.6 mCi及以上时,胃的Dmax超过90 Gy,有发生胃溃疡的风险。胃Dmax的平均值偏高的主要原因是有2例患者在行CT扫描前饮用了大量的清水,胃腔明显扩大,且粒子条位置较为靠上;但实际生活中患者胃腔不会一直保持扩大状态,因此胃的实际Dmax会比统计结果低。并且这2例患者胃的高量受照体积较小,V74Gy均低于10 cm3。十二指肠V50Gy、V30Gy的平均值均未超过剂量限值,当粒子活度为0.7 mCi时,有1例患者的V50Gy超过10 cm3,但在之后的随访过程中也未出现十二指肠溃疡或穿孔。胰腺的D33%为9.00~17.99 Gy,平均值均在剂量限值之内(40 Gy),当粒子活度为0.7和0.8 mCi时,均有1例患者超过40 Gy,主要原因是该患者为胰腺癌术后,正常胰腺体积较小。粒子条对肝脏影响较小,肝脏照射剂量远低于剂量限值,且由于粒子条离肾脏较远,肾脏照射受量较低。
本研究的不足之处是所应用的胆道支架直径均为8 mm,未能考虑到胆管支架直径在其他尺寸时,胆管弧度对剂量学的影响。由于样本量较少,未能将真实胆管组按支架长度、肿瘤的增生分型或胆管梗阻部位分亚组进行研究分析,期望在未来的研究中扩大样本量,进一步分析。由于技术和时间的问题,直线模型组的模型均是按照植入支架的尺寸、粒子条的粒子数及梗阻段的长度在TPS上进行模拟,今后可利用真实的支架和粒子条制作出线状支架,从而减少误差的影响因素。粒子支架即在支架周围装载放射性125I粒子,不仅可以迅速、有效地缓解狭窄,还可以有效减小肿瘤体积,如:胆道粒子支架和食管粒子支架。目前食管粒子支架的剂量学研究较多,有研究者发现粒子间距、支架直径及粒子活度是影响食管粒子支架径向累积剂量分布的主要因素[22]。期望将来会有更多关于胆道粒子支架的剂量学研究,阐明胆管弧度下胆道粒子支架的剂量学分布情况。
与直线模型相比,胆管弧度会降低肿瘤靶区的剂量体积参数及适形度,但能改善靶区的均匀度及靶区外的受照体积。对于胆管壁无明显增厚的MOJ,植入粒子活度为0.8 mCi的粒子条,胆管EQD2可达到60 Gy。
