纳米金比色法检测乙肝病毒核酸综合性实验
2022-09-23温聪颖张瑞巧李怡敏曾景斌
温聪颖, 李 想, 张瑞巧, 李怡敏, 周 亭, 曾景斌
(1.中国石油大学(华东)化学化工学院,重质油国家重点实验室,山东 青岛 266580;2.青岛市农业科学研究院,山东 青岛 266100)
0 引 言
近年来,纳米金由于具有独特的光学性质、良好的化学稳定性及生物相容性,且易于修饰等特点受到了广泛关注[7-9]。基于其发展的比色技术操作简便省时、无需大型仪器,在现场即时检测中展现出巨大的应用潜力。其检测原理主要是基于被检对象引起纳米金状态改变导致溶液变色,从而用裸眼即可判读检测结果[10-12]。基于此,本文以乙肝病毒核酸为模式目标物,利用纳米金技术设计了一种病毒核酸的比色检测法。该法通过在纳米金上分别修饰与乙肝病毒核酸两端互补的DNA序列,利用其与目标核酸通过碱基互补配对实现杂交,形成纳米金团聚,使颜色发生从红色到蓝色的明显变化,从而实现比色检测。该实验从材料制备、表征、修饰到应用,内容完整并具有较强的可操作性,融合了材料、化学、生物、医学等多个学科的理论知识以及相关的实验方法和技术,并紧密联系科学前沿,具有较高的综合性、交叉性和前瞻性,适合在相关专业高年级本科生中开设,有利于高校综合型创新人才的培养。
1 实验设计
图1展示了本实验的流程、实施方法和预期目标。实验开始前,学生通过参观实验室、查阅文献、交流讨论等方式,熟悉实验内容;然后实施实验,包括纳米金的制备、DNA修饰及病毒核酸检测;接着进行数据整理、分析和总结,并撰写论文;最后以学术答辩的形式进行考核。本实验通过模拟科学研究的一般步骤,让学生体验一套完整的科研训练过程,能够极大地培养学生的综合实验能力及科研素养。
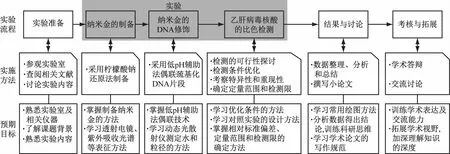
图1 实验流程、实施方法和预期目标
2 实验部分
2.1 仪器与试剂
试剂:氯金酸、氯化钠、六水合氯化镁、二水合柠檬酸三钠、甲酰胺、盐酸、硫酸葡聚糖钠盐(M.W.500000)、三羟甲基氨基甲烷(Tris)等购自国药集团化学试剂有限公司,乙肝病毒DNA片段(5′-ATA CCA CAT CAT CCA TAT AAC TGA AAG CCA-3′)、丙肝病毒RNA反转录DNA片段(5′-ATC TCC AGG CAT TGA GCG GGT TTA TCC ACG A-3′)、艾滋病毒RNA反转录DNA片段(5′-CCA TGA ATT TAG TTG CGC CTG GTC CTT TAA-3′)、乙肝病毒互补DNA片段1(HS-5′-AAA AAA AAAAAATGG ATG ATG TGG TAT-3′)、乙肝病毒互补DNA片段2(HS-5′-AAA AAA AAAAAATGG CTT TCA GTT ATA-3′)购自Invitrogen公司。
仪器:电子天平(奥豪斯仪器有限公司,PWS224ZH/E),离心机(湖南湘仪实验仪器开发有限公司,TGL-16),动态光散射仪(Malvern ZetaSizer Nano ZS),透射电镜(日本电子株式会社,JEM-1400),紫外-可见分光光度计(日本岛津公司,UV-2450),控温磁力搅拌器(爱博特科技有限公司,ZNCL-TS),恒温振荡器(上海精宏实验设备有限公司,THZ-312),超声波清洗器(昆山市超声仪器有限公司,KQ2200)。
2.2 纳米金的制备
采用柠檬酸钠还原法制备纳米金[13]:取5 mL 24.28 mmol/L的氯金酸溶液,用超纯水定容至100 mL,转移至烧瓶中,在搅拌下加热回流;待溶液煮沸后向其中迅速加入10 mL新配制的柠檬酸三钠溶液(38.8 mmol/L),继续加热15 min,在此过程中溶液颜色由黄色变为黑色,最后呈现酒红色,停止加热,存于4 °C待用。
2.3 乙肝病毒核酸靶向的纳米金生物探针构建
采用低pH辅助法[14-16],通过巯基与金的配位作用,在纳米金上修饰巯基化的乙肝病毒核酸的互补DNA片段,两种片段的修饰方法一致,具体为:在500 μL上述纳米金溶液中加入15 μL 100 μmol/L的巯基化DNA片段,涡旋混匀,在恒温振荡器上室温反应5 min,再加入10 μL柠檬酸缓冲溶液(500 mmol/L,pH3.0),继续反应30 min,将产物离心洗涤3次以除去未反应的DNA片段(离心条件:12 000 r/min,15 min);最后将产物分散到500 μL Tris缓冲溶液(20 mmol/L,pH 8.0)中,分别命名为探针1、探针2,存于4 °C待用。
2.4 纳米金生物探针用于乙肝病毒核酸的检测
2.4.1 检测的基本方案
医疗机构是引起医源性感染的重要场所。医院消毒是预防医源性感染的重要措施,消毒与灭菌质量监测又是评价消毒与灭菌效果的重要手段[1]。为了解新乡市医疗机构消毒与灭菌质量状况和相关部门进行医院消毒管理和监督工作提供理论依据,现回顾性分析新乡市2015-2017年各级医疗机构的消毒监测结果,现统计如下:
首先配制杂交液,在20 mmol/L、pH 8.0 Tris缓冲溶液中加入甲酰胺、硫酸葡聚糖和MgCl2,使其终浓度分别为20%、16%和3.75 mmol/L,再根据实验需求添加一定量的NaCl,然后将制备的两种纳米金探针与杂交液以体积比3∶3∶4(探针1∶探针2∶杂交液)混合配成检测工作液,取200 μL工作液与100 μL待检样品混合,在恒温振荡器上反应,根据实验需求选择反应温度和时间,待反应结束后观察颜色变化并测定紫外-可见吸收光谱。
2.4.2 检测条件的优化
采用单因素变量法优化反应温度、时间和盐度,所有阳性组乙肝病毒核酸的浓度都设定为0.1 μmol/L,所有空白对照组均加入等体积的超纯水,每组实验均重复3次。
反应温度的优化:杂交液中NaCl浓度设定为0.3 mol/L,反应分别在25、30、35、40、45 °C下进行,各反应1.5 h后测定吸收光谱,确定最佳温度。
反应时间的优化:杂交液中NaCl浓度设定为0.3 mol/L,反应温度设定为最佳温度,分别孵育1、5、10、30、50、70、90 min后,测定吸收光谱确定最佳时间。
检测体系盐度的优化:杂交液中NaCl浓度分别为0.3、0.4、0.5、0.6 mol/L,在最佳温度下孵育最佳时间,测定吸收光谱确定最佳盐度。
2.4.3 检测方法的特异性实验
在优化后的最佳反应条件下(反应温度30 °C;反应时间5 min;NaCl浓度0.4 mol/L),分别检测0.1 μmol/L的乙肝病毒DNA、0.01 mmol/L丙肝病毒的反转录DNA、0.01 mmol/L艾滋病毒的反转录DNA,并采用超纯水作为空白对照组,每组实验重复3次,反应结束后测定吸收光谱。
2.4.4 检测方法的重现性实验
在优化后的最佳反应条件下(反应温度30 °C;反应时间5 min;NaCl浓度0.4 mol/L),用同一批次制备的探针分别检测5组0.1 μmol/L的乙肝病毒DNA,测定吸收光谱,计算组内相对标准偏差;采用不同批次制备的探针分别测定5组0.1 μmol/L的乙肝病毒DNA,测定吸收光谱,计算组间相对标准偏差。
2.4.5 不同浓度的乙肝病毒核酸的检测
在优化后的最佳反应条件下(反应温度30 °C;反应时间5 min;NaCl浓度0.4 mol/L),分别检测5×10-3、1×10-2、5×10-2、1×10-1、5×10-1、1 μmol/L的乙肝病毒DNA,测定吸收光谱,以光谱信号对浓度进行线性拟合得到标准曲线,同时测定11组空白样品的信号,计算标准偏差。
3 结果与讨论
3.1 纳米金的表征
实验所制得的纳米金溶液呈现酒红色(见图2(a)),最大吸收波长为525 nm(见图2(b))。由透射电镜图(见图2(c))可以看出,纳米金尺寸均匀,具有良好的单分散性,没有发生团聚,粒径统计(见图2(d))显示纳米金的平均粒径为(14.4±1.7)nm。
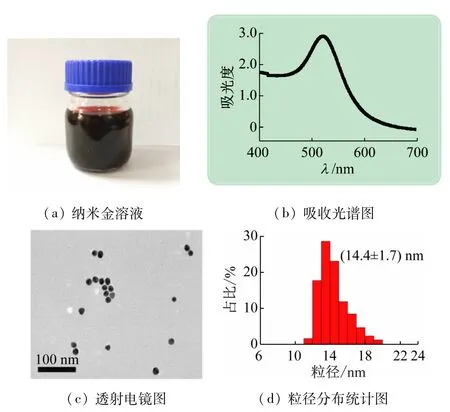
图2 纳米金的表征
3.2 纳米金生物探针的表征
在低pH环境下,DNA能够快速吸附到纳米金表面,进而通过巯基与金的配位作用实现偶联[14],本实验中与乙肝病毒核酸互补的两段DNA序列的5′端各加入12个腺嘌呤(A)作为连接臂,目的是为了减少后续检测时反应的空间位阻。纳米金偶联DNA后,水合粒径增大,如图3(a)所示,未修饰的纳米金水合粒径约为15 nm,修饰DNA后水合粒径增至22 nm左右(探针1、2)。纳米金和探针溶液中分别加入1 mol/L NaCl,纳米金迅速变蓝(图3(b),①),表明纳米金发生团聚,而探针1和探针2依然保持酒红色(图3(b),②、③),与纳米金原液相比几乎没有明显颜色变化(图3(b),④),说明探针1、2在高盐度的环境下仍然保持较好的单分散性。这是因为纳米金主要是通过彼此间的静电斥力稳定存在溶液中,当加入大量盐时,会屏蔽纳米金表面的电荷,进而发生团聚;而在纳米金表面修饰上DNA后,由于DNA对纳米金的稳定作用,使其在高盐度环境中也不会团聚[17-18]。纳米金探针水合粒径的增大及稳定性的提高证明DNA被成功修饰到纳米金表面。进一步通过透射电镜和吸收光谱进行表征,如图3(c)~(f)所示,两种探针均保持良好的单分散性,与未修饰的纳米金相比(图2(b)、(c)),尺寸和吸收光谱都没有明显的变化,表明修饰过程并未造成纳米金团聚,也没有改变纳米金的光学性质。
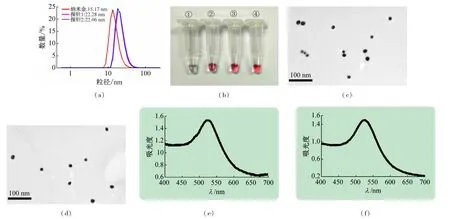
图3 (a)纳米金、探针1、2的水合粒径;(b)纳米金及探针的稳定性测试:①~③依次为纳米金、探针1、2加入1 mol/L NaCl的照片,④纳米金原液的照片;(c)、(d)探针1、2的透射电镜图;(e)、(f)探针1、2的吸收光谱图
3.3 纳米金生物探针用于乙肝病毒核酸检测的原理及可行性验证
检测原理示意图如图4(a)所示,探针1、2遇到目标DNA片段时,会通过碱基互补配对原则进行杂交反应,从而缩短纳米金颗粒间的距离进而发生团聚,纳米金溶液从酒红色变成蓝紫色,这样就实现了目标病毒核酸的可视化检测。对该方案的可行性进行了验证:纳米金生物探针用于阳性样品(含有0.1 μmol/L的乙肝病毒核酸)检测时,溶液颜色变成了蓝紫色,而空白样品(不含乙肝病毒核酸)保持酒红色(图4(b)),相应的吸收光谱显示空白组的吸收光谱没有发生明显变化,最大吸收波长依然在525 nm左右,而阳性组最大的吸收峰红移至590 nm左右(图4(c));透射电镜表征显示空白组的探针呈现单分散状态,而阳性组的探针出现较严重的聚集状态,更直观地展示了纳米金探针与目标DNA杂交后引起的团聚反应(图4(d)~(e))。以上实验结果表明该检测方案切实可行,后续采用590 nm处吸收值与525 nm处吸收值的比值(A590/525)作为检测信号。
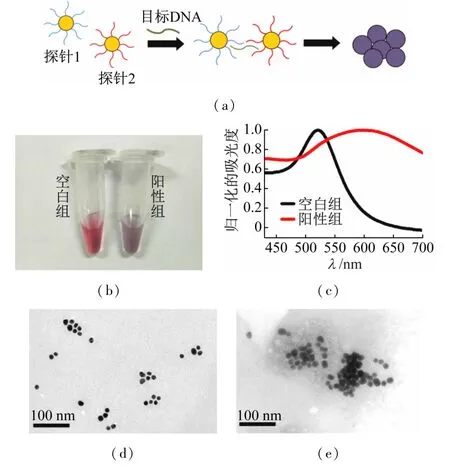
图4 (a)纳米金生物探针用于乙肝病毒核酸检测原理的示意图;(b)空白组和阳性组的照片;(c)空白组和阳性组的吸收光谱图;(d)空白组的透射电镜图;(e)阳性组的透射电镜图;阳性样品里含有10-7 mol/L的乙肝病毒核酸,空白样品中加入等体积的超纯水
3.4 最优检测条件的探讨
对检测过程中的孵育温度、反应时间、NaCl浓度进行了优化,结果如图5所示。随着反应温度的升高,信噪比(阳性信号与空白信号的比值)先增大后减小,在30 °C时达到最大值(图5(a)),这是因为升高温度有助于提高反应速率,但温度过高也可能会导致DNA解链,故选用30 °C作为最佳反应温度;而反应时间对检测信号影响不大(图5(b)),说明该反应速度很快,为了保证反应充分,选择5 min作为最佳反应时间;DNA的杂交需要一定的离子强度,如图5(c)所示,NaCl的添加浓度为0.4 mol/L时,信噪比最大,故在检 测体系用0.4 mol/L的NaCl保持离子强度。

图5 检测条件的优化(柱状图上方给出的是阳性组信号与空白组信号的比值,误差线=±标准偏差(重复3次))
3.5 检测的特异性与重现性
将该方法用于丙肝病毒的反转录DNA和艾滋病毒的反转录DNA的检测,结果如图6所示,即使非目标DNA的浓度高出乙肝病毒DNA100倍时,仍不能产生明显的信号,均与未加DNA的空白样品相差不大,这说明该方法具有良好的特异性。进一步利用同一批次的纳米金探针进行组内重复性实验、不同批次的纳米金探针进行组间重复性实验,得组内相对标准偏差为0.51%,组间相对标准偏差为0.85%,表明该方法重现性较好(见表1)。
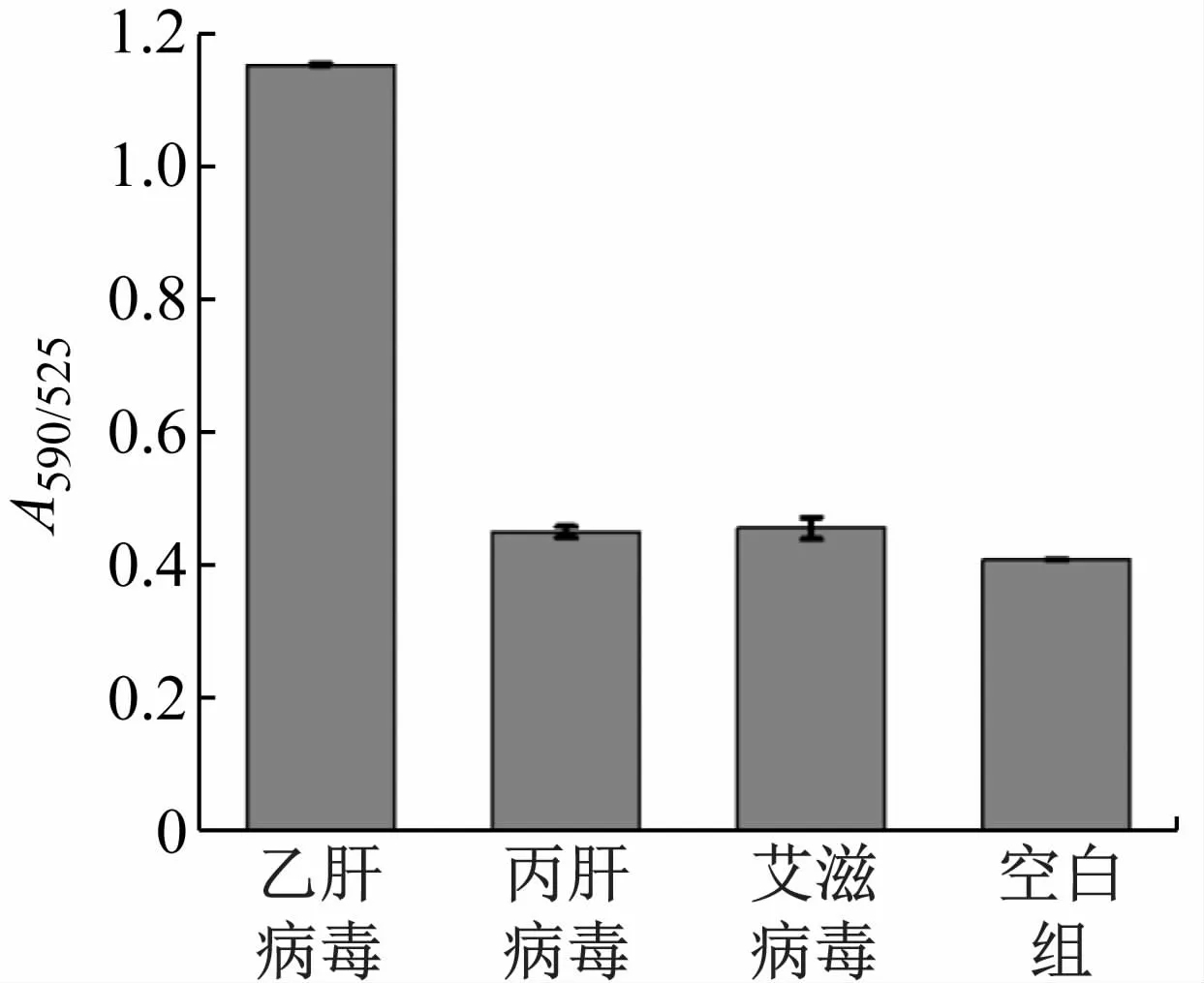
图6 纳米金生物探针检测不同病毒核酸和空白样品所得的信号值
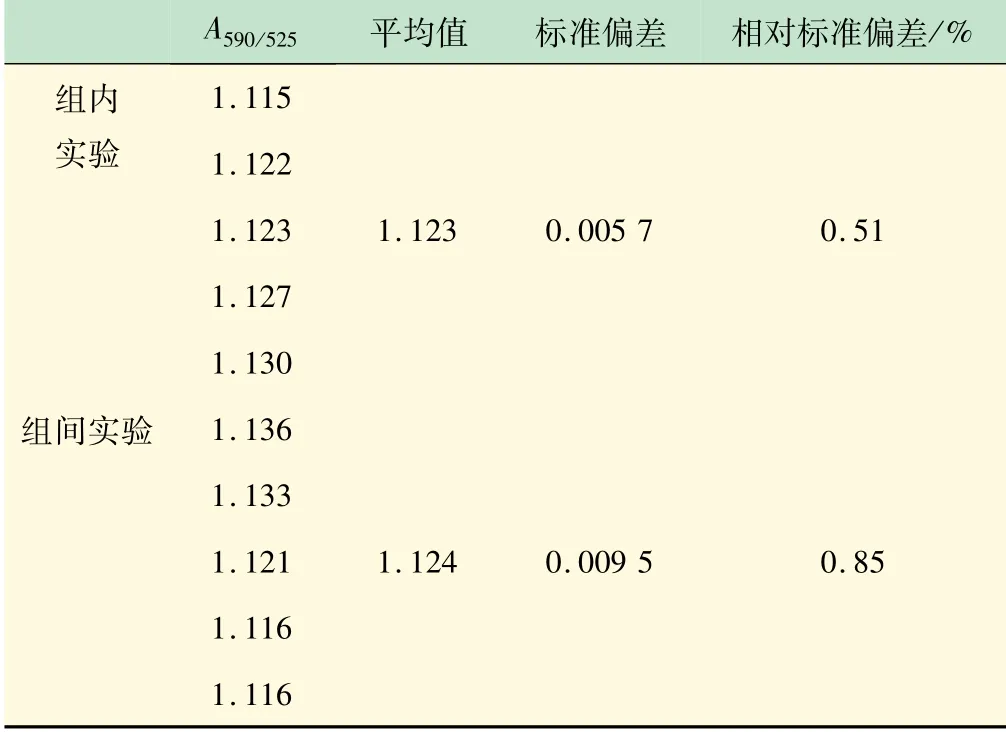
表1 本方法的组内及组间重现性
3.6 检测的定量范围及检测限
用该方法检测不同浓度的乙肝病毒DNA,所得信号随着目标DNA浓度的增大而增大(见图7),在5~1 000 nmol/L范围内具有良好的线性关系。进一步测定11组空白样品的信号,得平均值为0.411,标准偏差为0.004 3。以空白样品信号的平均值与其3倍标准偏差的和为可测量的最小检测信号[19],将最小检测信号代入到标准曲线的方程中,算出检测限为0.66 nmol/L。
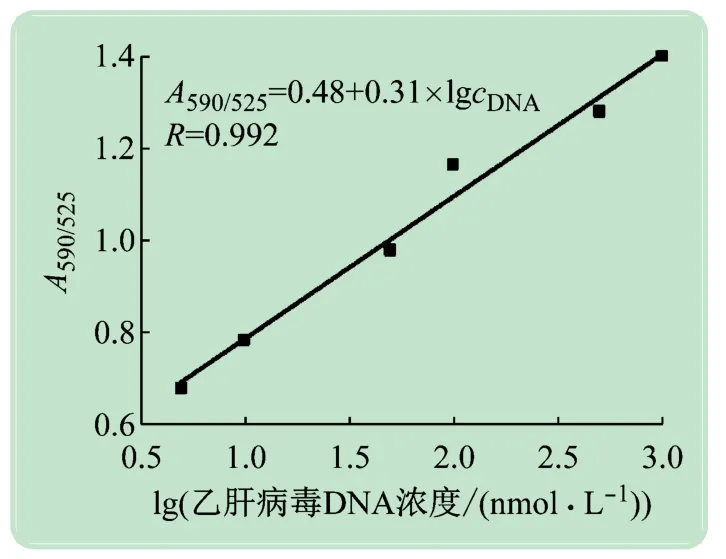
图7 纳米金生物探针用于乙肝病毒核酸检测的标准曲线
4 结 语
本实验基于纳米金技术构建了可以识别乙肝病毒核酸的生物探针,进而通过杂交反应,形成纳米金团聚,产生颜色变化,实现了乙肝病毒核酸的简便快速检测。实验涉及材料、化学、生物、医学等多个学科的理论知识以及相关的实验方法和技术,具有较强的综合性和交叉性,且立足学术前沿,围绕病毒检测等社会热点问题,在我校吸引了大批化学、材料等相关专业的学生开展实验。教学效果显示学生对实验项目怀有极大的热情,能够充分发挥其自身的主观能动性,圆满完成课题。本实验从文献调研到实验实施再到论文撰写和答辩,基本涵盖了科学研究的一般步骤,能够让学生体验一套完整的科研训练过程,从而极大地提高综合实验能力和科研素养,助力复合型人才和创新型人才的培养。
