基于芯片筛选螺原体感染中华绒螯蟹血细胞的免疫microRNAs
2022-09-23欧江涛蒋启程周刻焱栾筱琪王资生张启焕
欧江涛, 蒋启程, 周刻焱, 柳 巧, 栾筱琪, 王资生, 张启焕
(盐城工学院海洋与生物工程学院,江苏盐城 224051)
中华绒螯蟹()俗称河蟹,是我国特有的优质淡水虾蟹养殖品种之一,也是我国重要的水产经济蟹种,具有较高的营养价值。随着中华绒螯蟹水产养殖业的集约化大规模高速发展,导致水体环境状况急速恶化,病害频发且愈发严重。其中,由螺原体引起的“颤抖病”在中华绒螯蟹养殖中发生较为广泛。中华绒螯蟹作为无脊椎动物主要依赖其先天免疫(包括细胞和体液免疫)发挥重要的免疫调控作用。目前,对于中华绒螯蟹细菌感染研究报道较多,相关研究发现,中华绒螯蟹应对副溶血性弧菌()、金黄色葡萄球菌()和嗜水气单胞菌()等细菌侵染的免疫反应中,整合素(EsIntegrin)、C型凝集素(EsCTL1和EsCTL2)、L型凝集素(ERGIC-53和VIP36)等可作为识别受体参与宿主免疫防御;其中,、、等基因是重要的免疫调控因子,发挥重要调节功能。而关于它的分子调控机制,至今仍是研究热点。
河蟹螺原体()属于柔膜体纲(Mollicutes)虫原体目(Entomoplasmatales)螺原体科(Spiroplasmataceae)螺原体属()。螺原体是上世纪70年代被发现,可广泛寄生于无脊椎动物中具有严重致病性的一类独特微生物,其定植于宿主体内,在长期与宿主共存过程中,相互构成复杂网络,通过不同精细调控细菌基因表达,以适应不同的生存环境,并对不同宿主发挥毒性作用。螺原体为中华绒螯蟹的主要病原体之一,被侵染后死亡率可达100%,近年中华绒螯蟹螺原体致使中华绒螯蟹、南美白对虾()、日本沼虾()和克氏原螯虾()等甲壳经济动物暴发疫病发生大面积死亡,对我国水产经济动物养殖业造成巨大经济损失。中华绒螯蟹螺原体通过鳃或外壳感染河蟹,并在1~5 d内增殖于其靶细胞-血淋巴细胞,5~10 d扩散至全身器官及结缔组织,最后在 10~15 d引起中华绒螯蟹附肢颤抖直至死亡。
MicroRNA(miRNA)是一类非编码RNA分子,广泛存在于真核细胞中,它通过与靶mRNA的3′-非翻译区(UTR)碱基配对调节基因表达,其长度为19~25 nt,miRNA虽不能直接编码蛋白质,但miRNA在不同基因转录后的调控中具有重要作用。第一条miRNA被Lee等发现后,对于miRNA的研究引起了广泛关注,miRNA在各种生命活动中起重要调控作用,如生长发育、生殖、免疫代谢等。目前,miRNA研究方法主要有基因芯片、RNA-seq、Northern blotting和茎环qRT-PCR等。其中,微流体芯片高通量可靠检测miRNAs的存在和差异表达情况,在水产养殖动物研究中已广泛应用。
当前,利用微流体芯片技术系统鉴定与分析中华绒螯蟹螺原体感染血细胞的miRNA及其表达情况,至今仍未见报道。前期,笔者所在实验室以正常和感染螺原体中华绒螯蟹血细胞为研究对象,进行miRNA转录组测序分析,初步预测了血细胞免疫相关的miRNA。本研究在前期基础上,通过构建中华绒螯蟹miRNA的特异微流体芯片,进一步系统鉴定血细胞免疫相关miRNA并检测其表达情况,对差异表达的microRNA进行靶基因预测和功能聚类与通路分析,相关研究结果将为中华绒螯蟹该疫病的免疫防控和抗病育种提供分子信息。
1 材料与方法
1.1 螺原体感染中华绒螯蟹血细胞的样品准备
中华绒螯蟹购于江苏省南京市某养殖户,(100±10) g共100只,在试验前放置于10 L带有循环水、紫外灭菌、充氧及控温系统(26~28 ℃)中培育,通过PCR技术及负染技术证实研究所用中华绒螯蟹为螺原体阴性。试验所用螺原体分离自患螺原体病的中华绒螯蟹,R2培养基中培育 48 h 备用。
2012年6月在南京师范大学将中华绒螯蟹分为对照组和试验组,各50只,培养20 d备用;对照组注射100 μL R2培养基,试验组注射100 μL含螺原体(培养至对数期)R2培养基。饲养温度保持 28 ℃,间歇性供氧。抽取血液,采用Trizol提取法从血细胞中提取RNA,并对RNA进行质量检测。
1.2 中华绒螯蟹微流体芯片构建及差异表达检测
由表1可知,基于miRBase中收录的中华绒螯蟹、淡水枝角水蚤()、日本对虾()、克氏原螯虾()4种动物共897条成熟miRNA序列作为本研究探针。采用Cy3染料标记RNA样品,可通过检测分析Cy3的荧光强度来寻找2组样品差异表达的miRNAs。
在总RNA质检通过后,进入芯片试验阶段,由LC Science参与完成。使用Array-Pro图像分析软件进行图像数字化转换。首先,减除背景值,再使用LOWESS过滤进行信号归一化。衡量杂交结果可靠性的标准如下:(1)值<0.5;(2)探针信号值大于3倍背景值与标准偏差的和。满足以上2点为表达检测结果为阳性。

表1 中华绒螯蟹微流体芯片探针
1.3 差异miRNA靶基因预测及其GO和KEGG功能富集分析
通过微流体芯片检测,可获得正常和感染螺原体中华绒螯蟹共同表达miRNA及两者差异表达miRNA。为了解2组中华绒螯蟹差异miRNA功能,选用分析软件“miRanda,PITA和TargetScan”进行预测差异显著miRNA的所有靶基因,结合三者预测结果,取交集,获取共有靶基因。根据Gene Ontology数据库对靶基因进行功能分析,根据KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库对靶基因进行Pathway分类,而得到Path way分类。
1.4 茎环RT-qPCR验证
设计茎环引物,进行反转录、RT-qPCR试验,反转录反应PCR程序为:42 ℃ 60 min,70 ℃ 15 min。RT-qPCR程序为:50 ℃ 2 min 95 ℃ 2 min;95 ℃ 15 s 60 ℃ 15 s,39次循环。每个样品均为3复孔,-为内参基因,miRNA差异表达水平用2-ΔΔ方法计算。采用Primer 5.0 (ABI)进行引物设计,采用特异性引物进行反转录,共设计9对引物,引物序列见表2。

表2 miRNA的引物序列
2 结果与分析
2.1 中华绒螯蟹血细胞miRNA的芯片鉴定与表达分析
试验组和对照组各使用3张芯片进行检测,每张芯片都设计多重质控探针,保证了样品标记和杂交试验的质量控制。对于正常和感染中华绒螯蟹血细胞中不同miRNA,根据芯片所产生的不同反应信号,通过分析这些芯片杂交信号值,选取Signal>200及<0.05为分析基准,数据进行归一化处理后进行-Test和Cluster分析。由图1可知,6张芯片总共鉴定出中华绒螯蟹血细胞miRNA为303个,试验组和对照组共表达miRNA有48个,其中,有27个表达miRNA差异显著(<0.05),6个表达miRNA差异极显著(<0.01);在这些差异表达的miRNA中,12个miRNA显著下调,15个miRNA显著上调(<0.05)。

2.2 差异miRNA的靶基因预测、GO注释和Pathway分类
由表3可知,通过利用3款分析软件“miRanda、PITA和TargetScan”对差异显著的27个miRNA靶基因进行预测,结合三者数据取交集,共得78个靶基因,预测靶基因大多数为各种蛋白和酶的基因,参与调节各种生命活动,尤其是在免疫调节中发挥作用的proPO、ALF-2、Peroxinectin、Relish免疫因子等。

表3 miRNA的预测靶基因
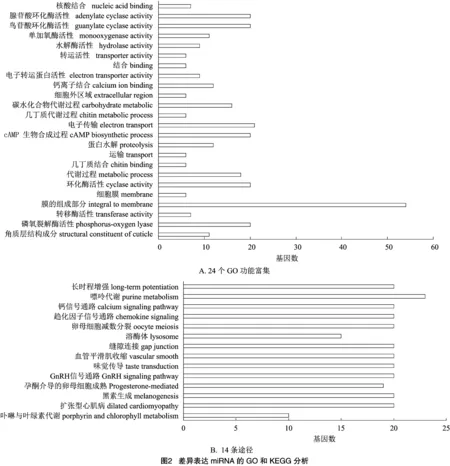
由图2-A可知,对预测到的78个靶基因进行GO注释,共有116个GO通路被注释,明显富集于24个GO,包括:蛋白水解、cAMP生物合成和钙离子结合等;由图2-B可知,通过KEGG注释,发现63个通路被注释,14个主要通路,包括:嘌呤代谢、趋化因子信号通路和GnRH信号通路等。
2.3 茎环RT-qPCR试验结果
为验证微流体芯片的检测结果,由图3可知,随机选取PC-esi-137-3p、PC-esi-14-5p、PC-esi-140-5p、PC-esi-229-3p、PC-esi-262-3p、PC-esi-33-3p、PC-esi-394-5p、PC-esi-433-5p、PC-esi-69-3p这9个明显差异表达的miRNA进行验证,利用茎环RT-qPCR法检测miRNA的差异表达情况。结果表明,这9个miRNA表达水平均上调,与微流体芯片结果一致。

3 讨论
miRNA通过与靶标基因的3′-非翻译区(3′-UTR)互补,抑制mRNA表达或直接裂解mRNA,调控各种生理和病理作用。miRNA也是至今研究最广泛的一类非编码RNA,已被证明在调节先天性和适应性免疫系统中发挥重要作用。因此,鉴定和筛选免疫相关的miRNA,解析其在宿主与病原体中的相互关系,将在疾病防控和抗病育种中发挥重要作用。在miRNA研究中,微流体芯片技术已被广泛应用,微流体芯片技术是高通量、特异性和敏感性强的一种基因鉴定和差异检测方法,在动物的生长、发育和免疫应答等方面运用较多。李升等选用不同月龄香猪的肝脏组织RNA,与微流体芯片杂交,结果表明不同月龄肝脏miRNA的表达水平存在差异。关于水产动物研究,何耀东等利用微流体芯片技术研究发现,在注射自噬诱导剂后对虾血淋巴中有15个miRNA明显上调,17个miRNA明显下调,表明相关差异表达miRNA在白斑综合症病毒(WSSV)侵染对虾的过程中发挥作用。现今,微流体芯片技术,因其具有微量化、快速、高通量等特点,近年来已被广泛应用到癌症、微生物和营养等多个领域研究中。随着微流体芯片的进一步广泛应用,将极大促进功能性调控miRNA的发现与鉴定,为进一步研究免疫调控机制奠定基础。
中华绒螯蟹属于无脊椎动物,完全依赖先天免疫(包括细胞和体液免疫),而缺乏适应性免疫来抵御细菌和病毒等。甲壳动物血细胞是主要的免疫细胞,在宿主的先天免疫活动中起着至关重要的作用,包括识别、吞噬、黑化、细胞毒性和细胞间信号传递等。因此,识别和鉴定参与先天免疫应答的调节因子(如非编码RNA和转录因子)至关重要。前期研究通过对正常和感染螺原体的血细胞进行高通量测序分析,结合生物信息学分析,共鉴定出735个miRNA;在被螺原体侵染后,本研究发现228个miRNA表达量存在明显差异,133个miRNA显著上调,95个miRNA显著下调。在此基础上,本研究选择微流体芯片和茎环RT-qPCR技术,对细胞免疫相关miRNAs进行了进一步的筛选鉴定与验证。由于μParaflo®微流体芯片相比于传统点样芯片具有更可靠、准确和灵活特点,本研究利用该技术鉴定出中华绒螯蟹血细胞miRNA共303个;健康组和试验组共表达miRNA有48个,其中,差异显著miRNA为27个(占比56.25%);差异极显著miRNA为6个(占比12.50%)。随机选择9个差异表达miRNA进行茎环RT-qPCR验证,结果与芯片结果一致,说明芯片检测结果准确可靠。
近年,随着测序成本的下降和技术的不断发展,miRNA在虾蟹免疫调控中发挥作用的研究已较为广泛。Ou等研究发现,pcl-miR-34、pcl-miR-7、PN-pcl-let-7、pcl-miR-1和pcl-miR-2b在克氏原螯虾应对螺原体侵染过程中发挥着积极作用,且在脊椎动物和无脊椎动物中高度保守。Bao等研究发现,microRNA-589-5p在凡纳滨对虾可调节抗WSSV免疫应答中血蓝蛋白的表达。Soo等发现,bta-miR-4286、dre-miR-107b 在斑节对虾()应对副溶血弧菌侵染过程中与对肌蛋白基因表达、钙浓度有调控作用。本研究通过利用3款分析软件“miRanda、PITA和TargetScan”对差异显著的27 个miRNA进行靶基因预测,取三者交集,共得到78个靶基因,涉及多个重要免疫通路,其中,()、()、和等多个靶基因是参与免疫调控的重要免疫因子。
酚氧化酶(proPO)系统是无脊椎动物先天免疫的重要组成部分之一,过氧化物酶可与proPO相关的细胞黏附因子相互作用来进行免疫调节。免疫缺陷同系物(immune deficiency homolog,IMD)信号通路是调节甲壳动物固有免疫的主要信号传导途径,而Relish是IMD信号通路中的关键因子,Bai等发现,Relish参与了中华绒螯蟹对革兰氏阳性和革兰氏阴性细菌的免疫防御过程;Zhang等发现,Relish在克氏原螯虾中能诱导基因的表达;丝裂原激活的蛋白激酶途径(MAPK)能够通过调节胞内蛋白来发挥调控功能,如细胞分化、凋亡、增殖和免疫反应。笔者所在课题组前期运用RNA-seq测序技术,结合本研究的微流体芯片技术,全面分析了正常和感染螺原体的中华绒螯蟹血细胞mRNA和miRNA转录组。结果显示,许多免疫相关miRNA及其靶基因均表达显著差异。它们参与了一些典型免疫相关途径,包括补体和凝血级联途径、VEGF信号途径、Wnt信号途径、NK细胞介导的细胞毒性、MAPK信号途径、神经活性配体-受体相互作用途径和溶酶体途径。
本研究同时通过对差异表达miRNA的靶基因进行了GO和KEGG功能分析,共注释到116个GO通路和63个KEGG通路,主要集中于宿主的多种酶活性、代谢和免疫通路等,包括细胞免疫涉及的包囊、结节形成和吞噬作用,与体液免疫涉及的酚氧化酶激活系统(proPO系统)、凝血级联和抗菌肽(AMP)的合成等。以上研究结果可为进一步深入研究中华绒螯蟹免疫机制提供科学理论依据,为水产经济动物虾蟹该疫病的综合防控奠定基础。
