灰楸组织培养体系研究
2022-09-22杨玉珍李晓哲侯宏伟
杨玉珍,李晓哲,侯宏伟
(1.南阳农业职业学院植物组织培养中心,河南 南阳 473000;2.中国科学院水生生物研究所,武汉430072)
楸树(Catalpa bungeiC.A.Mey.)是中国原产树种,属于紫葳科(Bignonicaceae)梓树属(Catalpa)楸树组的高大落叶乔木,是较为古老的树种之一。主要分布在黄河流域、华东及西南等地区[1,2],是中国珍贵优质的建筑用材和园林观赏树种,可营造用材林、楸农间作林、防护林及庭院观赏、道路绿化等。楸树树形挺拔优美、花色艳丽、枝叶繁茂、生长速度快、适应范围广、耐寒耐旱、材质名贵,且有很高的药用价值[3-5],自古素有“木王”和“黄金树”之美称,可与“花王”牡丹相媲美,目前已被中国视为“家珍”进行保护[6,7]。灰楸(Catalpa fargesiiBureau)在河南省南阳市有悠久的栽培历史,是当地优秀的造林和园林绿化乡土树种。近年来,随着人们生活水平的不断提高和社会经济的快速发展,绿化用灰楸苗需求量增大,市场供不应求,如何快速大量地繁殖灰楸良种壮苗已成为当前亟待解决的问题。目前,灰楸的繁殖方式有根蘖繁殖、嫁接繁殖、扦插繁殖、种子繁殖和组培繁殖等。灰楸需异株或异花授粉,结实率、发芽率低,种子繁殖困难[8,9],且楸树为难生根树种,扦插生根率也较低;传统的埋根繁殖方法,因其繁殖材料相对较少,客观上限制了繁育的规模;而采用嫁接繁殖的方法时,首先需要培育砧木,目前砧木培育多采用梓树播种育苗方式,但播种后至少需要2年才能达到嫁接砧木所需的粗度,这种繁殖方式存在砧木培育生产周期长、嫁接技术繁杂的缺点,不利于楸树的扩繁推广应用和规模化生产[2,10,11]。组培繁殖则是一种快速扩大优良种质资源的重要手段。
目前,国外对于楸树组织培养快繁体系的研究鲜有报道,其对楸树的研究主要侧重于楸树叶绿体基因组的完整测序、无性系生长性状的遗传变异及基因型与环境的互作、抗干旱性及抗病虫害机制等方面[12-16];国内对楸树的组织培养虽然有不少报道,但主要集中在周楸、金丝楸、鲁楸等种类[17-19],而灰楸的组织培养快速繁殖体系尚未建立,组培生产过程也鲜见报道。南阳农业职业学院植物组织培养中心对南阳市乡土树种灰楸优选株进行了组织培养快速繁殖技术系统的研究。
1 材料与方法
1.1 试验材料
以河南省南阳市乡土树种灰楸优选株的茎段、新芽为试验材料,试验在南阳农业职业学院植物组织培养中心进行。
1.2 试验方法
1.2.1 外植体的选取和预处理4—6月,将灰楸优选株的当年生茎段剪下,除去叶、叶柄,用洗涤剂浸泡10 min左右,软毛刷仔细清洗茎段和节芽缝隙,自来水冲洗2 h。
1.2.2 外植体的灭菌与初代培养 超净工作台上,紫外照射灭菌15 min,将预处理过的外植体用75%的乙醇溶液灭菌10 s,将0.1%的HgC12溶液倒入烧杯中灭菌16 min,再用无菌水冲洗5次,将茎段横切成1~2 cm长的小段,接种在不同的固体培养基上。试验选取MS培养基为基本培养基,2%的蔗糖,0.6%的琼脂,pH 5.6。以6-BA、GA3和IBA 3种生长调节剂的较低水平进行组合试验[17-19],每处理20瓶。接种20 d后观察侧芽培养情况。培养条件:光照度2 500 lx,光照时间12 h/d,温度(23±1)℃。
1.2.3 继代培养 腋芽萌发后,自侧芽基部切下转入继代培养基中,选取6-BA、NAA和IBA 3种生长调节剂进行不同浓度的组合配比试验[2,11,19],以MS培养基为基本培养基。观察丛生芽诱导情况,筛选最佳增殖培养基。丛生芽增殖到一定的数量高度后,转入最佳增殖培养基。
1.2.4 生根培养 当丛生芽长至3.5~4.5 cm、具3~4片叶时自底部切下,转入生根培养基内诱导生根[20,21],每瓶接种5株苗。选择1/2 MS为基本培养基,以不同浓度的NAA和IBA进行诱导生根试验,附加0.3%的活性炭,接种30 d后调查幼苗生长情况。
1.2.5 炼苗与移栽 当苗长出3~5片叶,根长到3 cm左右时,移入温室内驯化,7 d后开盖炼苗,2 d后将苗取出,用自来水洗净根部的琼脂。用小石子和草炭土按体积比1∶3混合,作为栽培基质,苗床底部垫以碎石、碎砖块。用稀薄的营养液喷雾,每隔7 d喷1次50%多菌灵可湿性粉剂800倍稀释液,温度保持在10~25℃。
2 结果与分析
2.1 灰楸愈伤组织与丛生芽的诱导
当侧芽萌发后,为了诱导愈伤组织分化丛生芽,将切下的腋芽接种到诱导培养基上,观察愈伤组织与丛生芽诱导产生情况(表1)、灰楸侧芽培养与愈伤组织诱导情况(图1),筛选出最佳增殖培养基。
从表1可以看出,相同浓度的6-BA下,较高浓度的IBA对形成灰楸侧芽生长有明显促进作用,但对于诱导丛生芽不利。从图1可以看出,处理1(图1a)侧芽膨大,长出愈伤组织,但无明显丛生芽;处理2(图1b)的周围长出1~2个丛生芽;处理3(图1c)的侧芽周围长出较多丛生芽;处理5(图1d)的愈伤组织过大,无健康的丛生芽。结果表明,无菌体系的建立与侧芽培养的生长调节剂配比以1.0 mg/L 6-BA+0.5 mg/L GA3+0.5 mg/L IBA为宜,培养20 d左右,侧芽周围有较多丛生芽萌发。无菌体系的建立与侧芽的培养仅要求维持成活,促使侧芽萌发即可,因此对生长调节剂要求不严格,培养基可以选用较低水平的生长调节剂。

图1 灰楸侧芽培养与愈伤组织诱导比较
2.2 灰楸丛生芽继代增殖培养中生长调节剂配比的选择
将诱导出的灰楸丛生芽转移到不同浓度组合的半固体MS培养基中,接种15 d后调查丛生芽诱导生长情况,试验结果见表2。
从表2可以看出,6-BA浓度在1.0 mg/L以下对丛生芽的诱导作用不明显,添加IBA后对丛生芽诱导有一定的促进作用,添加NAA对丛生芽诱导没有明显的促进作用,最佳生长调节剂是处理6,配比为0.6 mg/L 6-BA+1.0 mg/L IBA。
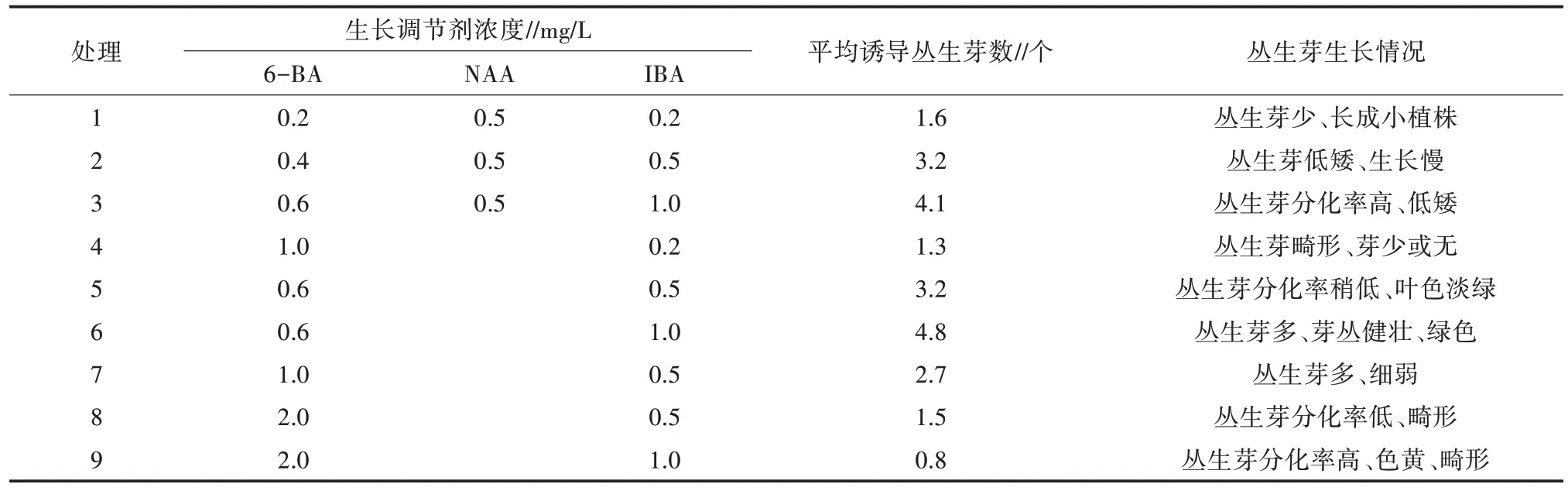
表2 不同生长调节剂配比对灰楸诱导丛生芽的影响
将需继代的丛生芽切割后转入新鲜的增殖培养基中培养。为了增加丛生芽的繁殖速度,丛生芽培养25 d后,将生长较高的丛生芽取出分割成单株、切段,继续移入附加0.6 mg/L 6-BA+1.0 mg/L IBA的培养基中,进行增殖培养,增殖倍数达4.8左右,25 d左右继代1次。
灰楸苗的生长情况见图2。从图2可以看出,处理2和处理3的丛生芽低矮、生长缓慢;处理8和处理9的丛生芽分别呈现出畸形、分化率低和畸形、叶色黄、分化率高的非健康生长状态。处理6的丛生芽生长状况最好,0.6 mg/L 6-BA+1.0 mg/L IBA配比的生长调节剂,较有利于不定芽的分化,芽增殖倍数高、苗健壮、叶色浓绿。

图2 不同生长调节剂配比下灰楸苗的生长情况
2.3 灰楸生根培养基的选择
以1/2 MS培养基添加不同浓度和比例的生长调节剂,NAA与IBA对灰楸幼苗生根试验结果见表3,生根情况见图3。
从表3、图3可以看出,添加不同浓度、不同比例的NAA与IBA对楸树幼苗生根壮苗具有明显影响,以IBA浓度为0.5 mg/L为最佳。

图3 不同生长调节剂组合下灰楸生根情况

表3 不同生长调节剂种类和浓度对灰楸生根壮苗的影响
灰楸生根苗移栽后,先置于加盖遮阳网的大棚中培养,温度保持在15~25℃,3~4周后将光线提高,逐步撤除遮阳网,空气相对湿度不低于80%[22]。幼苗健壮、叶色深绿,要防止强光照射。
3 小结
对灰楸优选株从外植体选择与处理、愈伤组织诱导、不定芽的诱导与增殖,到壮苗生根进行了组培快繁技术的系统研究,并进行了批量生产。研究结果表明,丛生芽诱导增殖最佳生长调节剂配比为MS+1.0 mg/L 6-BA+0.5 mg/L GA3+0.5 mg/L IBA,壮苗培养的最佳生长调节剂配比为MS+0.6 mg/L 6-BA+1.0 mg/L IBA,幼苗生根以1/2 MS+0.5 mg/L IBA为最佳。本研究通过探索诱导丛生芽增殖培养基中的生长调节剂配比、丛生芽继代增殖培养中生长调节剂的配比以及生根培养基中生长调节剂的配比,筛选得到了最佳快速培养灰楸优选株的繁育技术方法,为实现灰楸的速生丰产、满足大量生产需求提供了快捷途径,供行业研究及生产参考,以期加速对中国楸树资源的开发和利用。
