以短肽组装体为模板仿生矿化二氧化硅纳米管*
2022-09-22赵玉荣李幸凡张黎民陈翠霞
赵玉荣 王 丽 李幸凡 张黎民 王 栋 陈翠霞
(中国石油大学(华东)化学化工学院,青岛 266580)
硅元素在地球上的含量非常丰富,二氧化硅由于具有生物相容性好、机械强度高、光学性质优异等特殊性能,近些年来在非均相催化、酶固定、生物传感和微电子等技术领域展现出良好的应用前景[1-6]。通过化学合成法可制备二氧化硅纳米材料,但该传统方法往往很难控制二氧化硅材料的精细结构,同时反应条件苛刻,常需要在高温高压下进行,且反应需要引入有机化学试剂,导致大量有毒副产物的产生,造成严重的环境污染。因此,迫切需要开发一种高效、低毒且反应条件温和的二氧化硅纳米材料的制备方法。
生物矿化是由生物体在生物大分子的调控下形成无机矿物的过程,该过程在温和条件下便能形成更为精密的结构,且展示出优异的性能[7-8],例如,硅藻壳是硅藻细胞的细胞壁,具有精致的分层多孔结构,它的主要成分二氧化硅可为硅藻细胞提供出色的支撑与保护作用[9-10]。海绵可通过生物矿化的方式,利用海洋中的硅酸形成二氧化硅结构[11]。与传统的化学合成相比,生物矿化所需反应条件温和,在常温常压、pH值接近中性的条件下即可进行,且反应无有毒副产物,可有效减少对环境的污染。正因如此,通过模拟生物矿化过程,在体外构建具有类似性能的先进功能材料已发展成为生物化学、材料化学和纳米技术等交叉学科的研究热点。近年来,随着研究工作的不断推进,人们对生物矿化机理有了较深的认识,成功从生物体中提取了与矿化相关的生物大分子并在体外仿生合成了尺寸和形貌不同的二氧化硅纳米材料,如纳米球、纳米管、纳米棒等,这些纳米材料在生物探针、生物分离以及生物运输等方面展示出良好的应用前景[10,12-13]。在上述研究过程中,人们发现了一些重要的生物分子,如从硅藻和海绵骨针中分离提取的siliffins[14]、silacidins[3]和silicatein[15-16]等,可在常温常压、中性条件下诱导二氧化硅的沉积。在诱导过程中,这些生物大分子中含有的氨基、咪唑基和胍基等是导致硅化反应进行的重要基团[17]。然而,从生物体中直接提取生物大分子进行体外矿化不仅成本较高且提取过程中生物大分子的结构和性质容易遭到破坏。同时,这些生物大分子的结构和性质的体外调控相对复杂,这在一定程度上限制了该方法的推广和应用。因此,模拟天然生物大分子的结构,人工合成生物小分子并利用矿化反应制备无机纳米材料有助于人们拓宽制备的生物无机材料的种类和性质。
多肽是介于氨基酸和蛋白质之间的一类小分子,通过调整氨基酸的种类和排列顺序,可设计合成不同的多肽。由于碱性氨基酸中含有参与生物矿化反应的活性基团,人们首先将目光瞄准了它们。Patwardhan等[18]利用聚赖氨酸分子进行了二氧化硅的仿生矿化,发现矿化产物的形貌受赖氨酸的手性控制,这为二氧化硅仿生矿化提供了新思路。然而,聚肽的分子质量相对较大,纯化困难且自组装行为不易调控,这为解释二氧化硅纳米材料的形成机制带来了困难。相比之下,小分子短肽结构简单,易于合成和进行组装体形貌调控,可为二氧化硅纳米材料的合成提供丰富的模板,同时可为反应机理的探索提供方便。最近,Nguyen等[19]合成了一种双功能肽,考察了其在蛋白质净化和二氧化硅沉淀中的应用,但他们制备的二氧化硅主要为球形颗粒。本课题组以超短肽I3K自组装形成的纳米纤维为模板,正硅酸乙酯(TEOS)为硅源,在不同条件下仿生矿化制备二氧化硅纳米材料,发现短肽组装体在不同条件下可诱导TEOS水解并最终形成二氧化硅纳米管,通过改变pH值和放置时间可有效调节纳米管的尺寸。在矿化过程中,肽同时具有成核剂和催化剂的作用。值得注意的是,由于I3K形成纳米纤维的尺寸较小,仿生矿化制备的二氧化硅纳米管的尺寸也相对较小[20-21]。最近,Wang等[22]考察了系列非对称Bola型短肽的自组装行为,并以KI3E和KI4E构筑的组装体为模板仿生矿化得到了二氧化硅和二氧化钛纳米材料。尽管他们制备的纳米管的尺寸仍然较小,但是成功合成了尺寸较大的纳米带结构,为大尺寸纳米材料的制备提供了思路[22]。
二氧化硅纳米管的尺寸和形貌可显著影响其性质,因此制备尺寸不同的纳米管可促进其在不同领域的应用。前期针对Bola型多肽Ac-KI3VK-CONH2自组装行为的研究表明,该多肽在溶液为酸性或中性、浓度为32 mmol/L时可自组装形成尺寸约为40 nm的纳米管结构[23]。为进一步拓宽仿生矿化二氧化硅纳米管的尺寸,本文以Ac-KI3VK-CONH2自组装形成的纳米管为模板进行仿生矿化,制备二氧化硅纳米材料。首先考察了Ac-KI3VK-CONH2纳米管的稳定性,发现该纳米管在稀释、加入甲醇或乙醇、改变溶液pH值时形貌均遭到破坏,展示出较差的稳定性。为尽可能保证多肽纳米管在矿化过程中的模板作用,实验选择反应速率较快的TMOS为前驱体,仿生矿化制备二氧化硅,系统考察了乙醇加入量、硅源浓度、硅源种类、溶液pH值等因素对二氧化硅形貌和尺寸的影响。在此基础上,讨论了二氧化硅纳米管的形成机理。通过条件优化,仿生矿化成功制备出规则有序且尺寸较大的二氧化硅纳米管。该研究设计的短肽分子质量小、易于合成,其特异的原位催化作用使其形成的组装体可直接用于二氧化硅的仿生矿化。研究工作的开展为拓宽二氧化硅纳米管的尺寸和实现其在不同领域的应用奠定了基础,具有重要意义。
1 材料与方法
1.1 多肽纯度表征
1.1.1 质谱
配制1 g/L的多肽溶液,并以TA30(乙腈∶含0.1%三氟乙酸的超纯水(30∶70,v/v))作为溶剂配制饱和α-氰基-4-羟基肉桂酸(HCCA)溶液。按照体积比为1∶1将两种溶液进行充分混合,取2.5 μl混合溶液滴在干净的靶板上,待溶剂挥发干之后,将样品靶板放入仪器中进行分析。
1.1.2 高效液相色谱
配制1 g/L的多肽溶液,用0.22 μm的水系滤头过滤至液相瓶中,然后放入样品仓中进行分析实验。采用C18反相液相色谱分析柱对多肽的纯度进行检测,待基线平稳后,用A相和B相对样品逐级梯度洗脱,其中流动相A为含0.1%三氟乙酸(TFA)水溶液,B相为含0.1%TFA的乙腈,流动相的流速设定为0.6 ml/min,进样量为60 μl,实验检测波长为214 nm。梯度洗脱条件:0~1 min,A相95%,B相5%;1~45 min,A相95%~5%,B相5%~95%;45~50 min,A相5%~95%,B相95%~5%。
1.2 溶液配制
根据实验要求,配制浓度为32 mmol/L的Ac-KI3VK-CONH2溶液。具体配制方法如下:使用电子天平准确称量多肽并溶解在超纯水中,通过超声和涡旋促使其完全溶解。如果多肽未完全溶解,可继续用85℃水浴加热溶液2 h以促其溶解。用NaOH将溶液调至目标pH值,最后将配制好的溶液室温静置1周后进行形貌表征。
1.3 多肽组装体的二级结构表征
实验采用圆二色谱仪(CD)和傅里叶变换红外光谱仪(FTIR)表征了多肽组装体的二级结构。
1.3.1 CD表征
为防止氙灯在高温下受空气氧化而损坏,在实验开始前先通氮气20 min,以排除装置中的空气。选择厚度为0.1 mm的样品池测定其二级结构。具体实验参数如下:波长范围为190~260 nm,步长为1 nm,光源带宽为0.5 nm,狭缝宽度为1 mm,扫描速度为120 nm/min。样品检测前,首先对样品所对应的溶剂(水)进行信号收集,并将其作为样品背景进行扣除。待背景扣除后检测多肽样品,3次测量后取平均值,利用Bio-Logic软件进行曲线平滑。
1.3.2 FTIR表征
为了防止H2O对酰胺I带测量峰的影响,实验前用D2O代替H2O进行样品配制,利用NaOD调节pD值。实验中采用CaF2样品池,厚度为0.1 mm的聚四氟乙烯垫片,采集光谱范围为4 000~400 cm-1,分辨率为4 cm-1,扫描次数为64次。样品数据采集时,先扣除溶剂背景,之后采用OMINC软件对光谱曲线进行平滑和基线校正。
1.4 组装体的形貌表征
1.4.1 原子力显微镜(AFM)
取少量多肽溶液滴到新鲜云母片上,吸附2 min左右,用纯水冲掉多余溶液,再用氮气将云母片上的样品吹干,放置在样品台上。利用轻敲模式(tapping mode)进行图像扫描。实验采用TESP-V2型单晶硅探针,扫描频率为1.00 Hz,扫描角度为0o,图片分辨率为512×512。待图片采集完毕后,利用原子力自带软件对图片进行处理分析。
1.4.2 透射电子显微镜(TEM)
取5~10 μl多肽溶液滴于封口膜表面,将干净的铜网吸附在液滴上(吸附时间约为2 min),吸附完毕后晾干铜网。利用染色剂醋酸双氧铀进行染色,染色时间大约为8 min,待铜网彻底晾干后进行形貌表征。对制备的二氧化硅,首先将产物冻干,然后取少量冻干产物利用乙醇分散并吸附于铜网,待铜网彻底晾干后进行形貌表征。实验采用JEOL JEM-2100UHR型透射电子显微镜,加速电压设定为200 kV,利用Gatan CCD采集图像。
1.4.3 低温透射电子显微镜(Cryo-TEM)
取5~10 μl多肽溶液滴在微栅支持膜上,吸附3~8 s后,迅速投入预先冷却好的-165℃液态乙烷中,随后将玻璃化样品转入液氮中,再将制好的样品转移到样品杆中。利用JEOL JEM-1400透射电子显微镜于约-174℃成像,加速电压为120 kV。
1.5 二氧化硅的仿生矿化
首先配制浓度为32 mmol/L的Ac-KI3VKCONH2溶液,在室温下放置1周以保证体系形成纳米管,然后将溶解(或分散)在溶剂(水、乙醇或者水和乙醇的混合体系)中的硅源TMOS与多肽溶液混合,再将溶液pH值调到目标值,室温静置一定时间使其充分矿化并将矿化后的溶液冻干。利用乙醇将产物分散,通过TEM表征形成二氧化硅纳米材料的形貌。系统考察了矿化过程中乙醇加入量、硅源浓度、硅源种类、以及pH值对矿化结果的影响。实验中溶液的总体积为900 μl,其中包含组装后的多肽溶液500 μl和TMOS混合溶液400 μl。
2 结果与讨论
2.1 多肽纯度鉴定
首先,实验利用反相-高效液相色谱仪(RPHPLC)及基质辅助的激光解析电离-飞行时间质谱仪(MALDI-TOF-MS)对多肽Ac-KI3VK-CONH2的纯度进行了表征(图S1)。可以看出,Ac-KI3VK-CONH2的RP-HPLC谱图在保留时间为13.6 min时出现了一个强度较大且尖锐的单峰,没有其他杂峰出现,说明多肽纯度较高。通过对峰面积积分发现其纯度达98%以上。质谱图中(图S1b)有3个峰出现,它们分别对应Ac-KI3VK-NH2与氢离子(755.3)、钠离子(777.3)和钾离子(793.3)的结合峰,无其他杂峰出现,说明多肽纯度很高,满足实验要求。
2.2 多肽组装体的形貌表征
研究利用负染色TEM、Cryo-TEM以及AFM对多肽组装体的形貌进行表征。
2.2.1 TEM和Cryo-TEM表征
本文首先用负染色TEM和Cryo-TEM对Ac-KI3VK-CONH2溶液在pH值为3.0时形成组装体的形貌进行了表征(图1)。负染色TEM结果(图1a)表明体系形成了尺寸较大且均一的组装体,其边缘两侧各有一条白色亮线,这主要是由染色剂在组装体内部沉积造成的[24],证明体系形成了纳米管结构,这些纳米管的直径约为42 nm(图1a中的插图)。相比于负染色TEM,Cryo-TEM的制样不需要干燥和染色,能够避免制样过程对样品的破坏,有助于保持组装体的真实形貌。因此,本文进一步通过Cryo-TEM对Ac-KI3VK-CONH2形成组装体的形貌进行了表征(图1b),可以看出,组装体的边缘有两条平行的黑线,进一步证明Ac-KI3VKCONH2自组装形成了纳米管。
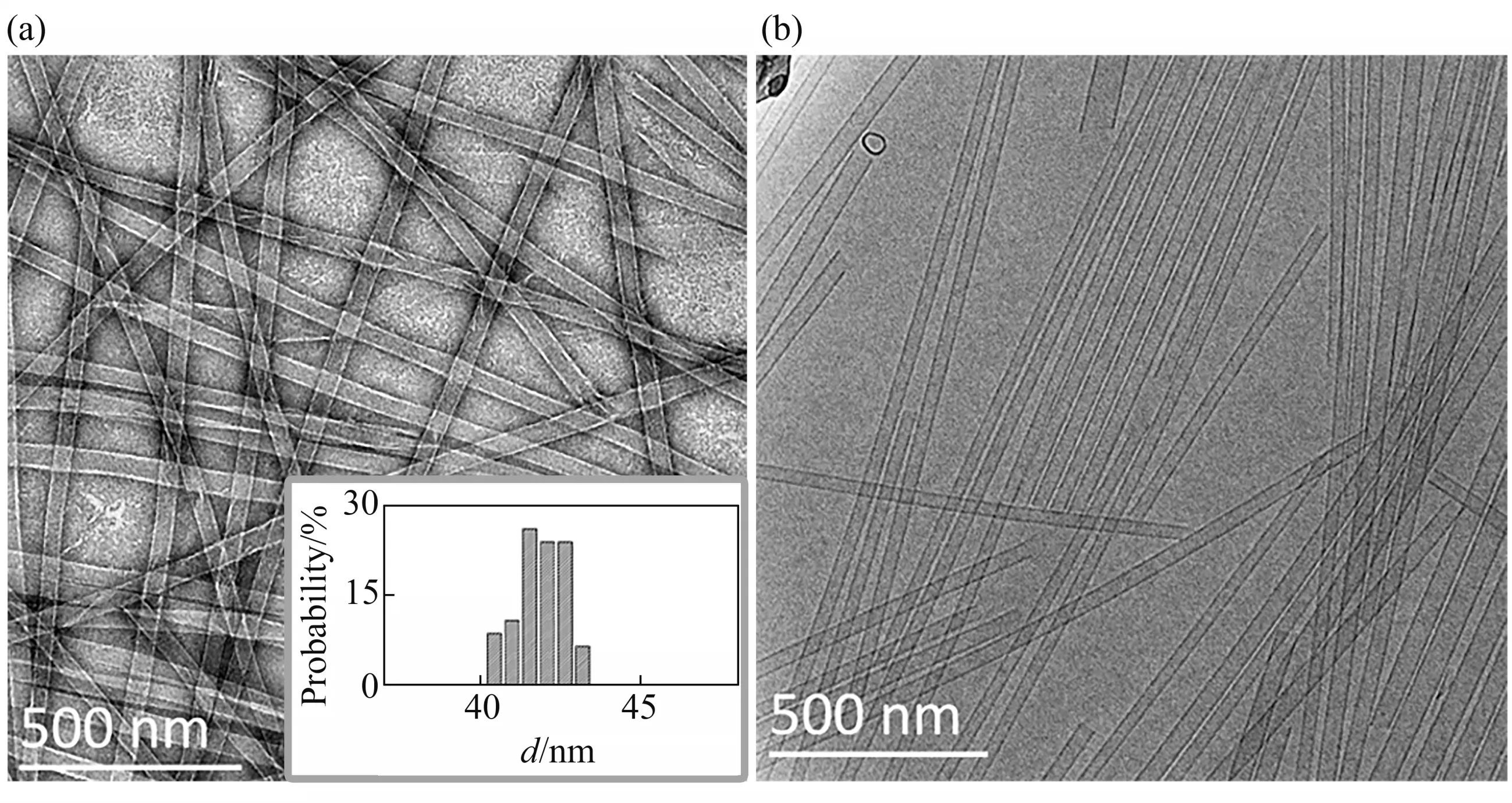
Fig.1 Negative-TEM and Cryo-TEM images of Ac-KI3VK-CONH2self-assemblies formed at the concentration of 32 mmol/L and pH value of 3.0
2.2.2 AFM表征
与TEM相比,AFM不仅可表征组装体形貌,还能够有效表征组装体的高度信息。本文利用AFM详细表征了Ac-KI3VK-CONH2形成组装体的形貌和高度信息(图2)。可以看出,Ac-KI3VK-CONH2形成了纳米管结构,管口清晰可见(图2a中白色箭头所示)。高度分析表明管的厚度约为4 nm(图2b),是Ac-KI3VK-CONH2分子长度的两倍,说明纳米管的管壁为单层。
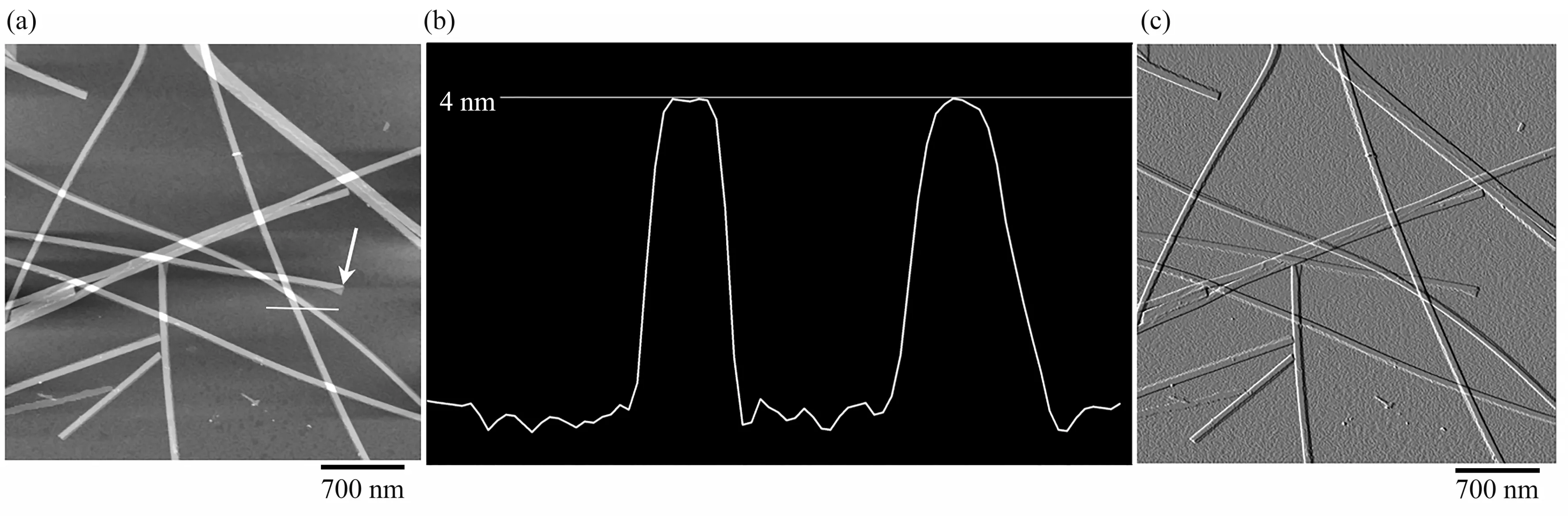
Fig.2 AFM images and the cross-section profile of Ac-KI3VK-CONH2 nanotubes
2.3 组装体的二级结构表征
研究利用CD和FTIR表征了组装体的二级结构(图3)。
CD结 果 表 明,Ac-KI3VK-CONH2溶 液 在~215 nm处呈现一个负吸收峰,在~198 nm处呈现一个正吸收峰,表明Ac-KI3VK-CONH2形成纳米管的二级结构为β折叠[25]。FTIR谱图在~1 622 cm-1处有一个强吸收峰,进一步证明了Ac-KI3VK-CONH2组装体的二级结构为β折叠[26]。此外,FTIR谱图中1 674 cm-1附近的吸收峰是多肽合成过程中残余的三氟乙酸(TFA)造成的[27]。
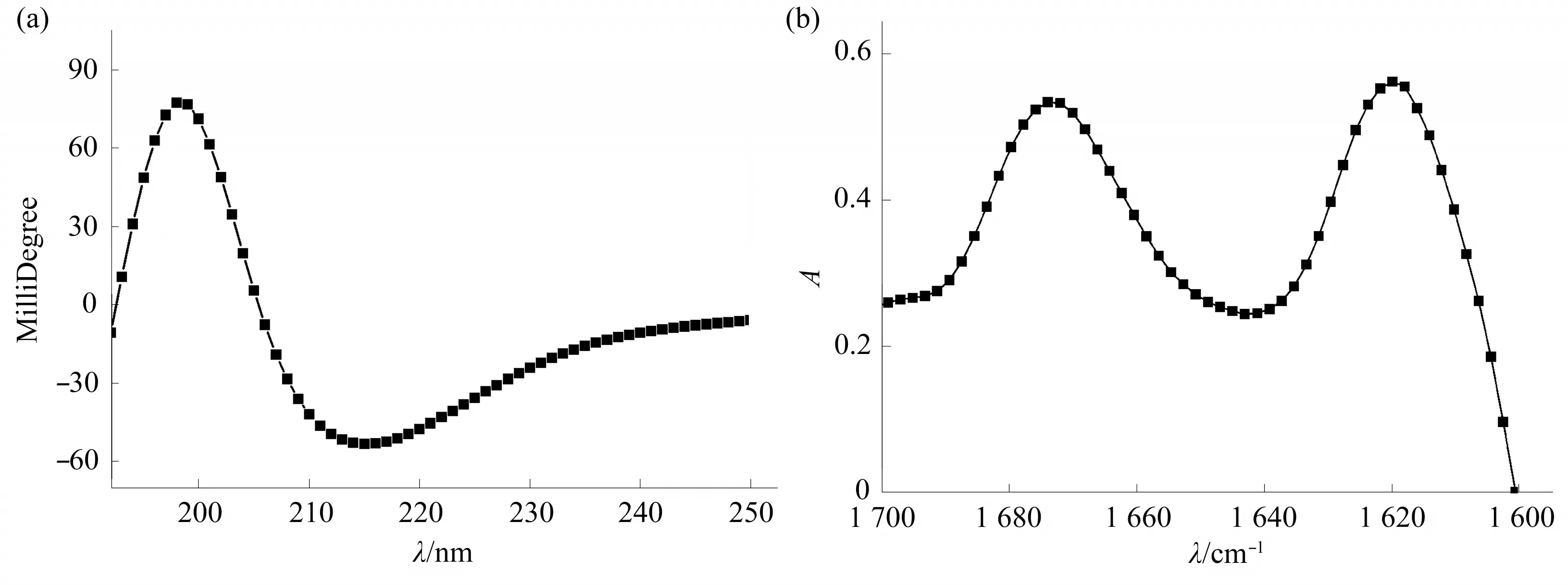
Fig.3 CD and FTIR spectra of Ac-KI3VK-CONH2 self-assemblies formed at the concentration of 32 mmol/L
2.4 纳米管的稳定性考察
为了以Ac-KI3VK-CONH2形成的纳米管为模板仿生矿化二氧化硅,本文首先对其稳定性进行了详细考察。
2.4.1 稀释对Ac-KI3VK-CONH2形成纳米管的稳定性影响
研究配制了32 mmol/L的Ac-KI3VK-CONH2溶液,室温放置1周后加入超纯水稀释至16 mmol/L,利用负染色TEM表征了稀释后组装体的形貌(图S2a)。可以看出,此时组装体中包含很多螺旋带,说明当多肽浓度降低至16 mmol/L时,部分纳米管转变为螺旋带结构,表明纳米管的稳定性较差。
2.4.2 有机溶剂对Ac-KI3VK-CONH2形成纳米管的稳定性影响
研究配制了32 mmol/L的Ac-KI3VK-CONH2溶液,分别加入等体积的甲醇或乙醇将其浓度稀释至16 mmol/L,考察了甲醇和乙醇对形成纳米管的稳定性影响(图S2b,S3)。可以看出,甲醇的加入使组装体由纳米管转变成较细的扭转带。这主要是由于甲醇的加入会降低体系的疏溶剂作用,导致β折叠的侧向堆积能力减弱,使组装体宽度明显减小。同时,本文考察了乙醇对Ac-KI3VK-CONH2形成纳米管的稳定性影响,发现乙醇的引入可显著破坏纳米管结构。图S3给出了加入50%乙醇对Ac-KI3VK-CONH2纳米管结构的影响。随着乙醇加入,纳米管变成了无序片层和细纤维结构。造成上述现象的主要原因是,相比于甲醇,乙醇极性显著降低,导致多肽在水/乙醇混合溶剂中的溶剂化程度较水/甲醇中显著降低,组装能力减弱,最终形成了无序结构。在有机溶剂甲醇或乙醇存在时,Ac-KI3VK-CONH2形成的纳米管结构均被破坏,表现出较差的稳定性。
2.4.3 溶液pH值对Ac-KI3VK-CONH2形成纳米管的稳定性影响
配制32 mmol/L的Ac-KI3VK-CONH2溶液,室温放置1周,用NaOH将其pH调至8.0,利用TEM表征此时形成组装体的形貌(图S2c)。与pH值为3.0时相比,pH为8.0时形成的组装体形貌发生了明显变化,主要为不均匀的纳米带,只有少量纳米管存在。造成这一现象的主要原因是:当溶液pH值从3.0升高至8.0时,Ac-KI3VK-CONH2中两端K侧链上的氨基部分去质子化,大大降低了多肽分子间的静电斥力,破坏了多肽自组装过程中的非共价键力平衡,导致了纳米管的解体。这表明,Ac-KI3VK-CONH2形成的纳米管在溶液pH值较高时不能稳定存在。
综上所述,Ac-KI3VK-CONH2在浓度为32 mmol/L时形成的纳米管不稳定,在稀释、加入有机溶剂和改变pH值时形貌均被破坏,因此实验选用反应速率较快的TMOS作为硅源进行反应制备二氧化硅纳米材料,以尽可能减小实验条件的改变对Ac-KI3VK-CONH2形成纳米管结构的破坏。
2.5 二氧化硅仿生矿化
2.5.1 乙醇加入量对二氧化硅形貌的影响
实验以TMOS为硅源,首先将其分散在溶剂中(水或水和乙醇的混合物),然后加入已经放置1周的多肽溶液中,进行矿化反应。在TMOS混合溶液中,TMOS的体积为20 μl,乙醇加入量分别取0、200、380 μl(总体积为400 μl,其余为水),调节溶液pH值至7.0,矿化时间为4 d。待矿化反应结束后将样品冻干,利用乙醇分散,通过TEM表征乙醇含量不同时矿化得到的二氧化硅纳米材料的形貌(图4)。

Fig.4 TEM images of silica obtained after 4 d incubation by using TMOS as silicon source and with different amounts of ethanol at pH 7.0
TEM结果表明,乙醇加入量不同的体系均形成了二氧化硅纳米管,且其形貌随乙醇加入量无明显变化。当不加入乙醇时,纳米管的外壁附着一层均匀的纳米二氧化硅,粒径分析表明此时形成二氧化硅纳米管的直径为50 nm左右,略大于多肽Ac-KI3VK-CONH2形成纳米管的尺寸,这主要是由于二氧化硅在多肽纳米管的外壁沉积造成的。尽管TMOS在水中不溶解,在没有乙醇,仅将其分散在水中即可保证矿化反应的进行。因此,下述实验体系中均未加入乙醇,仅用水分散TMOS,以降低有机溶剂乙醇的加入对多肽纳米管结构的破坏。
2.5.2 硅源浓度对二氧化硅形貌的影响
本部分考察了硅源TMOS的浓度对二氧化硅形貌和尺寸的影响。移取500 μl孵化1周的多肽溶液与TMOS含量不同(总体积为400 μl,TMOS含量分别为20、40、80 μl)的水溶液混合,再将溶液pH值用NaOH调至7.0,矿化4 d后将矿化产物冷冻干燥。利用乙醇分散产物并用TEM表征其形貌(图5)。

Fig.5 TEM images of silica obtained after 4 days incubation by using different amounts of TMOS as silicon source at pH 7.0
结果表明,加入20 μl TMOS时,纳米管外壁沉积的二氧化硅排列致密有序,矿化效果最为理想,粒径统计结果表明此时二氧化硅纳米管的管径为50 nm左右(图5a)。增加TMOS含量至40 μl时,矿化得到二氧化硅纳米管的管壁明显增厚,形成纳米管边缘仍较为平滑,但矿化产物中开始出现块状不规则的成分(图5b)。继续增加TMOS含量至80 μl时,形成二氧化硅纳米管表面出现明显毛刺,纳米管厚度不均匀,同时产物中出现大量不规则产物并覆盖在二氧化硅纳米管表面(图5c)。造成上述现象的主要原因是,当增加TMOS含量时,其局部浓度显著增加,矿化反应速率过快,导致纳米管管径不均匀,同时出现块状或者膜状结构。因此,TMOS的加入量显著影响矿化产物二氧化硅的形貌。当溶液总体积为900 μl,TMOS含量为10~30 μl时得到二氧化硅纳米管的尺寸较均匀,且表面较平滑。
2.5.3 硅源种类对二氧化硅形貌的影响
由于Ac-KI3VK-CONH2形成纳米管的稳定性较差,本文均以反应速率较快的TMOS作为硅源进行矿化,以降低溶液条件改变对多肽Ac-KI3VK-CONH2形成纳米管的破坏,保证反应模板的完整性。为考察硅源种类对矿化结果的影响,本部分用反应速率较慢的TEOS代替TMOS作为硅源进行实验。研究首先将TEOS分散在水中,然后与500 μl组装1周的多肽Ac-KI3VK-CONH2溶液混合,用NaOH将溶液pH值调至7.0,矿化4 d后将产物冷冻干燥。利用乙醇分散产物,通过TEM进行表征(图6)。

Fig.6 TEM images of silica obtained after 4 d incubation by using different silicon source as the precursors at pH 7.0
结果表明,以TEOS为硅源时,肽纳米管表面只沉积了少量二氧化硅,矿化效果不理想,这是由于TEOS的水解缩聚速率远远小于TMOS,在矿化过程中,TEOS的水解缩聚只产生少许的硅烷水解缩聚产物,因而只有少量二氧化硅可以附着在尺寸较大的管壁上,多数产物不规则;而以TMOS作为硅源的体系中,则得到了尺寸均匀的二氧化硅纳米管,说明以TMOS为硅源的矿化效果比TEOS理想。这表明,由于尺寸较大的多肽纳米管稳定性差,使用反应速率较快的TMOS更利于制备出形貌和尺寸均一的二氧化硅纳米管。
2.5.4 溶液pH值对二氧化硅形貌的影响
本部分考察了溶液pH值对二氧化硅形貌的影响,将500 μl放置1周的多肽溶液与400 μl TMOS溶液(20 μl TMOS+380 μl水)混合,分别调节pH值至5.0、7.0、8.0以及9.0,矿化4 d后将产物冷冻干燥,乙醇分散后利用TEM表征其形貌(图7)。

Fig.7 TEM images of silica obtained after 4 d incubation by using TMOS as silicon source at different pH values
TEM结果表明,在pH为5.0时,矿化效果不理想,仅形成了少量的二氧化硅纳米管,产物中存在大量无序结构。当调节溶液至中性或者碱性,使pH值为7.0、8.0和9.0时,均可得到形貌和尺寸均匀的二氧化硅纳米管,且其尺寸和形貌随pH值变化不大。
3 机理解释
自然界中生物矿化过程的发生往往和生物大分子密切相关,这些生物大分子一方面可以预先组装成特定的形貌结构,为矿化反应提供模板。同时,它们结构中都含有与矿化反应相关的活性基团,可为生物矿化提供反应位点。在对自然界生物矿化的研究中发现,许多在矿化过程中起关键作用的蛋白质主要由赖氨酸(K)、丝氨酸(S)、组氨酸(H)等氨基酸组成,其中K在二氧化硅矿化蛋白sillaffins中含量丰富,对二氧化硅的形成有十分重要的作用。本文设计的多肽Ac-KI3VK-CONH2包含两个K残基,在组装后分布在组装体纳米管的表面。当溶液为中性或者弱碱性时,其侧链氨基全部或部分质子化,此时多肽带正电,可为TMOS溶胶-凝胶转化提供充足的催化位点,促使其经过水解和缩合反应后形成硅酸以及聚硅酸,这些中间体容易去质子化,带有负电荷,使其在静电吸引力的驱动下聚集到肽纳米管的表面,最终矿化形成规则的二氧化硅纳米管,矿化过程和形成机理如图8所示。
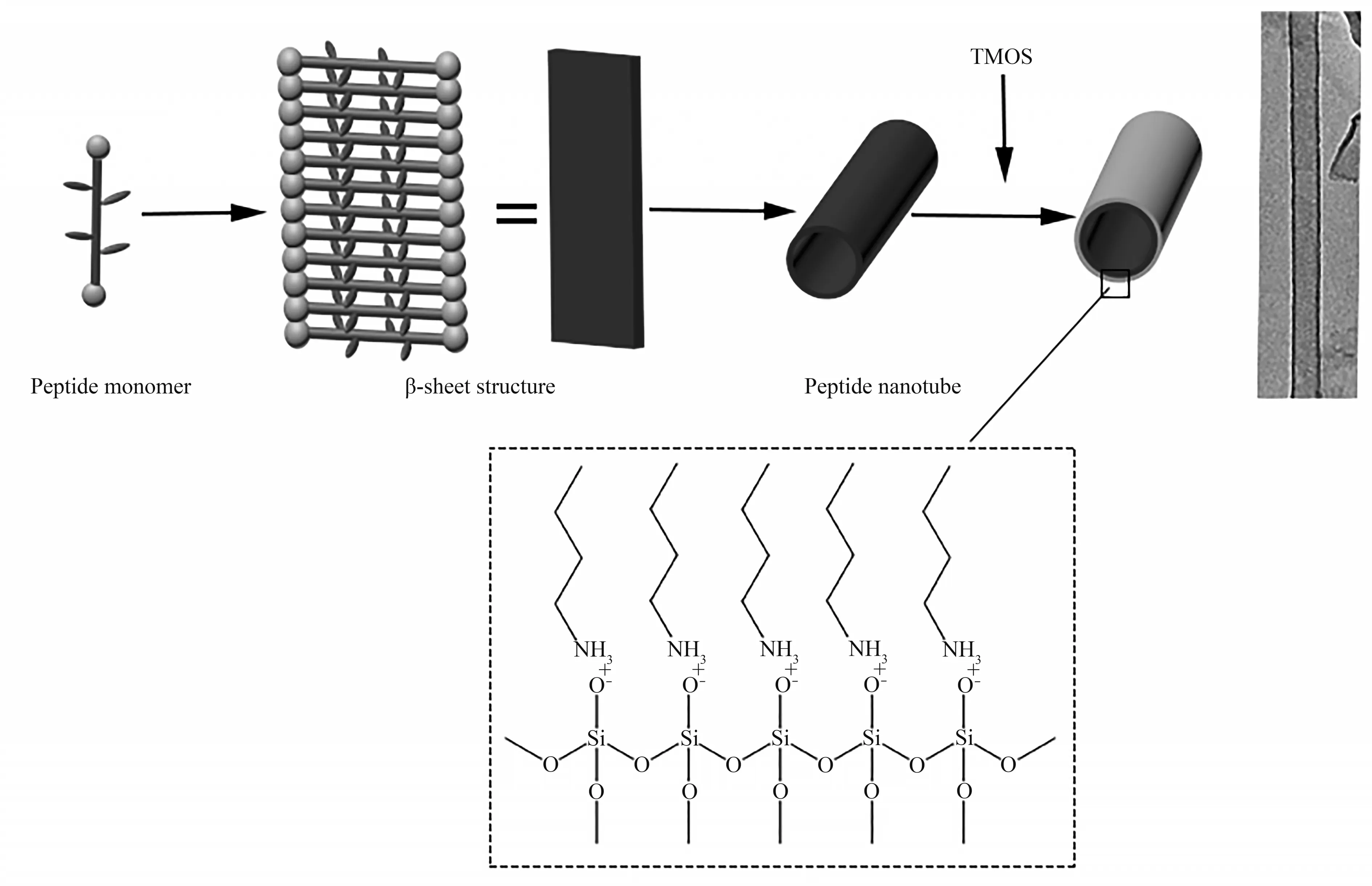
Fig.8 Proposed mechanism for the silica nanotubes fabrication by using peptide self-assemblies as templates
4 结 论
本文模拟自然界中生物矿化的过程,以短肽Ac-KI3VK-CONH2自组装形成的纳米管为模板,仿生矿化制备二氧化硅纳米材料。系统考察了不同反应条件,如是否加入乙醇、硅源种类、浓度和溶液pH值等因素对二氧化硅尺寸和形貌的影响,探索得到以TMOS为硅源、浓度为10~30 L/900 L、溶液pH值为中性或者弱碱性时,可矿化得到形貌规则且尺寸均匀的二氧化硅纳米管。上述研究为制备尺寸较大的二氧化硅纳米管提供了思路,可有效促进其在不同领域的应用。
附件见本文网络版(http://www.pibb.ac.cn或http://www.ncki.net):
PIBB_20210205_Fig S1.jpg
PIBB_20210205_Fig S2.jpg
PIBB_20210205_Fig S3.jpg
