苦参碱抗PCV2诱导小鼠肺炎的作用及其机制研究
2022-09-22张司寰岑龙座曹志刚孙盼盼孙耀贵范阔海李宏全
孙 娜 张司寰 岑龙座 曹志刚 张 华 孙盼盼孙耀贵 范阔海 尹 伟 李宏全*
(1.山西农业大学 动物医学学院/中兽医药现代化山西省重点实验室,山西 太谷 030801;2.山西农业大学 实验动物管理中心,山西 太谷 030801)
猪圆环病毒2型(Porcine circovirus type 2,PCV2)是养猪生产中常见的DNA病毒,PCV2与多种猪病综合征有关,包括断奶仔猪多系统衰竭综合征(PMWS)、猪皮炎与肾病综合征(PDNS)、猪呼吸道疾病综合征(PRDC)、幼龄仔猪的先天性震颤、猪繁殖障碍、肠炎和增生性坏死性肺炎等。由PCV2引起的疾病统称为猪圆环病毒病(Porcine circovirus associated diseases, PCVAD),其临诊表现主要为进行性消瘦、贫血、黄疸、腹泻、呼吸困难、母猪繁殖障碍和内脏器官的病理变化,特别是全身淋巴结的高度肿大、出血以及间质性肺炎[1]。疫苗免疫是防控病毒感染的有效手段,我国目前商业化的猪圆环病毒2型疫苗主要是灭活疫苗和基因工程亚单位疫苗。尽管PCV2疫苗的使用可一定程度上控制PCV2诱发的PMWS和PRDC[2],但PCV2毒株变异较快[3],现有疫苗的交叉保护效果差,且存在多病原的混合感染,因此,单纯疫苗免疫不能达到控制疾病发生的目的,亟需研制具有广谱抗病毒作用的药物。长期以来,天然产物在药物研发过程中起着重要作用,市面上的大多数药物都是直接或间接来源于天然产物。苦参碱(Matrine, MT)是从苦参中提取分离的一种生物碱。现已有大量研究证明苦参碱具有多种药理作用,主要包括抗炎、抗肿瘤、镇痛和心肺功能保护等药理作用[4]。此外,一些研究表明苦参碱具有广谱抗病毒作用,包括乙肝病毒[5]、人肠道病毒71型[6]、柯萨奇病毒(Coxsackie virus B3, CVB3)[7]、流感病毒(H3N2)[8]和新型冠状病毒[9]等。
本实验室前期的研究结果表明,苦参碱体外具有抗PCV2[10]、猪繁殖与呼吸综合征病毒(PRRSV)[11]和猪脑心肌炎病毒(EMCV)的作用[12],并利用细胞模型证实了苦参碱对PRRSV和LPS共刺激诱导的炎症反应具有抑制作用,其抗炎机制与MyD88/NF-κB和NLRP3炎症小体有关[13]。现有研究已表明,PCV2感染可激活NF-κB信号通路以诱发炎症反应[14-17]。本研究拟建立PCV2感染诱发昆明小鼠肺炎模型,体内评价苦参碱的抗PCV2诱发炎症的作用,并以NF-κB信号通路和 NLRP3 炎症小体为切入点,探究苦参碱的抗炎机制,以期为苦参碱作为抗病毒抗炎新兽药的临床应用奠定基础。本研究从中兽药中发掘抗病毒抗炎化合物,也为PCV2的防控提供新的研究思路和临床防治手段。
1 材料与方法
1.1 实验动物与试剂
32只SPF级昆明小鼠(雌性),体重(20±2) g,购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2020-0003。于山西农业大学实验动物管理中心适应性饲养7 d,饲养温度18~22 ℃,相对湿度50%~60%,让小鼠自由采食鼠粮,饮用蒸馏水。
本研究所用毒株为PCV2-SH,由南京农业大学姜平教授馈赠,中兽医药现代化山西省重点实验室经扩增保存,利用间接免疫荧光法(IFA)测定其半数组织培养感染剂量(TCID50)为105.4[18]。苦参碱(批号:110805-201709)购自中国食品药品检定研究院,纯度:98.7%;利巴韦林(CAS:36791-04-5)购自Solarbio,纯度:99.0%。
1.2 试验设计
选取4周龄32只雌性SPF级别昆明小鼠按体重随机均分成4组,每组8只,即:空白对照组、PCV2组(只感染PCV2)、苦参碱处理组(PCV2+40 mg/kg苦参碱)、利巴韦林阳性药物对照组(PCV2+40 mg/kg利巴韦林)。本实验室前期已通过测定苦参碱对昆明小鼠的半数致死量(LD50)得到苦参碱在昆明小鼠上的最大安全剂量为40 mg/kg,利巴韦林试验剂量为40 mg/kg[18]。适应性饲养7 d后,除空白对照组外,其他各组小鼠通过每只腹腔注射0.5 mL 105.4TCID50/mL的PCV2进行攻毒,同时对空白对照组小鼠腹腔注射等体积生理盐水,于接种PCV2后的第5天开始腹腔注射对应药物,每天按0.2 mL/10 g体重,定点给予40 mg/kg,连续用药5 d,空白对照组小鼠腹腔注射等体积的灭菌生理盐水。在PCV2接种后的第11天(用药6 d),剖检所有试验小鼠,采集肺脏样本,提取肺组织DNA、RNA和总蛋白,并制备肺组织病理切片。
1.3 肺组织切片制备和HE染色
解剖小鼠后立即取其大小合适的肺组织固定在Bouin’s固定液中,每隔24 h更换70%酒精,共换液3次。按照梯度酒精进行浸泡后浸蜡2.5 h,过夜包埋,随后进行修块、切片、展片和捞片,置于摊片机上40 ℃烘干。经苏木精-伊红染色后,中性树胶封片,正置荧光显微镜镜检。
1.4 荧光定量PCR(qPCR)检测PCV2 Cap基因和炎症相关基因的表达
取出-80 ℃冻存的各组小鼠肺组织样品,取适量放进装有液氮的研钵中,快速充分研磨至粉末状。提取肺组织DNA,用于检测各组PCV2Cap基因的表达量,提取方法参照天根生化科技(北京)有限公司的血液/细胞/组织 DNA 提取试剂盒使用说明书。参照TRIzol说明书进行RNA提取,用于检测各组炎症因子相关基因的表达量。采用Takara反转录试剂盒(去除gDNA)说明书合成cDNA。使用ND-1000核酸蛋白浓度测定仪分别检测DNA和RNA的质量浓度。分别以DNA或cDNA为模板,应用ABI 7500 Real-time PCR系统,根据Bimake荧光定量试剂说明书,qPCR检测PCV2Cap基因以及IL-1β、IL-6、IL-8和TNF-α基因的表达。以β-actin为管家基因,采用2-ΔΔCt法计算分析IL-1β、IL-6、IL-8和TNF-α相对表达量。制备Cap基因标准曲线,通过标准曲线计算各组Cap基因拷贝数。本研究所用基因引物由西安擎科泽西生物技术有限公司合成,引物序列见表1。

表1 本研究用于qPCR的引物序列Table 1 Primer sequences used for qPCR in the study
1.5 蛋白提取和Western blot
取出-80 ℃冻存的各组小鼠肺组织样品,取适量放进装有液氮的研钵中,快速充分研磨至粉末状。将RIPA buffer、蛋白酶抑制剂和磷酸酶抑制剂(Beyotime,中国)按照VRIPA∶V蛋白酶抑制剂∶V磷酸酶抑制剂=100∶1∶1的体积比例混匀形成的蛋白裂解工作液加至肺组织的粉末中。参照说明书提取组织总蛋白并采用BCA蛋白浓度测定试剂盒测定蛋白浓度。根据测得蛋白大小,经不同浓度SDS-PAGE电泳分离后,将目的蛋白转至PVDF膜上。转膜结束后,将PVDF膜完全浸泡于含5%脱脂奶粉的TBST封闭液中,在水平摇床上室温封闭2 h。按照表2加入相应一抗,4 ℃过夜孵育,然后加入二抗室温孵育1 h。按照eECL化学发光检测试剂盒说明书,配制发光液,用X-光胶片在暗室条件下进行显影、定影并成相,扫描后用Image J软件进行数据采集。
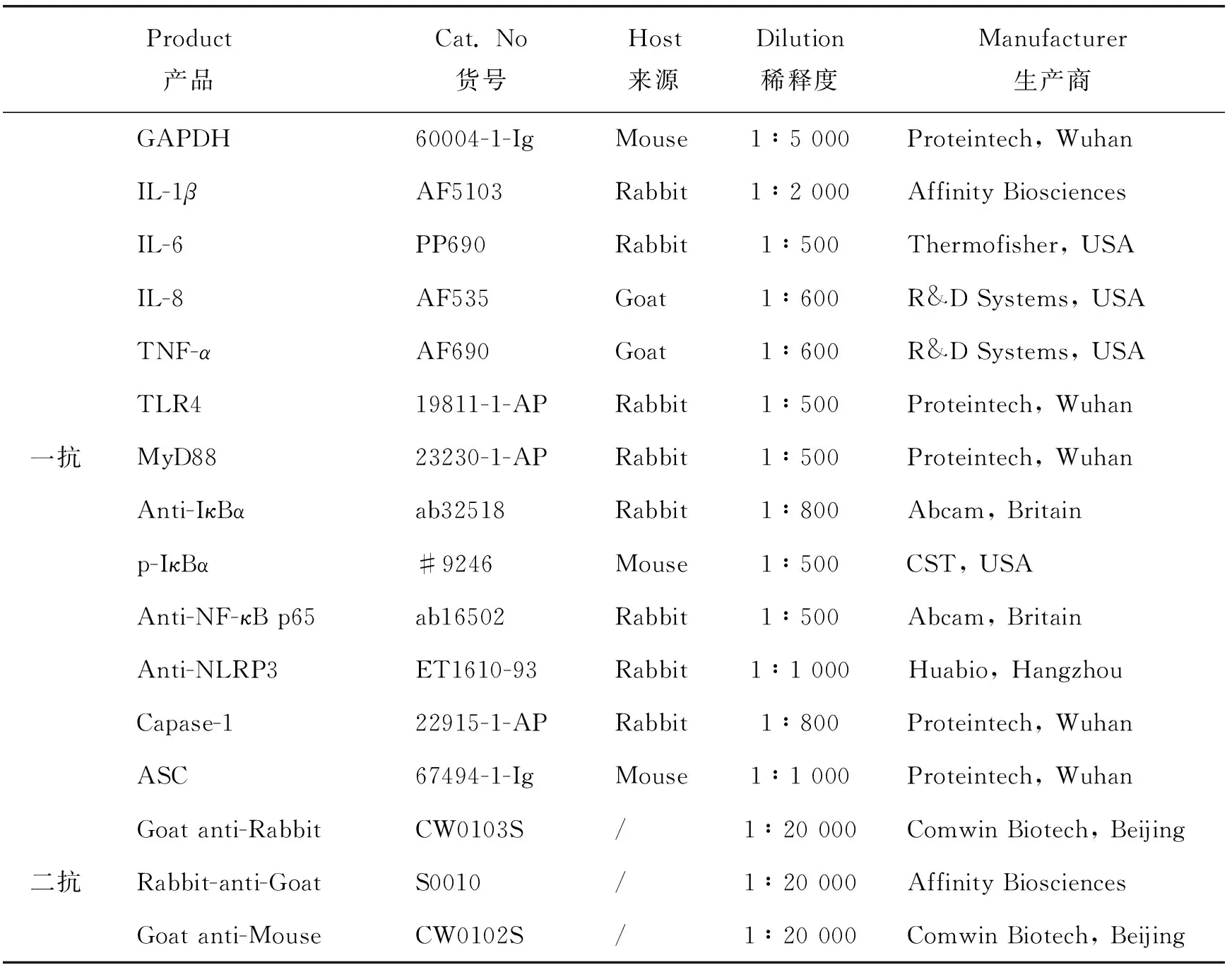
表2 本研究中用到的抗体信息Table 2 Antibody information in the study
1.6 数据分析
使用GraphPad Prism 8.0软件,利用单因素方差分析法(One-way ANOVA)进行数据分析,结果均采用平均值±标准差(Mean±SD)表示。*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1。利用Image J(National Institutes of Health,USA)软件对Western blot图像进行灰度值分析。
2 结果与分析
2.1 苦参碱对PCV2感染小鼠肺脏病理变化的影响
PCV2感染的第11天(用药6 d),固定肺脏组织,HE染色镜检观察肺脏病理学变化。从图1的HE染色结果看出,与空白组相比(图1(a)),PCV2组小鼠的肺间质显著增宽,肺泡腔显著缩小(粗箭头)。同时还观察到中等量的炎性细胞和红细胞浸润(细箭头),提示PCV2感染诱发了小鼠间质性肺炎(图1(b))。与PCV2组相比,苦参碱处理组(图1(c))和阳性对照组(图1(d))能不同程度的改善PCV2感染诱导的肺间质增宽、肺泡腔缩小等病理变化。

(a)空白组;(b)PCV2组;(c)苦参碱处理组;(d)阳性对照组放大倍率:400×。比例尺:50 μm。
2.2 苦参碱对PCV2感染小鼠肺脏组织中Cap基因表达的影响
给药结束后,提取肺脏组织DNA,qPCR检测苦参碱对各组小鼠肺脏组织中 PCV2Cap基因的表达量,如图2所示。与PCV2组相比,苦参碱处理组显著降低小鼠肺脏组织中Cap基因的表达量(P<0.05),表明苦参碱可抑制PCV2在小鼠肺脏组织中的复制。

与PCV2组相比,*表示P<0.05;**表示P<0.01。Compared with PCV2 group, * means P<0.05; ** means P<0.01.
2.3 苦参碱下调PCV2感染小鼠肺组织中IL-1β、IL-6、IL-8和TNF-α mRNA和蛋白水平的表达
在PCV2感染小鼠11 d(用药第6 天)解剖各组小鼠,取其肺组织,提取RNA及总蛋白,采用qPCR和Western blot检测苦参碱对各组PCV2感染后的小鼠肺组织中4个炎症相关因子mRNA和蛋白表达的影响。qPCR检测结果显示(图3),与空白组比,PCV2组的IL-1β(P<0.05)、IL-6(P<0.01)、IL-8(P<0.000 1)和TNF-α(P<0.05) mRNA 的表达量显著升高,提示PCV2感染诱发了小鼠肺脏炎症。与PCV2组相比,苦参碱处理组和阳性对照组均不同程度地降低了IL-1β、IL-6、IL-8和TNF-αmRNA的表达量。
Western blot结果显示(图4),与空白组比,PCV2组的IL-1β、IL-6、IL-8和TNF-α蛋白的相对表达量显著升高(P<0.000 1)。与PCV2组比,苦参碱组和利巴韦林阳性药物组均显著降低IL-1β、IL-6、IL-8和 TNF-α蛋白的表达(P<0.000 1),进一步证实了苦参碱对炎症因子表达的抑制作用。
2.4 苦参碱抑制TLR4/MyD88/NF-κB信号通路
苦参碱作用于PCV2感染小鼠11 d(用药6 d)后,Western blot检测苦参碱对各组小鼠肺组织中TLR4、MyD88、IκBα、p-IκBα和NF-κB p65蛋白的表达水平的影响,结果显示(图5),与空白组相比,PCV2组中TLR4和MyD88蛋白的表达水平显著上升(P<0.000 1);IκBα蛋白表达水平显著下降(P<0.000 1),p-IκBα和p65表达水平显著上升(P<0.001),表明PCV2感染小鼠后,肺组织中TLR4/MyD88/NF-κB信号通路被激活。与PCV2组相比,苦参碱组显著降低了TLR4(P<0.000 1)、MyD88(P<0.000 1)、p-IκBα(P<0.000 1)和p65(P<0.01)蛋白的表达,升高IκBα(P<0.001)的表达。表明苦参碱在PCV2感染下可抑制小鼠肺组织中TLR4/MyD88/NF-κB通路的活化。
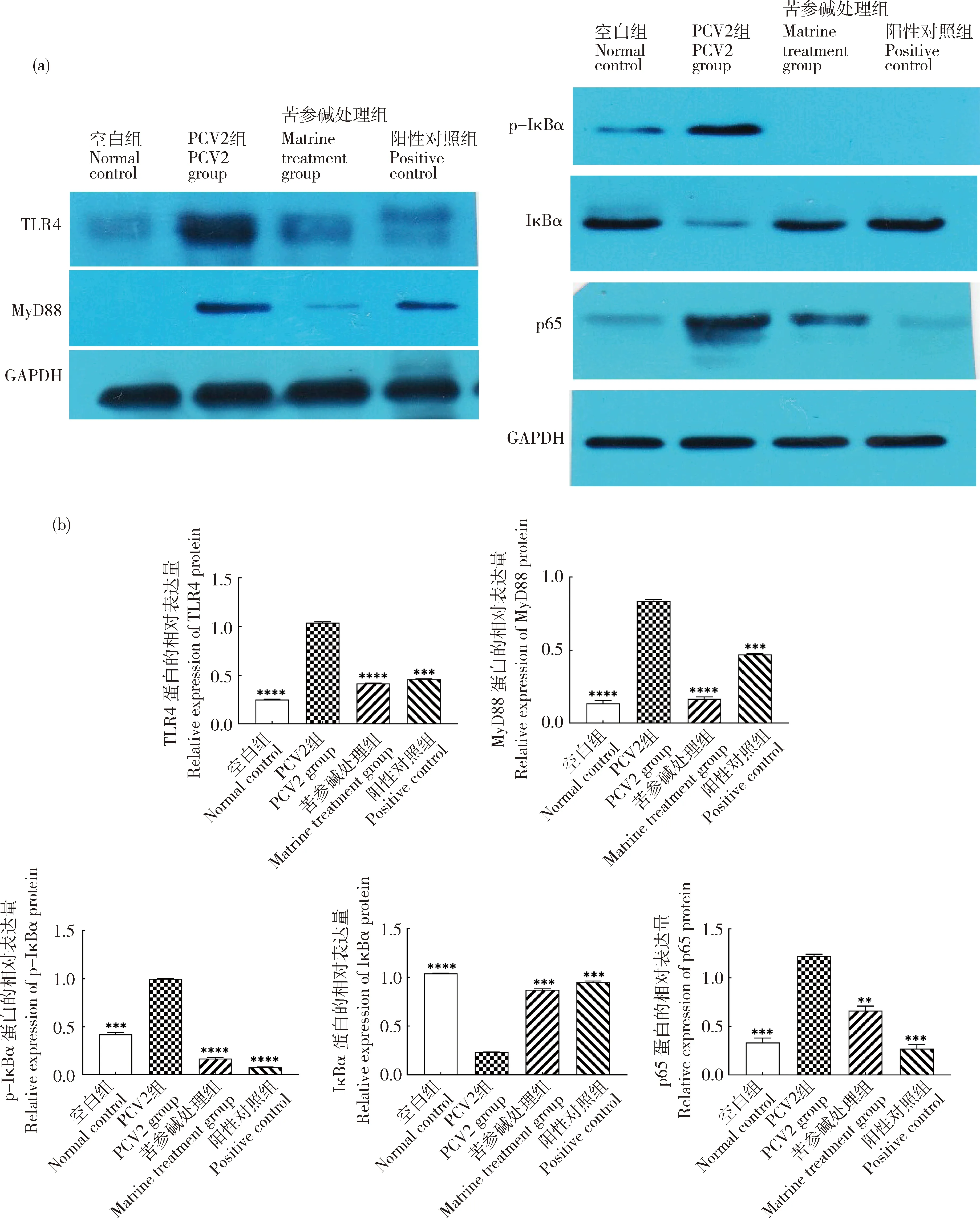
与PCV2组相比,**表示P<0.01;***表示P<0.001;****表示P<0.000 1。
2.5 苦参碱抑制NLRP3炎症小体的活化
Western blot检测NLRP3炎性小体复合物中NLRP3、ASC和Caspase-1的表达情况。结果显示(图6),与空白对照组相比,PCV2组显著升高NLRP3、ASC和Caspase-1蛋白的表达(P<0.000 1)。与PCV2组相比,苦参碱组显著降低NLRP3、ASC和Caspase-1蛋白的表达(P<0.000 1)。提示PCV2感染能够激活NLRP3炎症小体,而苦参碱对其有抑制作用。

与PCV2组相比,****表示P<0.000 1。
3 讨 论
实验室前期已证实苦参碱可显著抑制PCV2在小鼠肝脏中的复制[19],在本研究中,通过每只腹腔注射0.5 mL 105.4TCID50/mL的PCV2进行攻毒,经检测肺脏组织中PCV2Cap基因的表达量,发现苦参碱亦显著抑制PCV2Cap基因在小鼠肺脏中的复制。这些结果均证实了通过腹腔注射的方式可建立PCV2感染昆明小鼠模型,且苦参碱具有抗PCV2作用。PCV2感染小鼠后会引起肺间隔增宽、肺泡腔缩小等病理现象,这与PCV2感染仔猪后出现的肺部病理变化相一致[20],通过qPCR和Western blot检测炎性因子,结果表明,PCV2感染小鼠后肺组织中一系列炎性因子(IL-1β、IL-6、IL-8和TNF-α)的mRNA和蛋白表达量均显著升高,提示采用PCV2诱发小鼠的肺炎模型来研究药物的抗炎作用及机理具有一定的科学性和可行性。本研究中,苦参碱处理后,可显著降低PCV2诱导的小鼠肺脏组织中IL-1β、IL-6、IL-8和TNF-α基因和蛋白的表达,表明苦参碱能抑制PCV2感染小鼠诱发的炎性反应。Chu等[21]研究表明苦参碱可显著减少自身免疫性脑脊髓炎诱发的TNF-α、IL-6和IL-1β等炎症因子的产生,且苦参碱是通过抑制HMGB1/TLR4/NF-κB信号通路来发挥抗炎作用的。
TLRs是一类模式识别受体,在先天性免疫应答中起重要作用。TLR4是TLR家族成员之一,MyD88是TLR4/NF-κB途径中的衔接蛋白[22]。NF-κB在抗病毒感染的正常免疫反应中发挥至关重要的作用,且作为关键介质参与炎症反应的调节,但异常活化的NF-κB是引起炎症反应的主要原因[23]。研究表明,PCV2可通过介导MyD88/NF-κB信号通路来调节体外培养猪肺泡巨噬细胞分泌IL-1β、IL-6和IL-10等炎症因子[17]。在本研究中,PCV2感染小鼠后,显著升高了TLR4、MyD88和p-IκBα 和NF-κB p65的表达,降低了IκBα的表达,表明PCV2感染激活了TLR4/MyD88/NF-κB信号通路,这与先前体外研究结果一致[24],而苦参碱干预后能显著抑制这一通路的活化,表明苦参碱通过抑制TLR4/MyD88/NF-κB信号通路的激活来发挥其抗炎作用。Xue等[25]在研究黄芪多糖抗PCV2作用机制时,同样发现黄芪多糖可通过抑制NF-κB信号通路和氧化应激反应来发挥其抗病毒作用。在研究苦参多糖[26]和马尾藻多糖[27]的抗PCV2作用时也得到的类似的结果。提示NF-κB信号通路是药物发挥抗病毒、抗炎作用的核心通路。
NLRP3炎症小体及其相关蛋白和下游炎症因子的异常表达与肺部炎症性相关疾病有重大的关联,如慢性阻塞性肺炎、支原体肺炎等[28]。Zhao等[29]总结了NLRP3炎症小体与病毒感染的相关性,并提出NLRP3炎症小体是药物发挥抗病毒作用的重要靶标之一。现已鉴定出大约40种靶向NLRP3炎症小体的天然化合物[30]。已有研究表明PCV2可通过激活NF-κB/NLRP3信号通路以介导促炎细胞因子IL-1β的表达[31]。本研究中,PCV2感染可诱导NLRP3炎症小体的激活,而苦参碱处理组可显著抑制NLRP3、ASC和Caspase-1的表达,表明苦参碱可通过抑制NLRP3炎症小体的活化来抑制促炎因子IL-1β的分泌和表达。实验室前期在PRRSV感染模型上,同样发现了苦参碱对NLRP3炎症小体的抑制作用[13]。
4 结 论
本研究证实苦参碱可明显改善PCV2诱导的小鼠肺间质增宽的病理现象并降低小鼠肺组织中炎症因子IL-1β、IL-6、IL-8和TNF-α mRNA和蛋白表达水平。苦参碱通过抑制TLR4/MyD88/NF-κB 信号通路以及 NLRP3 炎症小体的激活来发挥其抗炎作用。
