甜荞FeHSP83基因的克隆及其在逆境胁迫下的表达分析
2022-09-21熊泽浩朱旭东周宾寒侯泽豪许嘉盛罗旖柔方正武
徐 锐,熊泽浩,朱旭东,周宾寒,侯泽豪,许嘉盛,罗旖柔,方正武
(长江大学农学院,主要粮食作物产业化湖北省协同创新中心,湖北 荆州 434025)
随着全球环境的变化,干旱、高温、盐碱等非生物胁迫已经成为影响植物正常生长的关键因素。荞麦是蓼科(Polygonaceae)荞麦属(FagopyrumMill)药食两用的草本植物,主要分为苦荞(FagopyrumtataricumGaertn)、甜荞(FagopyrumesculentumMoench)两个栽培种。其中甜荞作为一种重要的粮食作物和经济作物,在我国北方干旱地区得到了大量种植。因此,开展荞麦抗逆研究对于培育植物抗逆新品种具有重要意义。
热激蛋白(Heat shock proteins, HSPs)也被称为热休克蛋白,是植物遭遇高温等非生物胁迫时诱导生物体合成的一类保护性蛋白。大多数真核细胞生物体内都有种类丰富的HSPs存在[1],一般根据蛋白质大小以及同源关系,将其分为五大类,分别是HSP60、HSP70、HSP90、HSP110和小分子量sHSP 家族[2],其中HSP90家族蛋白主要存在于真核细胞中,约占细胞蛋白总数的1%~2%[3];在结构上包含有两个保守结构域,N-端为ATP酶结合域、C-端含有二聚合体结合区,中间段为氨基酸,是一个主要受ATP调控的二聚体伴侣蛋白[4]。已有研究表明HSP90在控制细胞周期、细胞生存、激素等多个细胞过程中扮演重要角色[5],且与其他蛋白间存在互作关系,如Hsp40、p23FKBP52等[6]。近年来,HSP90家族研究逐渐成为热点[7]。另外,HSP90作为一种功能专一的蛋白折叠工具,在生物体的存活和逆境胁迫应答方面有着重要意义[8]。同时HSP90作为分子伴侣,参与辅助了其他蛋白的合成与加工,在生物体机能维护方面起到了极其重要的作用[9]。
目前HSP90家族在辣椒(CapsicumannuumL.)[10]、南瓜(Cucurbitamoschata)[11]、番茄(Solanumlycopersicum)[12]等植物中得到了广泛的研究,但其在甜荞逆境胁迫条件下的分析却鲜有报道。本试验以‘西农9976’为材料开展研究,通过同源克隆的方法得到荞麦FeHSP83基因序列,在此基础上对该序列进行生物信息学分析,通过进化树亲缘关系比对,发现其隶属于HSP90家族成员,与此同时运用qRT-PCR的方法探究该基因在干旱、盐胁迫条件下的表达情况,分析该基因在荞麦中的表达模式,为荞麦培育抗旱抗盐品种提供优异的基因资源。
1 材料与方法
1.1 植物材料、生长条件及胁迫处理
试验用甜荞品种为‘西农9976’,挑选饱满无病害的种子,经消毒冲洗后,置于铺有双层滤纸的培养皿中,25℃恒温催芽,待种子长出根时,将长势相同的荞麦种子移栽至水培盒中,进行常规水肥管理。待幼苗长出2~3片真叶后,使用15% PEG 6000溶液和0.1% NaCl溶液对荞麦幼苗进行胁迫处理,在分别处理3、6、12、24、48 h后对幼苗和根部进行取样,将胁迫前的材料作为对照,每个处理设置3个生理学重复,样品通过液氮速冻后放置-80℃冰箱中保存备用。
1.2 供试仪器与试剂
PCR扩增采用Bio-rad T-100 PCR仪(美国Bio-rad公司);凝胶成像仪购自上海培清科技有限公司。RNA提取试剂盒(RN38)购自北京艾德莱生物科技有限公司;反转录试剂盒(TaKaRa)及金牌MIX购自北京擎科生物科技有限公司;荧光定量试剂盒、感受态细胞引物合成和DNA测序也均由北京擎科生物科技有限公司完成。
1.3 FeHSP83基因克隆
荞麦嫩叶基因组DNA,总RNA提取法参考CTAB法[13-14],得到RNA后利用反转录试剂盒逆转录RNA得到cDNA,具体试验步骤参照试剂盒说明书进行。以cDNA为模板,使用引物FeHSP83-F/FeHSP83-R(表1)对基因进行扩增。PCR反应体系如下:cDNA 2 μL,上下游引物各1.5 μL,金牌MIX 45 μL。PCR反应条件为:98℃预变性2 min,98℃变性10 s,56℃退火10 s,72℃延伸30 s,35个循环,72℃延伸5 min,4℃保温。PCR产物使用1.0%琼脂凝胶电泳进行检测,产物保存于-20℃备用。参照凝胶试剂盒回收目的条带,采用007VS载体连接回收产物,转化大肠杆菌DH5α感受态细胞,通过AMP抗生素进行筛选,挑选阳性克隆进行测序。
1.4 FeHSP83基因的生物信息学分析
通过NCBI(https://www.ncbi.nlm.nih.gov)数据库网站ORF Finder分析目标基因编码区;利用在线软件ProtParam(http://web.expasy.org/protparam/)分析目标基因基本理化特性;利用MEGA7.0软件,以邻接法(Neighbor-joining,NJ;bootstrap=1000)构建进化树;通过WOLF PSORT(https://www.genscript.com/wolf-psort.html) 在线软件进行蛋白亚细胞定位预测;使用SWISS-MODEL(https://swissmodel.expasy.org/interactive)对蛋白质三级结构进行预测。
1.5 FeHSP83基因的qRT-PCR分析
以反转录的cDNA第一链为模板,将其稀释10倍后用于荧光定量分析。设计FeHSP83基因对应的荧光定量引物,根据TB Green(TaKaRa,大连)荧光定量试剂盒操作说明书在CFX96 real-time PCR 仪器(美国BioRad公司)上进行qRT-PCR。qRT-PCR反应体系为20 μL、100 ng cDNA模板、引物各0.6 μL和10 μLPCR-mix(2×)。qRT-PCR反应体系为:95℃,30s,(95℃,10s;55℃,30s)×40个循环。试验以β-Actin为内参基因,试验数据通过CK对样品做标准化处理,并使用2-ΔΔct法计算基因的相对表达量。
1.6 数据处理
通过SPSS 19.0软件对数据进行单因素方差分析,利用Excel 2019和SPSS 19.0软件对数据进行整理和统计分析,最后使用Excel 2019软件绘制基因表达量的柱状图。
2 结果与分析
2.1 FeHSP83基因的克隆
以甜荞cDNA为模板,使用表1中的引物进行扩增,连接007VS载体后转化大肠杆菌,利用AMP抗生素筛选阳性克隆,成功获得了目的条带,通过观察PCR产物凝胶电泳图(图1)可知,PCR扩增得到的长度大约为2 100 bp,与预期的片段大小基本一致。通过BLAST对比发现,甜荞HSP83基因与藜麦HSP83基因同源性达到80%以上,证实在西农9976中获得了HSP83基因,将其命名为FeHSP83。
2.2 生物信息学分析
2.2.1 FeHSP83蛋白质理化性质与序列分析 通过ProtParam软件对FeHSP83蛋白理化特性分析表明,该基因蛋白相对分子量约为80.97 kDa,理论等电点为4.96,总共包括11408个原子,分子式为C3592H5721N933O1137S25。在组成FeHSP83编码蛋白的704 个氨基酸中,谷氨酸(Glu)含量最高,达到了12.5%,负电荷残基143个,正电荷残基109个,脂溶指数为82.56,蛋白的不稳定参数为41.03,具有较强亲水性。
2.2.2 FeHSP83蛋白的同源比对和进化分析 利用NCBI数据库,将FeHSP83基因编码的氨基酸序列与甜菜(BvHSP83)、黎麦(CqHSP83)、花生(AhHSP83)的HSP83氨基酸序列进行对比(图2),结果显示,其蛋白氨基酸长度极为相似,同源性达97.06%,说明FeHSP83蛋白在这几个作物中存在较高的相似性。

图2 FeHSP83与其他物种同源蛋白的多序列比对分析结果Fig.2 Multi-alignment of FeHSP83 amino acid sequence with other HSP83s
通过进化树的构建,发现甜荞FeHSP83蛋白与甜菜、藜麦HSP83蛋白的亲缘关系较近,与番茄、辣椒等作物的HSP83蛋白亲缘关系较远(图3)。进一步对比发现,同一分支上的甜菜、藜麦与甜荞都为藜科植物,这种进化关系符合形态学分类规律,由此我们可推测FeHSP83基因具有较高的保守性。
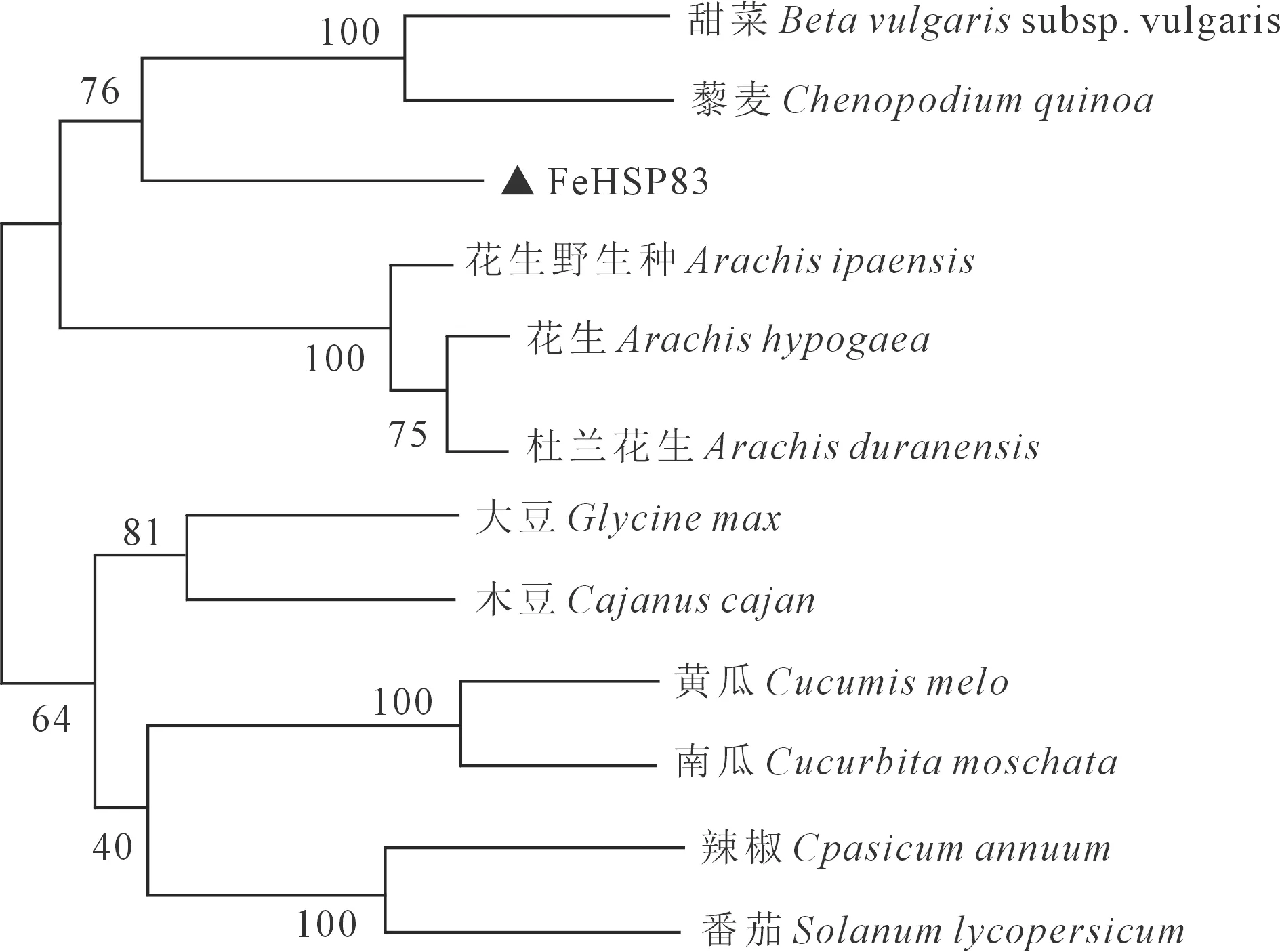
图3 FeHSP83与其他物种HSP83蛋白的系统发育进化树Fig.3 Phylogenetic analysis of FeHSP83 with other HSP83-like proteins
2.2.3 FeHSP83蛋白亚细胞定位 WOLF PSORT预测表明,该蛋白主要存在于细胞质,推测其编码蛋白可能在细胞核外发挥作用。使用SWISS-MODEL网站对FeHSP83蛋白的三级结构进行预测,其结构如图4所示。

图4 FeHSP83蛋白的三级结构预测分析结果Fig.4 Prediction of three-dimensional structure of FeHSP83 protein
2.3 FeHSP83基因的表达分析
实时荧光定量PCR结果显示(图5),经干旱和盐胁迫处理后,FeHSP83基因能较快响应胁迫,且在根、叶不同部位的表达量存在较大差异。在干旱胁迫条件下,FeHSP83在植株根部的表达量持续上升,至48 h达到最大,响应较为强烈;叶的表达量呈先升后降的状态,在48 h时表达量最高,12 h时表达量较低。在盐胁迫条件下,FeHSP83在植株叶部的响应较为强烈,在12 h时表达量达到最高,之后开始下降;根部的表达量在3 h时迅速升高,随后缓慢下降。

图5 FeHSP83在甜荞不同组织中的表达分析Fig.5 Relative expression analysis of FeHSP83 in different tissues of sweet buckwheat
3 讨 论
热激蛋白(HSPs)是一类在生物体受到外界胁迫时由转录因子诱导合成产生的高度保守的蛋白质家族。目前,HSP被报道主要有三类生物学功能:(1)分子伴侣,能够帮助其他的蛋白质折叠、转运,而自身不参与相关代谢;(2)获得耐热性;(3)调控细胞骨架动力学[15]。HSP90作为HSP家族中的一员,分子量大约为90 KD,通常以同型二聚体结构存在于真核细胞中,王彬等[11]研究发现,CmHSP90基因参与了中国南瓜对逆境的应答,表达量与其定位以及执行的功能有一定关系。叶绿体HSP90主要参与光和热激的信号转导,而线粒体HSP90的功能较为特殊,主要作用为免受氧化胁迫带来的伤害。此外,有研究显示,热激转录因子(HSFs)在逆境信号传导过程中起着重要的作用,大量HSP家族基因表达受其调控。
甜荞是我国重要的经济作物,有很高的营养价值和药用价值,其生育期短、适应性强、耐贫瘠等优点,在干旱地区作物布局中具有极其重要的地位。本研究根据已知序列进行FeHSP83基因的引物设计,从甜荞品种西农9976中成功克隆了FeHSP83基因的编码序列,在对该基因进行生物信息学分析后发现FeHSP83基因具有HSP90家族所有的Pfam区域,在进化关系上与藜麦FeHSP83蛋白、甜菜FeHSP83蛋白较为接近,与番茄FeHSP83蛋白相距较远,推测FeHSP83蛋白隶属于HSP90家族,在功能上可能与藜麦较为相似,具有较高的同源保守性。
本研究基于转录组测序结果分析,发现了逆境胁迫条件下特异性表达基因FeHSP83,实时荧光定量PCR结果显示在干旱和盐胁迫条件下,FeHSP83基因在甜荞幼苗子叶和根部的表达量显著上升,且在根和叶不同部位间的反应存在较大差异。在干旱胁迫处理下,甜荞幼苗子叶和根部反应迅速,子叶部分表达量相对较大,而在盐胁迫条件下,甜荞幼苗子叶和根部反应较为迟缓,根部的表达量远高于子叶部分。因此,我们可以推测,FeHSP83基因参与了甜荞对逆境胁迫的应答,在甜荞抗旱研究中起到一定作用。在后续的研究中,我们可以通过农杆菌介导转化法,构建超量表达载体转入荞麦,进一步探究FeHSP83基因在逆境胁迫下的调控机制,为荞麦的抗逆分子育种奠定基础。
