基于16S rDNA测序技术分析利福平致大鼠肝损伤中肠道菌群变化特征
2022-09-21杨璐铭郝金奇裴盛斐唐琴艳高学磊李玉红郝明媛冯福民
杨璐铭,郝金奇,2,王 林,裴盛斐,郭 玉,唐琴艳,李 玥,高学磊,李玉红,4,郝明媛,冯福民,
利福平(rifampicin,RFP)是WHO推荐使用的一线抗结核药物之一,然而经RFP治疗的结核病患者会出现血清转氨酶升高、轻度肝炎、肝脏胆汁淤积等肝损伤表现[1]。这种抗结核药物性肝损伤(anti-tuberculosis drug-induced liver injury,ADLI)已成为结核病治疗中的一大难题,肠道微生物组学研究的进展为ADLI的预防和治疗提供了新思路。
人类肠道微生物群由1 000多种细菌组成[2]。肠道菌群处于生态平衡状态时可以抵抗致病菌并且防止致病菌过度繁殖,但当大量使用抗生素或抗菌药物后,肠道菌群的生态平衡被破坏,进而通过肠-肝轴调控肝脏疾病的进展[3]。此外,肠道菌群也可通过分泌对甲酚来降低对乙酰氨基酚的磺化作用,进而导致药物性肝损伤的发生[4]。而RFP治疗后的肠道菌群变化特征与ADLI的发生是否有关联仍需研究。该研究使用16S rDNA测序技术分析RFP致ADLI大鼠模型中肠道菌群的变化特征。
1 材料与方法
1.1 实验动物SPF级雄性SD大鼠24只,6~8周龄、体质量180~250 g,购自北京维通利华实验动物技术有限公司,饲养于华北理工大学实验动物中心,大鼠自由进食与饮水,交替照明各12 h,温度24 ℃左右,相对湿度60%~80%。本研究已获华北理工大学动物伦理委员会审查批准(批文号:LX2018137)。
1.2 主要试剂RFP购自日本TCI公司,丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)检测试剂盒购自南京建成生物工程研究所。
1.3 RFP灌胃液配制称取RFP粉末1.2 g溶解于60 ml生理盐水中,配置成浓度为20 mg/ml的RFP灌胃液。
1.4 动物分组24只SD雄性大鼠经适应性喂养1周,随机分为对照组(D0组,n=8)、RFP灌胃10 d组(R10组,n=8)、RFP灌胃28 d组(R28组,n=8)。对照组大鼠在0 d处死,其余两组给予100 mg/(kg·d) RFP灌胃,分别于连续灌胃10 d和28 d后处死各组所有大鼠。
1.5 标本采集末次给药24 h后,收集大鼠新鲜粪便颗粒于5 ml无菌冻存管中,置于-80 ℃保存。处死大鼠,取肝组织,经HE染色后观察组织形态。
1.6 ALT、AST检测按照试剂盒说明书进行操作,在96孔板中加入ALT、AST基液和血清,37 ℃孵育30 min,各孔中加入2,4-二硝基肼,37 ℃孵育20 min,各孔加入NaOH,室温静置。使用酶标仪检测吸光度(optical density,OD)值。
1.7 16S rDNA测序使用随机数字表法每组选取4只大鼠的粪便标本送至上海美吉生物医药科技有限公司进行16S rDNA测序。设计16S rDNA V3~V4区域的引物,引物序列为F:5′-NNNNCCTA-CGGGNGGCWGCAG-3′、R:5′-NNNNGGACTACHVG-GGTATCTAATCC-3′,扩增16S rDNA片段,将获得PCR产物进行纯化后,采用Qubit 2.0测定纯化后的PCR扩增子浓度,构建cDNA文库,使用IlluminaMiSeq平台来测序。
1.8 肠道菌群测序结果分析Alpha多样性分析采用Sobs指数和Shannon指数;β多样性分析采用主坐标分析(principalco-ordinatesanalysis,PCoA),并使用相似性分析(analysisofsimilarities,Anosim)来评估组间差异;分别从门和属水平比较各组大鼠肠道菌群组成。
1.9 统计学处理使用STAMP和R软件进行组间差异分析。STAMP软件中的ANOVA检验和Rstats包中的Kruskal-Wallis秩和检验用于多组间差异分析,Wilcoxon秩和检验用于两组间差异分析。P<0.05为差异有统计学意义。
2 结果
2.1 实验大鼠肝组织HE染色结果D0组肝小叶结构正常,肝细胞形态完整,整齐排列,细胞核大小正常;R10组肝细胞排列紊乱、细胞质疏松,伴有气球样变和点状坏死;R28组可见肝小叶结构破坏,大面积肝细胞溶解性坏死且部分细胞核染色变深。见图1。与R0组比较,R10组和R28组ALT、AST水平升高(P<0.05),差异有统计学意义,见表1。表明随着RFP灌胃时间的延长,肝细胞出现损伤现象,大鼠ADLI造模成功。
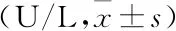
表1 三组大鼠血清ALT、AST水平变化

图1 三组大鼠肝组织病理学光镜图 ×200
2.2 实验大鼠肠道菌群结构的变化Sobs指数和Shannon指数可以反映群落物种数量和群落多样性,D0组、R10组、R28组Sobs指数差异有统计学意义(P<0.05),Shannon指数差异无统计学意义(P>0.05),见图2。通过PCoA图对肠道菌群进行β多样性分析,可以直观的看到D0组、R10组、R28组明显分开,而各组组内样本呈现聚集现象,第一主成分(PC1)和第二主成分(PC2)分别解释了总变量的33.93%和23.35%;结合Anosim分析,三组大鼠组内肠道菌群结构相似,各组间肠道菌群结构差异有统计学意义(P<0.01),见图3。说明在RFP致大鼠肝损伤过程中改变了肠道菌群结构及其丰富度,而多样性未发生改变。
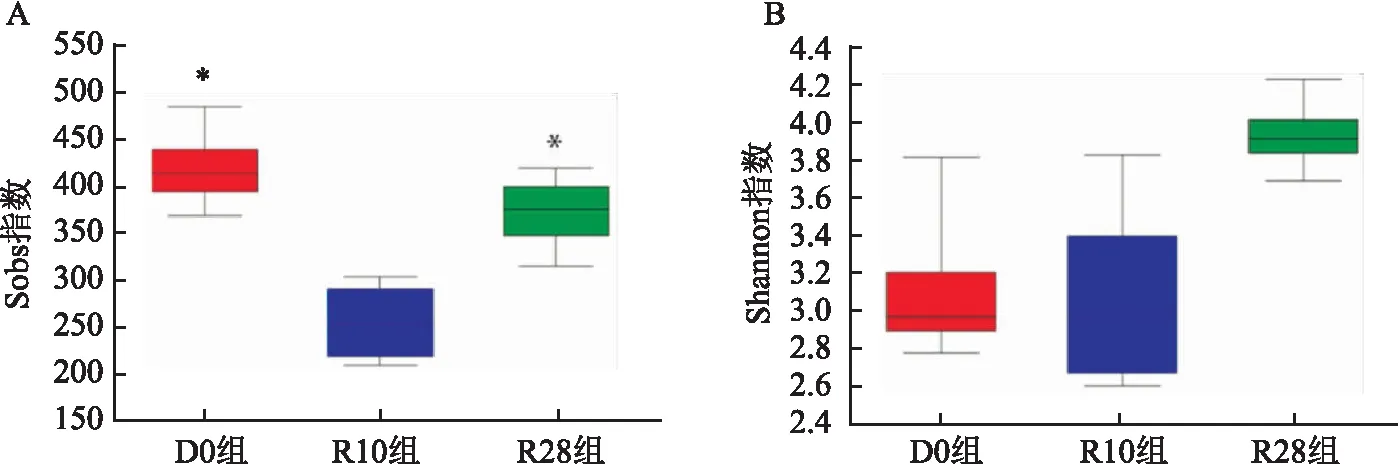
图2 三组大鼠肠道菌群的Alpha多样性

图3 三组大鼠肠道菌群的PCoA图
2.3 实验大鼠肠道菌群物种组成分析根据OUT物种注释结果,三组大鼠在门水平上主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)和Proteobacteria构成,其中Firmicutes和Bacteroidetes占细菌总数的85%以上,在三组中均丰度最高。Kruskal-Wallis检验结果显示,在三组中丰度变化有差异的是Firmicutes、Bacteroidetes、Actinobacteria和Verrucomicrobia。与D0组大鼠比较,随着给予RFP药物时间的延长,Bacteroidetes丰度增加,Firmicutes丰度减少,Actinobacteria丰度先增加后减少,Verrucomicrobia丰度先减少后增加(P<0.05)。其中Firmicutes、Bacteroidetes、Actinobacteria丰度变化较明显,D0组、R10组、R28组Firmicutes丰度分别为72%、53%、32%;Bacteroidetes丰度分别为17%、33%、61%;Actinobacteria丰度分别为4%、16%、2%。进一步两两比较,与D0组比较,R10组Firmicutes和Patescibacteria丰度减少,R28组Firmicutes和Actinobacteria丰度减少,Bacteroidetes丰度增加(P<0.05);与R10组比较,R28组Actinobacteria丰度减少(P<0.05)。见图4。

图4 三组大鼠肠道菌群在门水平的组成及差异分析
在属水平上,三组大鼠粪便样本中共有Lactobaclllus、Bifidobacterium、Romboutsia等21个属,Kruskal-Wallis检验结果显示,三组大鼠肠道菌群相对丰度有统计学差异的属共15个。与D0组比较,随着给予RFP药物时间的延长unclassified_f_Prevotellaceae、Blautia、Prevotellaceae_NK3B31_group、Erysipelotrichaceae_uCG-003、Fournierella丰度增加,Lactobacillus、Romboutsia、Ruminococcaceae_uCG-014丰度减少,Bifidobacterium、Dubosiella、Faecalibaculum丰度先增加后减少,Alloprevotella、Akkermansia、Prevotellaceae_Ga6A1_group、Ruminococcus_1丰度先减少后增加(均P<0.05),其中Lactobacillus丰度变化较为明显,D0组、R10组、R28组Lactobacillus丰度分别为52%、34%、8%;与D0组比较,R10组Dubosiella、unclassified_f_lachnospiraceae、Faecalibaculum丰度增加,R28组norank_f_Muribaculaceae、Ruminococcus_1丰度增加,Lactobacillus丰度减少;与R10组比较,R28组Lactobacillus、Faecalibaculum丰度减少,Ruminococcus_1丰度增加(P<0.05)。见图5。
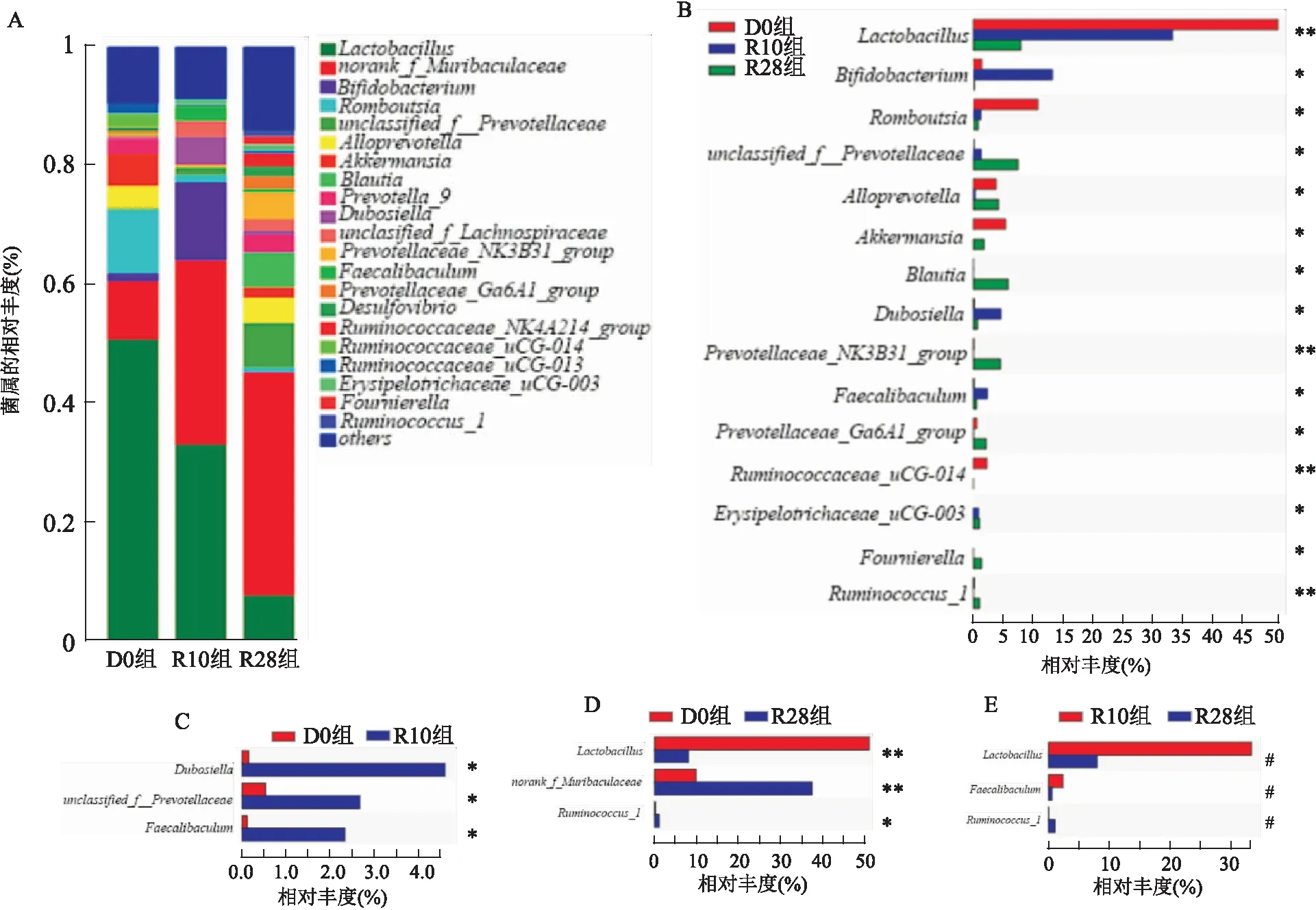
图5 三组大鼠肠道菌群在属水平的组成及差异分析
3 讨论
肠道菌群是衡量机体健康程度及水平的指标之一,已有研究发现肠道菌群多样性与多种疾病有关。本研究选择16S rDNA高通量测序技术对RFP诱导大鼠肝损伤模型中的肠道菌群多样性进行分析,其结果能够有效解释粪便标本中肠道菌群的物种分布、丰度、差异以及进化关系,为RFP诱导的ADLI机制研究提供了新的视角,为ADLI的预防及治疗提供实验理论基础。
肠道是微生物群的天然栖息地,菌群可以通过各种途径发挥作用。有益菌群,比如粪球菌属(Coprococcus)、假丁酸弧菌属(Pseudobutyrivibrio)、罗氏菌属(Rothia)等,可以通过产生短链脂肪酸而使宿主受益[5]。在本研究中,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)在RFP构建的大鼠ADLI模型中是绝对优势菌群,随着给予RFP药物时间的延长,Bacteroidetes丰度增加,Firmicutes丰度减少,虽然影响了其组成比例,但未影响优势菌群的种类。Firmicutes和Bacteroidetes在不同的肝脏疾病均被证实可以影响疾病的进展,比如,Bacteroidetes减少,放线菌门(Actinobacteria)的增加,会导致肝病的恶化[6]。也有研究发现,在酒精性肝病发生后,起到抗炎和保护黏膜作用的Firmicutes呈现显著降低[7]。大鼠给予RFP灌胃后,Bacteroidetes丰度增加,说明Bacteroidetes参与了ADLI发生,但因果关系尚不明确。
同样的,有研究报道指出肠道微生物群对药物的代谢有直接和间接的影响[8],这导致肠道菌群中有益菌群和致病菌群丰度变化程度不同,这可能是Actinobacteria丰度先增加后减少的原因,进一步的,在属水平上,本研究发现在ADLI大鼠肠道中Lactobacillus数量减少,Lactobacillus作为一种有益共生菌属,可增强小鼠肝脏的核转录因子E2相关因子2活性,进而起到保护肝脏免受氧化性损伤[9]。在慢性肝炎患者和全身炎症反应综合征患者粪便中均表现出致病菌数量增加,Bifidobacterium和Lactobacillus等有益菌的数量减少[10-11],与本研究结果一致。
本研究通过对大鼠肠道菌群的分析,证实了RFP致ADLI的发生改变了大鼠肠道菌群的丰度,未改变其多样性,菌群的结构和组成均发生了改变,有益菌减少,致病菌增多。本研究对大鼠的饲养过程进行了严格的质量控制,提升了肠道菌群与ADLI之间联系的可靠性,然而大鼠的饲养时间也可能是一个影响因素,未能在每个时间点设置空白对照组是本研究的局限性。肠道菌群数量较多,组成复杂,探究关键菌群在ADLI中如何发挥作用仍是进一步研究的重点。
