青蛤I型溶菌酶在毕赤酵母中的重组DNA表达
2022-09-21冯付霭钱韻芳
冯付霭,赵 震,陶 妍,2,谢 晶,2,钱韻芳,2
( 1.上海海洋大学 食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 201306 )
溶菌酶在大多数生物先天性免疫系统中发挥重要作用,其主要包括植物、动物和微生物来源的溶菌酶[1];而动物来源的溶菌酶则可分为鸡型(C型)、鹅型(G型)和无脊椎动物型(I型),其中研究最多、最具代表性的是C型,即鸡蛋清中的天然C型溶菌酶。水产动物溶菌酶的研究起步较晚,但因其特殊的作用机理及其在动物免疫中的重要作用而越来越受到关注[2]。鱼类等脊椎动物中仅存在C、G型溶菌酶,而贝类等无脊椎动物中3种类型溶菌酶均存在[3]。三者之间在一级结构上存在较大差异,C型溶菌酶含保守的8个半胱氨酸残基,鱼类G型溶菌酶大多数缺乏半胱氨酸残基;而I型溶菌酶含多至14个的半胱氨酸残基,以致在空间上可形成7对二硫键而赋予其结构的高稳定性[4-5]。自1975年Jollès等[6]从海星Asteriasrubens中分离出第一个I型溶菌酶以来,已从斑节对虾(Penaeusmonodon)[7]、仿刺参(Apostichopusjaponicus)[8]、青蛤(Cyclinasinensis)[9]、剃刀蛤(Sinonovaculaconstricta)[10]和文昌鱼(Branchiostomajaponicum)[3]等无脊椎动物中克隆到I型溶菌酶基因。
曾有学者对文昌鱼施行鳗弧菌(Vibrioanguillarum)挑战试验,发现其鳃中C型和G型溶菌酶基因的mRNA转录水平并无明显变化,但I型溶菌酶的转录水平在24 h后明显提高[3];有研究显示,将菲律宾蛤仔(Ruditapesphilippinarum)置于人为设置的鳗弧菌污染的养殖环境中,其I型溶菌酶基因在血细胞中的转录水平显著提高[11];此外,当剃刀蛤在有副溶血性弧菌(V.parahemolyticus)的环境中生长时,其鳃和肝胰腺中I型溶菌酶基因的转录水平显著增加[10]。由此可以确定I型溶菌酶是无脊椎动物的重要蛋白质免疫因子,因此其可以成为开发天然抗菌剂的良好候选者。曾有学者构建了剃刀蛤和仿刺参的I型溶菌酶的原核表达系统,最初获得的是无活性的表达产物,对其进行基于尿素透析的复性处理后才使其显示部分活性[10,12];另有学者通过巴斯德毕赤酵母(Pichiapastoris)表达系统获得克氏原螯虾(Procambarusclarkii)的重组I型溶菌酶,其显示了抗多种细菌的生物学活性[13]。
青蛤是我国沿海重要的经济贝类之一,其作为滤食性的水产生物,具有较强的抗逆能力。研究表明,在有鳗弧菌的养殖环境中生长的青蛤,其体内的某些溶菌酶的转录水平会明显提高[9]。对其C型溶菌酶基因进行了cDNA克隆及基于重组毕赤酵母的生物合成研究,发现重组C型溶菌酶具有良好的抑菌活性和稳定性[14]。然而,关于青蛤I型溶菌酶的重组表达方面的研究尚未见报道。据此,笔者拟通过构建重组毕赤酵母菌株,实现青蛤I型溶菌酶的分泌表达,旨在为无脊椎动物来源I型溶菌酶的制备提供重组DNA技术。
1 材料与方法
1.1 材料
1.1.1 试验动物、载体和菌株
青蛤来源于上海市鱼港路海鲜市场;pMD-19T来源于日本TaKaRa公司;pPICZαA和毕赤酵母X-33来源于美国Invitrogen公司(pPICZαA属穿梭载体,它含众多限制性酶切位点以便于目的基因与其连接构建重组载体;此外,它含有强诱导型醇氧化酶启动子5′AOX1和分泌信号肽α-factor,前者可以利用甲醇表达任何外源基因,而后者能够实现外源蛋白的持续分泌表达);大肠杆菌(Escherichiacoli)DH5α来源于北京天根生物科技有限公司;试验细菌为副溶血性弧菌(ATCC17802)、大肠杆菌(ATCC25922)、金黄色葡萄球菌(Staphylococcusaureus,ATCC6538)。
1.1.2 主要试剂
RNAiso plus、Taq DNA 聚合酶、T4DNA连接酶和3种核酸内切酶(Xba Ⅰ、Xho Ⅰ、Sac Ⅰ)来源于日本TaKaRa公司;Fastking cDNA第1链合成试剂盒、DNA分子量标准、胶上DNA和酵母基因组DNA以及质粒提取的试剂盒来源于北京天根生物科技有限公司;蛋白质分子量标准来源于北京中科瑞泰生物科技有限公司;Western Blot试剂盒来源于北京康为世纪生物科技有限公司。DNA测序和PCR引物的合成委托生工生物工程(上海)股份有限公司完成。用于培养细菌和毕赤酵母的所有培养基配方(LB、YPD、MM、MD、BMGY、BMMY)见毕赤酵母表达系统手册(Invitrogen公司)。
1.2 方法
1.2.1 反转录PCR扩增青蛤I型溶菌酶基因
新鲜青蛤采购后快速运至实验室,立即取其闭壳肌,按RNAiso Plus说明书提取总RNA。第1链cDNA的合成:2 μL总RNA、1 μL 3′ RACE Adaptor primer (5 μmol/L)、2 μL 5×Prime Script Buffer、1 μL dNTPs Mixture (10 mmol/L each)、0.25 μL RNase Inhibitor (40 U/μL)、0.25 μL Prime Script RTase (200 U/μL)、3.5 μL RNase-Free dH2O;先42 ℃ 60 min,再70 ℃ 15 min。
参考青蛤I型溶菌酶基因序列(GenBank登录号:HQ651175)设计引物(表1)。以第1链 cDNA 为模板、F1和 R1为引物,通过PCR扩增编码青蛤I型溶菌酶的全长cDNA。PCR体系:1 μL 10×Taq Buffer、0.8 μL dNTPs(2.5 μmol/L each)、各 0.2 μL 的F1和R1(10 μmol/L)、0.1 μL第1链 cDNA、0.1 μL Taq DNA聚合酶(2.5 U/μL),调至总量10 μL。PCR程序:94 ℃ 3 min;94 ℃ 40 s,56.5 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 5 min。以pMD-19T为克隆载体,将第1次PCR产物与其连接后转入大肠杆菌DH5α细胞,经选择性培养基培养后挑取白色菌落用于阳性克隆的筛选,入选的阳性克隆由生工生物工程(上海)股份有限公司进行DNA测序。在此基础上再分别以2对引物(F2、R2和F2、R3)(表1)进行第2次和第3次PCR,以在5′端(Xho Ⅰ位点、Kex 2信号肽酶切位点)和3′端(6×His标签、终止密码子、Xba Ⅰ位点)添加相关位点,反应体系和程序同第1次PCR,退火温度分别改为58.6 ℃和58.4 ℃。最终获得的目的片段同上经DNA测序后命名为青蛤I型溶菌酶(CslyI)基因。经ExPASy软件(http://web.expasy.org/compute.pi/)预测CslyI的分子质量。

表1 引物序列Tab.1 Primer sequence
1.2.2 pPICZαA-CslyI和X-33/pPICZαA-CslyI的构建
pMD-19T-CslyI经Xba Ⅰ和Xho Ⅰ双酶切后获得目的片段CslyI,按试剂盒说明书将其与pPICZαA连接构建重组表达载体pPICZαA-CslyI(图1),再转入大肠杆菌DH5α细胞后经增殖培养、按照快速小提质粒试剂盒说明书提取纯化重组载体pPICZαA-CslyI,通过双酶切、菌落PCR和DNA测序对其进行确证。双酶切反应体系:70 μL重组载体、10 μL 10×M Buffer、10 μL 0.1% BSA、5 μL Xho Ⅰ(15 U/μL)、4 μL Xba Ⅰ(10 U/μL),37 ℃反应8 h。
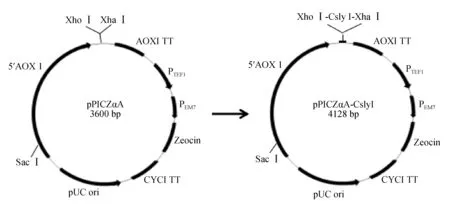
图1 重组表达载体pPICZαA-CslyI的构建Fig.1 Construction of recombinant expression vector pPICZαA-CslyI
使用Sac Ⅰ对pPICZαA-CslyI进行线性化酶切后,将其与毕赤酵母X-33按1∶8(体积比)混合,置于电转杯中冰浴数分钟后电击5 ms (1.5 kV、25 μF、200 Ω);加入1 mol/L的山梨醇1 mL,约1.5 h后加入YPD培养基1 mL于摇床培养1.5 h;菌体涂于含100 μg/mL博莱霉素YPD平板,于29 ℃培养3~5 d。挑选长势饱满的酵母单菌落再依次接种至含1000 μg/mL博莱霉素MM、MD、YPD平板,经培养后筛选优质的X-33/pPICZαA-CslyI酵母转化子,并使用5′AOX 1和3′AOX 1(表1)对其基因组DNA进行PCR鉴定。另外,同上方法构建X-33/pPICZαA酵母转化子作为阴性对照。
1.2.3 重组青蛤I型溶菌酶的诱导表达和鉴定
于5 mL的YPD培养基中接种入优质的酵母转化子后,28 ℃、250 r/min摇床培养16 h;转接250 μL于50 mL的BMGY培养基中,在同样条件下培养48 h;菌体重悬于250 mL的BMMY培养基(含1%甲醇)中,再培养72 h。通过Tricine-SDS-PAGE分析离心后的培养液上清[4%浓缩胶、18%分离胶、9%三羟甲基氨基甲烷(Tris)、0.1%十二烷基硫酸钠(SDS)]。
Western blot分析按试剂盒说明书进行:凝胶上的蛋白质条带被电转至聚偏二氟乙烯膜后,加入封闭液8 mL反应1 h;用1×TBST两次洗膜后再分别与鼠单克隆抗体和山羊抗小鼠单克隆抗体反应2 h和1 h;经洗膜后使用HRP-DAB试剂盒对其显色。由上海中科新生命生物科技有限公司对经镍离子亲和层析纯化后的重组蛋白进行基于MALDI-TOF-TOF的序列分析。
1.2.4 重组青蛤I型溶菌酶的抑菌活性及稳定性测定
将培养至600 nm吸光值[D(600 nm)]为0.5的副溶血性弧菌、大肠杆菌和金黄色葡萄球菌分别稀释100倍后,按1∶100(体积比)与X-33/pPICZαA-CslyI的培养液上清液于37 ℃作用2 h;然后取30 μL涂于LB平板上,37 ℃培养至菌落长出。以X-33/pPICZαA的培养液上清液作为阴性对照。
另一方面,将40 μL金黄色葡萄球菌和大肠杆菌分别注入96孔板中,加入经100 ℃沸水浴保温0、20、40、60 min的80 μL培养液上清液,于37 ℃孵育过夜后使用酶标仪(BioTeK®,美国)测定D(600 nm),以考察经高温处理不同时间后的培养液上清液对细菌的抑制作用[15]。每个试验组3个平行,使用SPSS 21.0对数据进行统计分析。
2 结 果
2.1 青蛤I型溶菌酶(CslyI)基因的cDNA克隆
经过3次PCR依次扩增到590、516、528 bp的cDNA片段,最后的PCR产物为青蛤I型溶菌酶(CslyI)基因(图2),其DNA测序结果见图3,Xho Ⅰ和Xba Ⅰ 2个限制性位点、Kex 2信号肽酶切位点及6×His标签均被添加。除去这些位点,CslyI基因编码了由162个氨基酸残基组成的青蛤I型溶菌酶成熟肽,含有的14个保守半胱氨酸残基可以在空间上形成7对二硫键以稳定其空间结构。经分析,CslyI的理论分子质量为19.97 ku,等电点为7.6。

图2 PCR产物的琼脂糖凝胶电泳Fig.2 Agarose gel electrophoresis of PCR productsM.DNA标记;1.第1次PCR扩增片段;2.第2次PCR扩增片段;3.第3次PCR扩增片段.M.DNA marker;1.the first PCR amplification fragment;2.the second PCR amplification fragment;3.the third PCR amplification fragment.

图3 目的基因CslyI的核苷酸及其推断的氨基酸序列Fig.3 Nucleotide and deduced amino acid sequences of the target gene CslyI斜体指示Xho Ⅰ和Xba Ⅰ酶切位点;下划线指示Kex 2信号肽酶切位点;阴影指示半胱氨酸残基.Italics indicate Xho Ⅰ and Xba Ⅰ restriction sites;underline indicates Kex 2 signal cleavage site;cysteine residues are shaded.
2.2 pPICZαA-CslyI的鉴定及其X-33/pPICZαA-CslyI的筛选
以DH5α/pPICZαA-CslyI为模板,使用引物5′AOX1和3′AOX1对重组表达载体pPICZαA-CslyI进行PCR鉴定,扩增到1个约1000 bp的片段,与1030 bp的理论值相符(图4a)。另一方面,使用Xho Ⅰ和 Xba Ⅰ对pPICZαA-CslyI进行双酶切后显示,在略高于500 bp处有淡淡的条带,与预期的528 bp相符(图4b)。最终通过DNA测序证明目的基因CslyI已正确连接至pPICZαA表达载体。通过含1000 μg/mL博莱霉素的YPD平板筛选到5株高拷贝的X-33/pPICZαA-CslyI重组菌株,对它们的基因组DNA的验证结果显示,5株重组酵母菌均扩增到约1000 bp的片段(图4c),与预期的1030 bp相符。
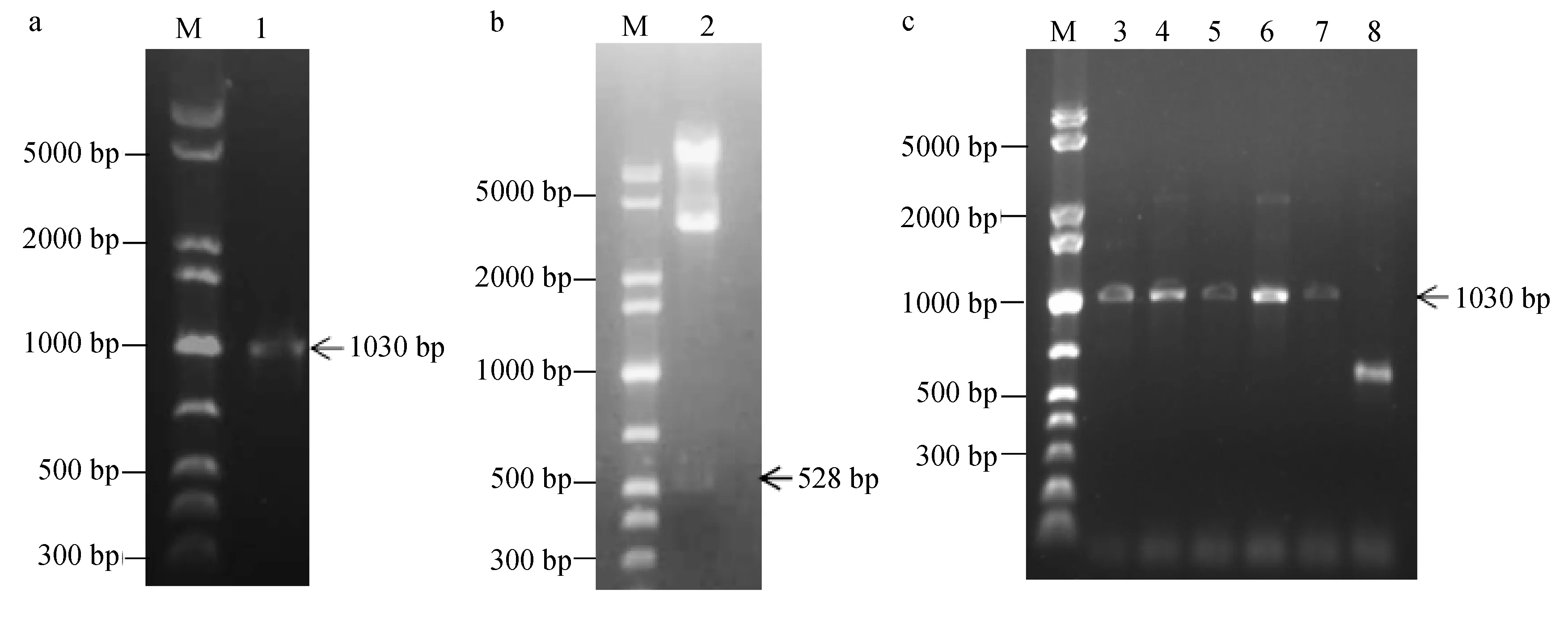
图4 pPICZαA-CslyI的菌落PCR(a)和双酶切验证(b)及X-33/pPICZαA-CslyI的筛选(c)Fig.4 Identification of pPICZαA-CslyI by colony PCR (a) and digestion of two endonucleases (b) as well as screening of X-33/pPICZαA-CslyI (c)M.DNA标记;1.PCR产物;2.双酶切产物;3~7.含pPICZαA-CslyI的酵母转化子;8.含pPICZαA的酵母转化子.M.DNA marker;lane 1.PCR product;lane 2.pPICZαA-CslyI products digested by two endonucleases;lanes 3~7.yeast transformants containing pPICZαA-CslyI;lane 8.yeast transformant containing pPICZαA.
2.3 在毕赤酵母中表达重组蛋白
选择6号菌株用于重组蛋白质的诱导表达,Tricine-SDS-PAGE结果显示(图5a):培养液上清液在靠近22.0 ku 处存在明显条带,基本接近重组蛋白的理论分子质量19.97 ku,初步推测其为目的蛋白;其条带位置偏上可能与待分析蛋白质样品变性不完全有关[16],以下试验结果将进一步证明此判断。

图5 重组菌株表达产物的Tricine-SDS-PAGE(a)和Western blot(b)分析Fig.5 Tricine-SDS-PAGE (a) and Western blot (b) analysis for the recombinant strain productsM1.超低蛋白质分子质量标准;M2.彩虹预染蛋白质分子质量标准;1.含pPICZαA的酵母转化子培养液上清液;2.含pPICZαA-CslyI的酵母转化子培养液上清液.M1.ultra-low protein molecular weight marker;M2:rainbow pre-stained protein molecular weight marker;lane 1.culture supernatant of yeast transformant containing pPICZαA;lane 2.culture supernatant of yeast transformant containing pPICZαA-CslyI.
2.4 基于Western blot和MALDI-TOF-TOF质谱的表达产物鉴定
通过Western blot对X-33/pPICZαA-CslyI的培养液上清液进行分析,其为1个近25 ku的单一明显杂交条带,其分子质量明显高于理论分子质量 19.97 ku(图5b),分析原因可能与使用的彩虹预染蛋白质分子量标准有关,即目的蛋白与显色染料共价偶联后,减慢了其在凝胶中的迁移速度,以致显示的分子量变大,此现象在笔者之前的研究中也有出现。而X-33/pPICZαA的培养液上清液未出现任何杂交条带。进一步对表达产物的MALDI-TOF-TOF质谱进行分析,结果显示,在m/z1441.8~2727.4 之间捕获到2个肽段:m/z为1499.7352的峰代表自N端起第143~155的肽段(GCKSGSTIGYWQR)(图6)、m/z为2251.0564的峰代表自N端起第67~85的肽段(NVGCKMDIGSYSCGYFQIK)。两者与推断的氨基酸理论序列完全一致,证明了表达产物即为预期的重组青蛤I型溶菌酶。
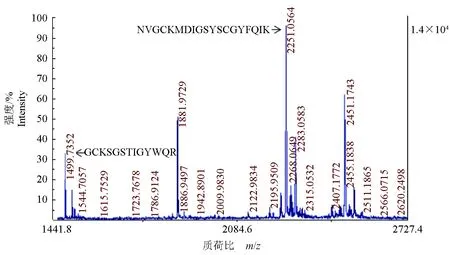
图6 表达产物的MALDI-TOF-TOF质谱分析Fig.6 MALDI-TOF-TOF mass spectrometry analysis of the expressed products大写字母指示氨基酸序列.Capital letters indicate amino acid sequences.
2.5 重组青蛤I型溶菌酶的抑菌活性和稳定性
基于平板涂布法的抑菌活性测定结果显示,菌株X-33/pPICZαA-CslyI的培养液上清液与金黄色葡萄球菌、大肠杆菌和副溶血性弧菌作用后,菌落数明显少于阴性对照(X-33/pPICZαA的培养液上清液与细菌作用)(图7)。另一方面,为了考察重组青蛤I型溶菌酶的热稳定性,将培养液上清液置于沸水浴中保温不同时间后与金黄色葡萄球菌和大肠杆菌作用,保温20、40、60 min后的培养液上清液仍然对上述2种细菌具有抑菌活性(图8),与阴性对照组差异不显著(P>0.05),表明青蛤I型溶菌酶具有良好的热稳定性。

图7 重组青蛤I型溶菌酶的抑菌活性Fig.7 Antibacterial activity of the recombinant protein CslyIin clam C. sinensis1.用X-33/pPICZαA的培养液上清液处理的细菌;2.用X-33/pPICZαA-CslyI的培养液上清液处理的细菌.1.bacteria treated with X-33/pPICZαA culture supernatant;2.bacteria treated with X-33/pPICZαA-CslyI culture supernatant.
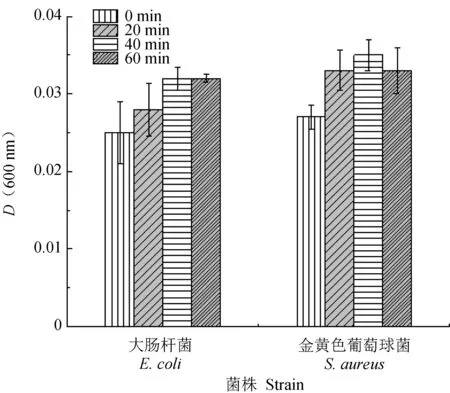
图8 高温处理对重组青蛤I型溶菌酶抑菌活性的影响Fig.8 Effect of high temperature on the antibacterial activity of recombinant CslyI in clam C. sinensis
3 讨 论
3.1 影响重组青蛤I型溶菌酶表达量的因素
通过构建青蛤I型溶菌酶的重组毕赤酵母表达系统,首次获得具有抑菌活性的重组青蛤I型溶菌酶,但表达量很低。可能有2个原因:(1)菌体接种量偏低。本次试验使用的培养基含酵母浸出物和优质蛋白胨,它较以前使用的无氨基氮源培养基营养丰富,更有利于菌体生长,故尝试将菌体接种量减为0.5%;但本试验结果显示,减少接种量会影响重组青蛤I型溶菌酶的表达量。有研究表明,菌体接种量为2%~10%,随着接种量的增加重组蛋白质的表达量会随之增加[17]。(2)根据Graphical Codon Usage Analyser(http://www.gcua.schoedl.de)预测,笔者通过反转录PCR克隆的青蛤I型溶菌酶cDNA中存在19个对于毕赤酵母来说的低频密码子,该现象可能会影响重组蛋白质的高效表达。有学者报道,其根据毕赤酵母的密码子喜好优化了纳豆激酶成熟肽的基因nkD,结果发现使用合成的优化基因后使重组纳豆激酶成熟肽的表达量提高了3.5倍[18];另有学者对人源溶菌酶基因LYZop进行优化后,发现其在牛乳腺上皮细胞中的表达量提高2.2倍,在牛成纤维细胞中的表达量提高2.44倍[19]。综上,进一步的研究将关注于菌体的接种量和密码子的优化。
3.2 重组青蛤I型溶菌酶热稳定性的结构基础
有研究表明,二硫键的作用是叠加的,且引入二硫键突变体的蛋白质的变性温度较野生型蛋白质高很多[20]。笔者对重组青蛤I型溶菌酶的热稳定性测定发现,经100 ℃处理60 min时,其抑菌活性较对照组并无明显下降,证明重组青蛤I型溶菌酶具有良好的稳定性。分析原因可能与其一级结构中含多至14个的半胱氨酸残基有关,经SWISS MODEL在线软件(https:∥swissmodel.expasy.org/)初步预测,这些半胱氨酸残基在空间上通过7对二硫键将数个α-螺旋与无规卷曲等二级结构单元缔合在一起,形成紧密的球状蛋白质而极大地稳定了重组青蛤I型溶菌酶的结构。也有学者将海参I型溶菌酶置于85 ℃水浴中保温50 min,发现其仍具有80%的相对酶活性[21]。
3.3 基于重组青蛤I型溶菌酶特性的应用展望
就目前水产养殖业的发展和食品安全而论,绿色无抗生素饲料的应用必将成为主要的趋势,因此,具有良好热稳定性的重组青蛤I型溶菌酶极具开发和使用价值。饲料生产中饵料的制作一般须经历原料的粉碎、机械化处理和颗粒化或压块等过程[22],这些过程必然会伴随温度的上升,而热稳定性良好的重组青蛤I型溶菌酶则能够抵抗高温的影响,从而成为水产饲料添加剂的极佳候选者。此外,含重组青蛤I型溶菌酶的培养液上清液对金黄色葡萄球菌、大肠杆菌和副溶血性弧菌具有良好的抑菌活性,预示了大规模制备时对培养液上清液无需进行纯化即可将其作为生产天然抗菌剂的原液,这既简化了工业上的操作流程,也节约了生产成本。
4 结 论
通过反转录PCR获得编码青蛤I型溶菌酶的成熟肽基因CslyI,并成功构建了X-33/pPICZαA-CslyI毕赤酵母重组菌株;该菌株于28 ℃、250 r/min、1%甲醇、72 h的发酵条件下,成功表达重组青蛤I型溶菌酶;经抑菌试验证明,重组青蛤I型溶菌酶具有明显的抗金黄色葡萄球菌、大肠杆菌和副溶血性弧菌的活性,并在高温下显示良好的稳定性。试验结果可为无脊椎动物来源I型溶菌酶的制备提供基于重组毕赤酵母的生物合成技术。
