泥鳅鳃出血病病原菌及其拮抗菌的分离鉴定
2022-09-21王倩楠贾凌晨刘有华皮乔木徐思琪李联泰蔡月凤安贤惠
王倩楠,冯 妍,贾凌晨,刘有华,皮乔木,徐思琪,李联泰,,蔡月凤,安贤惠,
( 1.江苏海洋大学 海洋科学与水产学院,江苏省海洋生物资源与生态环境重点实验室,江苏 连云港 222005;2.江苏省海洋生物技术重点实验室,江苏 连云港 222005 )
泥鳅(Misgurnusanguillicaudatus)属泥鳅科,为小型底栖淡水经济鱼类。泥鳅对生活环境有较强的适应性,一般生活在泥浆底部的静止或缓慢流动的水体中,也可以生活在潮湿营养丰富的环境中,如湖底、池塘、沟渠和稻田底部。泥鳅主要分布在亚洲沿岸国家,如中国、日本、韩国和印度等;在我国广泛分布于江西赣江支流、萍乡等地的淡水流域[1]。泥鳅素有“水人参”[2]之称,可直接加工食用也可干制入药,因其富含蛋白质且肉质鲜嫩而备受人们喜爱,也是出口水产品之一[3]。
近年来,随着市场需求的增加,泥鳅养殖业不断发展,规模也不断扩大,社会效益和经济效益显著提高,养殖出口量占泥鳅总产量的20%~40%,每667 m2可产泥鳅超过1000 kg,可获纯利润至少5000元。然而,随着养殖规模和密度不断增大,其发病率也逐步升高,泥鳅病害大量发生甚至死亡,产量大幅度下降,造成极大的经济损失。泥鳅病害主要为泥鳅出血病[4-5]、幼鱼红点病[6]、泥鳅腐皮病[7]等,致使其发病的病原菌主要有维氏气单胞菌(Aeromonasveronii)[8]、腐败希瓦氏菌(Shewanellaputrefaciens)[5]等,其中维氏气单胞菌感染所引起的病例占比较高,但从水产动物中分离得到其拮抗菌的报道较少[9-11]。
维氏气单胞菌主要感染变温动物[12],对鱼类具有较强的致病性,也是泥鳅鳃出血病的主要致病菌之一[13],该细菌能通过伤口感染、水源和食源等途径传播[14]。在孟加拉国,该细菌曾引起鱼类流行性溃疡综合征[15]。据报道,自养殖场的水生生物体内分离得到维氏气单胞菌,通过检测发现维氏气单胞菌携带众多致病因子,耐药性也逐渐增强,对水产养殖业的正常健康发展具有潜在的威胁[16]。有研究表明,维氏气单胞菌能感染草鱼(Ctenopharyngodonidella)[17]、大口黑鲈(Micropterussalmoides)[18]、斑点叉尾(Ietaluruspunetaus)[19]、大刺鳅(Mastacembelusarmatus)[20]、泥鳅[21]等。秦蕾等[22]最早从泥鳅病灶部位筛选出1株维氏气单胞菌NQ,该菌导致泥鳅出现体表出血、皮肤溃疡等症状,其致死率达60%;王颖等[4]自泥鳅肝脏及病灶处筛选出2株维氏气单胞菌Q2和Q3,均使泥鳅出现出血症状;卢艳敏等[5]自患病泥鳅中筛选出致使泥鳅出血的维氏气单胞菌2株;徐先栋等[6]自泥鳅幼鱼的肝脏、脾脏、肾脏及病灶部位筛出使其出现红点病的维氏气单胞菌FZ2N,其半致死剂量为1.1×103cfu/g。
拮抗菌的筛选已有报道。杨乔乔等[11]从泥鳅养殖场的水体中分离筛选得到泥鳅腐皮病的拮抗菌解淀粉芽孢杆菌(Bacillusamyloliquefaciens);郝彦利[23]筛选得到副溶血弧菌的拮抗菌枯草芽孢杆菌(B.subtilis)H19;王侃[24]分离筛选得到1株海洋拮抗菌RF106。关于维氏气单胞菌拮抗菌的筛选,国内报道较少。凡飞等[25]曾筛选获得1株荧光假单胞菌(Pseudomonasfluorescens)4-1-3;何涛等[9]从草鱼中分离得到的拮抗菌为解淀粉芽孢杆菌。有研究表明,解淀粉芽孢杆菌拮抗物质为糖类物质[7]、脂肽类物质[9]、伊枯草菌素和芬荠素等[26],荧光假单胞菌产生的拮抗物质包括黄绿脓菌素、吩嗪、氢氰酸、生物表面活性剂、邻氨基苯甲酸等[27]。而有研究表明,属于荧光假单胞菌生物变种Ⅱ的边缘假单胞菌(P.marginalis)可致植物病变[28],能够降解烟碱[29],但在水产养殖中未见有拮抗菌为边缘假单胞菌的报道。笔者自出现鳃出血病症状的泥鳅病灶部位分离到泥鳅鳃出血病病原菌,并以此为指示菌对其拮抗菌进行分离与筛选,以期为该菌的生态防治研究提供参考,并为维氏气单胞菌引发的病害防治奠定基础。
1 材料与方法
1.1 试验材料
鳃出血病泥鳅活体、健康泥鳅、水体及池塘底泥均采自江苏省连云港某泥鳅养殖场。
1.2 主要试剂
Ezup柱式细菌基因组DNA抽提试剂盒、SanPrep柱式DNA胶回收试剂盒、SanPrep柱式DNA胶回收试剂盒、dNTP、DNA Ladder Mix maker、Dream Taq-TM DNA Polymerase均购自生工生物工程(上海)股份有限公司。
1.3 试验方法
1.3.1 病原菌的分离纯化
随机取鳃出血病泥鳅2尾,用体积分数75%的乙醇对样品表面进行消毒,用解剖刀取其病灶部位,在无菌条件下划线接种于LB固体培养基上,在28 ℃恒温培养箱中培养,24 h后观察菌落形态[30]。挑选不同形态、颜色、大小的单菌落进行多次分离纯化,直至获得纯培养物。
1.3.2 回归感染试验
将分离出的纯化物分别接种于LB液体培养基中,28 ℃培养24 h,将菌液分别稀释至1.0×108cfu/mL[4],试验组泥鳅注射稀释后的菌液0.1 mL/尾,对照组注射0.9%的无菌生理盐水0.1 mL/尾[31],每个菌株1组,每组3个平行,每个平行10尾。每隔24 h给泥鳅换水、投饵,每次换水1/3,观察其生长状况,并对感染泥鳅的生存情况、死亡率和死鱼的症状进行观察、记录。
1.3.3 拮抗菌的分离
称取泥鳅养殖场的底泥样品5 g,放入盛有45 mL无菌水的三角烧瓶中,180 r/min振摇20 min,取1 mL放入盛有9 mL无菌水的试管中;取1 mL泥鳅养殖场的水体,放入盛有9 mL无菌水的试管中,分别以10-1、10-2、10-3、10-4、10-5、10-6梯度稀释菌液,在无菌环境中将菌液涂布于LB固体培养基,每个密度3组平行,28 ℃恒温培养,24 h后观察菌落形态,挑选不同形态、颜色、大小的单菌落进行平板三区划线,以达到分离纯化的目的,重复挑单菌落划线直至获得纯培养物。
1.3.4 拮抗菌的筛选——打孔抑菌圈法
利用打孔法[32]抑菌试验筛选拮抗菌,以无菌LB液体培养基作对照组,其中一个孔里加入50 μL LB液体培养基,其他孔分别加入各个纯化物的过夜发酵菌液50 μL,每组3个平行,置于28 ℃恒温培养,10 h后开始每隔2 h观察抑菌圈生长情况,直至长出抑菌圈,并测量抑菌圈大小。从初筛结果中选出有抑菌圈的菌株,通过重复打孔法进行复筛试验。
1.3.5 病原菌和拮抗菌的形态观察及生理生化鉴定
取适量菌液涂片,涂片后进行革兰氏、芽孢和荚膜染色[33]。将拮抗菌以1∶100(体积比)的比例接种于LB液体培养基中,过夜振荡发酵培养,利用微量生化鉴定管和自制的大分子水解培养基进行生理生化鉴定,并按照《常见细菌系统鉴定手册》[33]操作。
1.3.6 16S rDNA序列的测定及系统进化树的构建
提取筛选所得到的病原菌和拮抗菌总DNA,以细菌通用引物[21]1492R(5′-GGTTACCTTGTTACGACTT-3′)和27F(5′-AGAGTTTGATCATGGCTCAG-3′)进行PCR扩增(表1)。
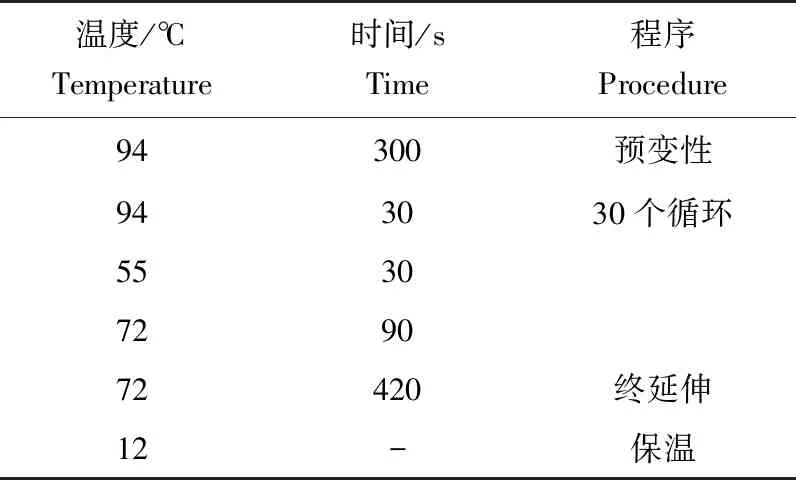
表1 PCR反应程序Tab.1 PCR reaction procedure
PCR扩增完成后,将产物经过1.5%琼脂糖凝胶电泳进行检测。然后将目标菌的PCR扩增产物送至生工生物工程(上海)股份有限公司测序,测序完成后将所得序列提交至美国国家生物技术信息中心数据库,应用BLAST程序与数据库中已存在的细菌16S rDNA序列进行相似性的比较,运用MEGA 7.0构建系统发育树。
1.3.7 拮抗菌药敏试验
将拮抗菌接种于LB液体培养基中,在振荡培养箱中以180 r/min、28 ℃条件下恒温培养24 h,测定其D(600 nm),采用药敏纸片法做抑菌试验。将发酵好的菌液均匀涂布于LB固体培养基上,贴药敏纸片:红霉素、环丙沙星、恩诺沙星、诺氟沙星、头孢克肟、庆大霉素、复方新诺明、利福平、阿莫西林、青霉素G、四环素、链霉素、磺胺异亚唑等,28 ℃恒温培养24 h后测量抑菌圈直径大小,以易华山等[34-35]提供的指标作为药物敏感度标准。
1.3.8 拮抗菌抗菌谱
将本实验室保存的病原菌鳗弧菌(Vibrianguillaris)、哈维氏弧菌(V.havieri)、创伤弧菌(V.vulnificus)、副溶血弧菌(V.parahaemolyticus)、温和气单胞菌(A.sobria)、嗜水气单胞菌(A.hydrophila)和豚鼠气单胞菌(A.caviae)等接种于试管中活化,在28 ℃恒温振荡培养箱中以180 r/min过夜发酵。取不同的病原菌均匀涂布于LB固体培养基上,采用打孔法进行抑菌试验,将发酵液加入孔中,28 ℃恒温培养24 h后记录抑菌圈直径大小,每组3个平行。
2 结果与分析
2.1 病原菌的分离
按1.3.1中的方法,取不同的菌落进行观察,经多次分离,得到7株不同形态的单菌落,分别编号为JY1、JY2、JY3、JY4、JY5、JY6和JY7。
2.2 回归感染及病原菌的筛选
用上述获得的7株病原菌,按1.3.2方法进行人工感染试验,结果表明,菌株JY2、JY5、JY6对泥鳅均有不同程度的致病性,且有明显的鳃出血症状(图1),其中感染菌株JY5的泥鳅在第2天全部死亡,即死亡率100%(表2)。

图1 初选病原菌回归感染健康泥鳅后的病症Fig.1 Primary symptoms of healthy loach M. anguillicaudatus exposed to re-infected with primary selective bacterial pathogens
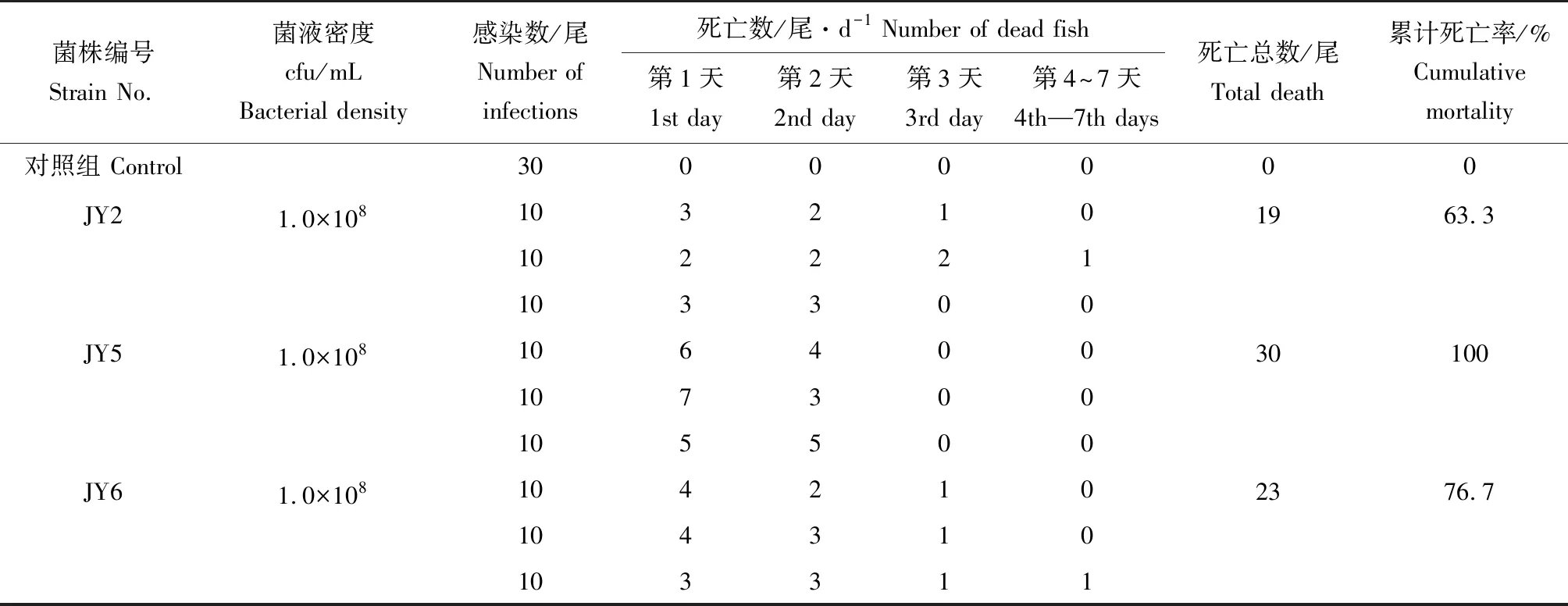
表2 菌株JY2、JY5、JY6对泥鳅的回归感染试验结果Tab.2 Regression infection test results of loach M. anguillicaudatus challenged with strains JY2,JY5 and JY6
2.3 拮抗菌的分离纯化及筛选
经过分离纯化后得到28株不同形态的单菌落,其中菌株CJT4、CJT6、CJT10、CJT17-2和CJT23共5个纯化物表现出不同程度的抑菌活性。菌株CJT23的抑菌圈最大,因此确定菌株CJT23为目标拮抗菌,其抑菌效果见图2。
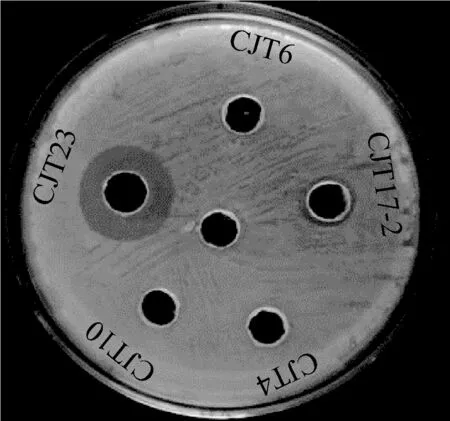
图2 CJT23抑制JY5效果Fig.2 Effect diagram of JY5 inhibited by CJT23
2.4 病原菌和拮抗菌的形态特征及生理生化鉴定
将菌株JY5和CJT23在LB固体培养基上培养,菌株JY5形态特征:菌落呈圆形,灰白色,不透明,中央稍凸起,表面光滑,边缘整齐;革兰氏阴性菌,短杆状(图3a~b)。菌株CJT23形态特征:菌落呈圆形,白色,半透明,中央凸起,边缘整齐光滑,黏稠不易挑起;革兰氏阴性菌,短杆状,无芽孢,有荚膜,有运动性(图3c~d)。
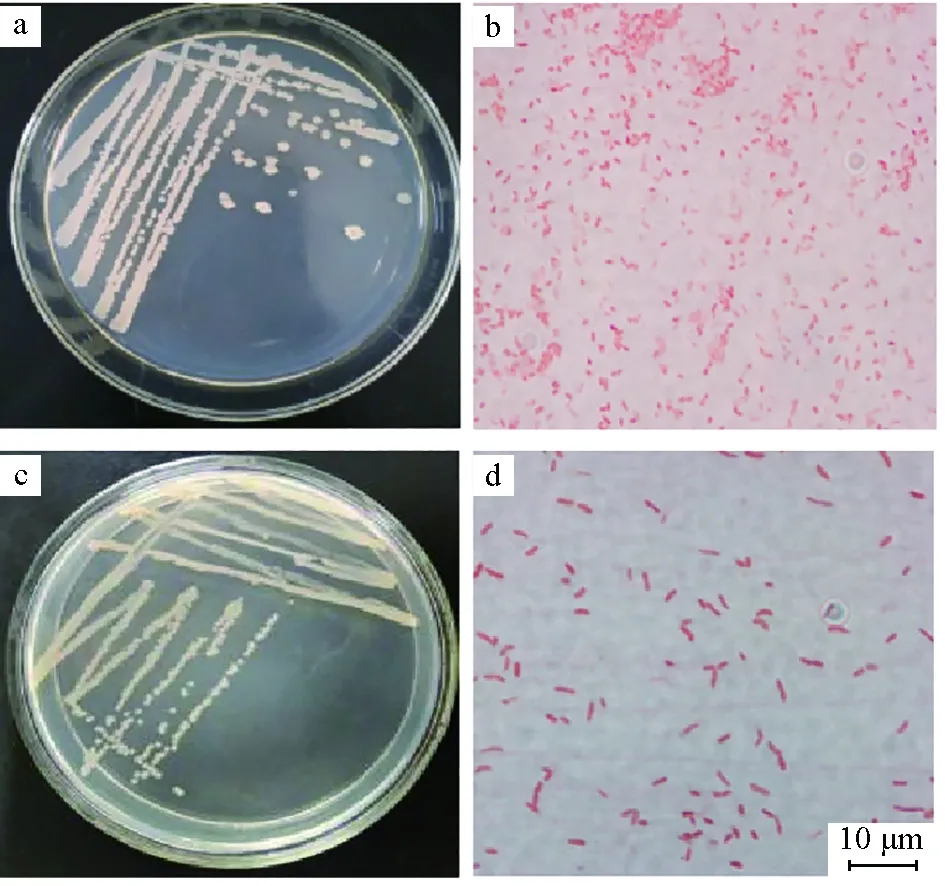
图3 菌落形态及革兰氏染色Fig.3 Colony morphology and Gram staininga、b.病原菌JY5;c、d.拮抗菌CJT23.a,b.pathogenic bacterium JY5;c,d.antagonistic bacterium CJT23.
病原菌JY5大分子水解培养基结果(图4)表明:淀粉水解培养基中出现无色透明圈,说明淀粉已被水解,为阳性;油脂水解培养基中出现红色斑点,说明脂肪已被水解,为阳性;明胶水解培养基呈液化状态(对照组呈凝固状态),说明明胶被水解,为阳性。拮抗菌CJT23淀粉水解、油脂水解、明胶水解结果分别呈现出无色透明圈、红色斑点、明胶液态化,说明淀粉、脂肪、明胶均被水解,为阳性(图4)。

图4 病原菌JY5和拮抗菌CJT23对大分子物质水解反应Fig.4 Hydrolysis of macromolecules by pathogenic bacterium JY5 and antagonistic bacterium CJT23A.病原菌JY5;B.拮抗菌CJT23;a.淀粉水解;b.油脂水解;c.明胶水解;1.对照组;2.试验组.A.pathogenic bacterium JY5;B.antagonistic bacterium CJT23;a.starch hydrolysis;b.oil hydrolysis;c.gelatin hydrolysis;1.control group;2.experimental group.
病原菌JY5和拮抗菌CJT23的生理生化鉴定结果见表3、表4。病原菌JY5能够利用葡萄糖、甘露醇、果糖肉汤等,而不能利用赤藓醇、乳糖、苯丙氨酸等。拮抗菌CJT23能利用葡萄糖、七叶苷、西蒙氏枸橼酸盐、赖氨酸脱羧酶等,不能利用木糖、酒石酸盐、阿拉伯醇、硝酸盐等。
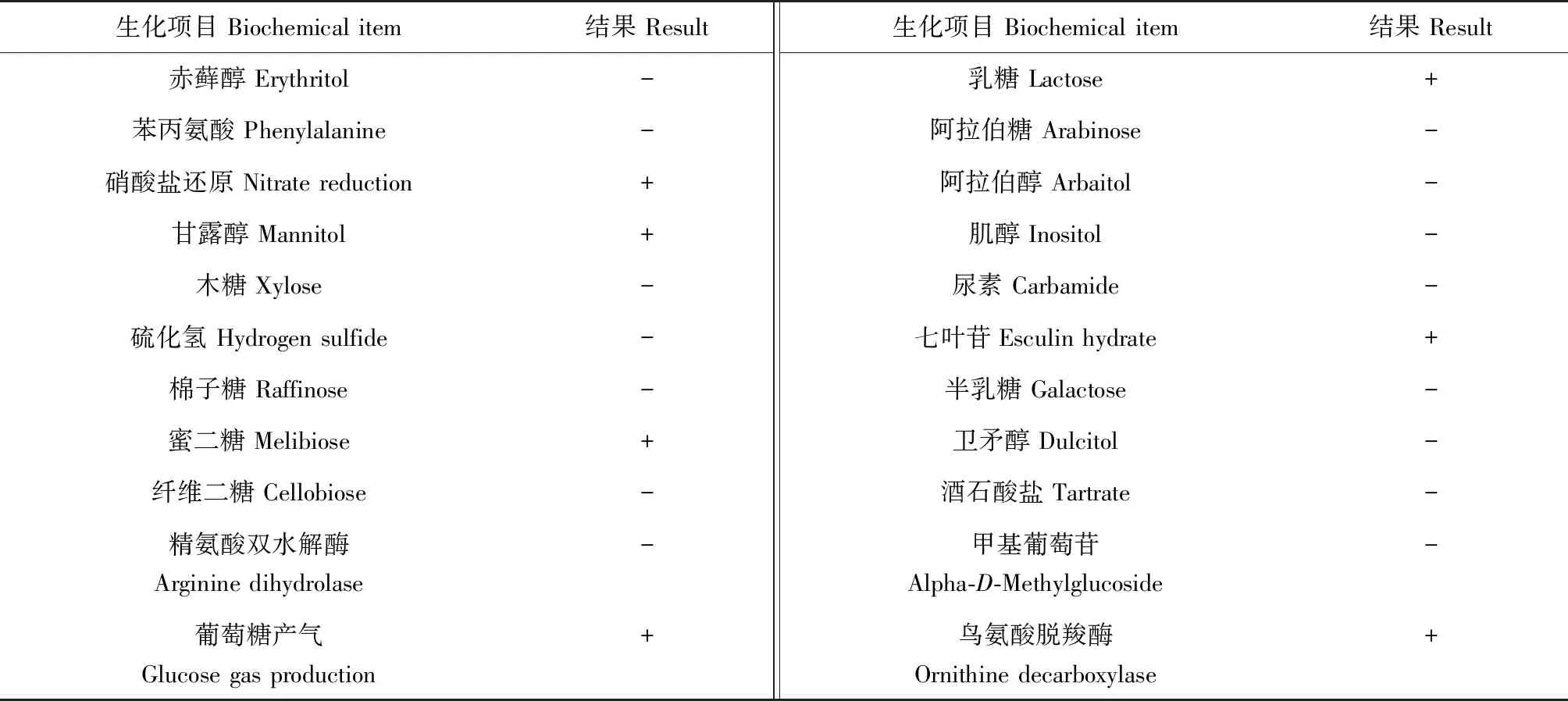
表3 病原菌JY5的生理生化特性Tab.3 The physiological and biochemical characteristics of the pathogenic bacterium JY5

表4 菌株CJT23的生理生化特性Tab.4 The physiological and biochemical characteristics of the antagonistic bacterium CJT23
2.5 病原菌和拮抗菌16S rDNA序列测定及系统发育树构建
按1.3.6方法,将病原菌JY5和拮抗菌CJT23测序所得序列提交至GenBank数据库进行BLAST比对,结果显示,病原菌JY5与维氏气单胞菌同源性达到100%,拮抗菌CJT23与边缘假单胞菌同源性达到99%。由MEGA 7.0构建的系统发育树见图5、图6。病原菌JY5与维氏气单胞菌聚为一支,同时根据其菌落形态及生理生化特性,将该菌暂定名为维氏气单胞菌JY5(GeneBank登录号MW418195);拮抗菌CJT23与边缘假单胞菌聚为一支,且菌落形态及生理生化特性与其相似,因此,将CJT23初步命名为边缘假单胞菌CJT23(GeneBank登录号MW418194)。
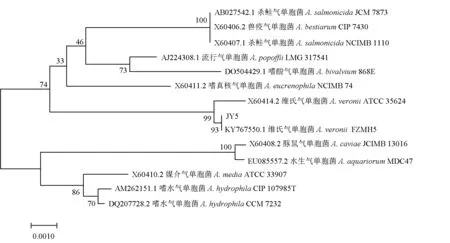
图5 基于16S rDNA序列BLAST结果构建的细菌JY5的系统发育树Fig.5 Phylogenetic tree of bacterial JY5 based on 16s rDNA sequence BLAST
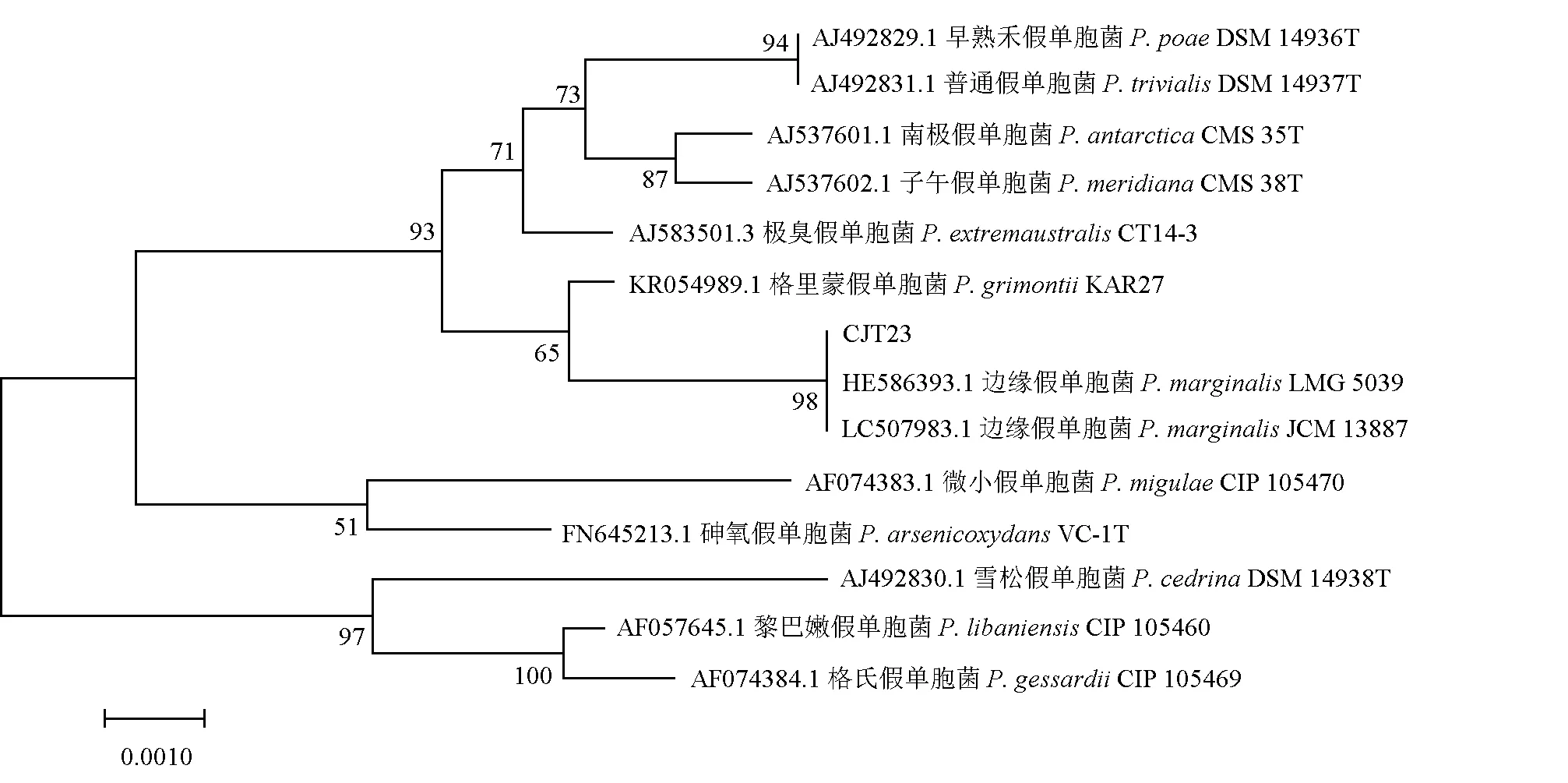
图6 基于16S rDNA序列BLAST结果构建的细菌CJT23的系统发育树Fig.6 Phylogenetic tree of bacterial CJT23 based on 16s rDNA sequence BLAST
2.6 拮抗菌药敏性
药敏试验结果表明,边缘假单胞菌CJT23对环丙沙星、诺氟沙星、庆大霉素、链霉素、恩诺沙星、复方新诺明敏感性较强(表5),用边缘假单胞菌CJT23防治维氏气单胞菌时应避免使用以上敏感药物和中敏药物。
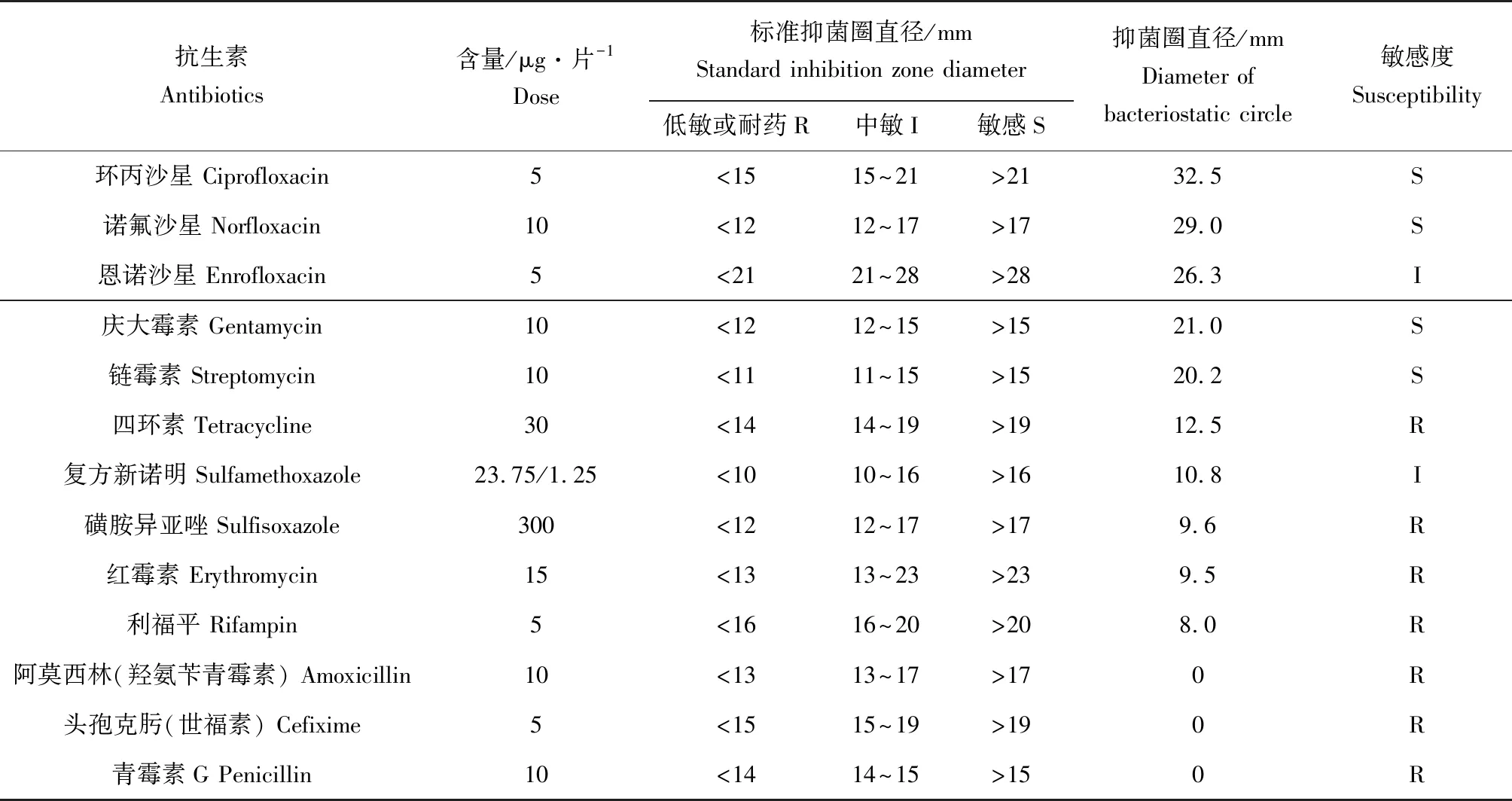
表5 菌株CJT23的药敏性Tab.5 Drug sensitivity of bacterium CJT23
2.7 拮抗菌的抗菌谱
拮抗谱结果表明,边缘假单胞菌CJT23对不同的病原菌表现出不同的拮抗作用,其中:对维氏气单胞菌JY5的抑菌性最强,抑菌圈直径最大达(21.00±0.41) mm;对副溶血弧菌和鳗弧菌拮抗性较强,抑菌圈直径分别为(17.97±0.21)、(15.93±0.26) mm;创伤弧菌、嗜水气单胞菌、温和气单胞菌、哈维氏弧菌抑菌圈直径分别为(12.73±0.26)、(12.63±0.17)、(12.57±0.12)、(11.47±0.17) mm;对豚鼠气单胞菌无抑菌效果(图7)。故菌株CJT23对防治由维氏气单胞菌、副溶血弧菌、鳗弧菌引起的病害可能会有更好的效果。
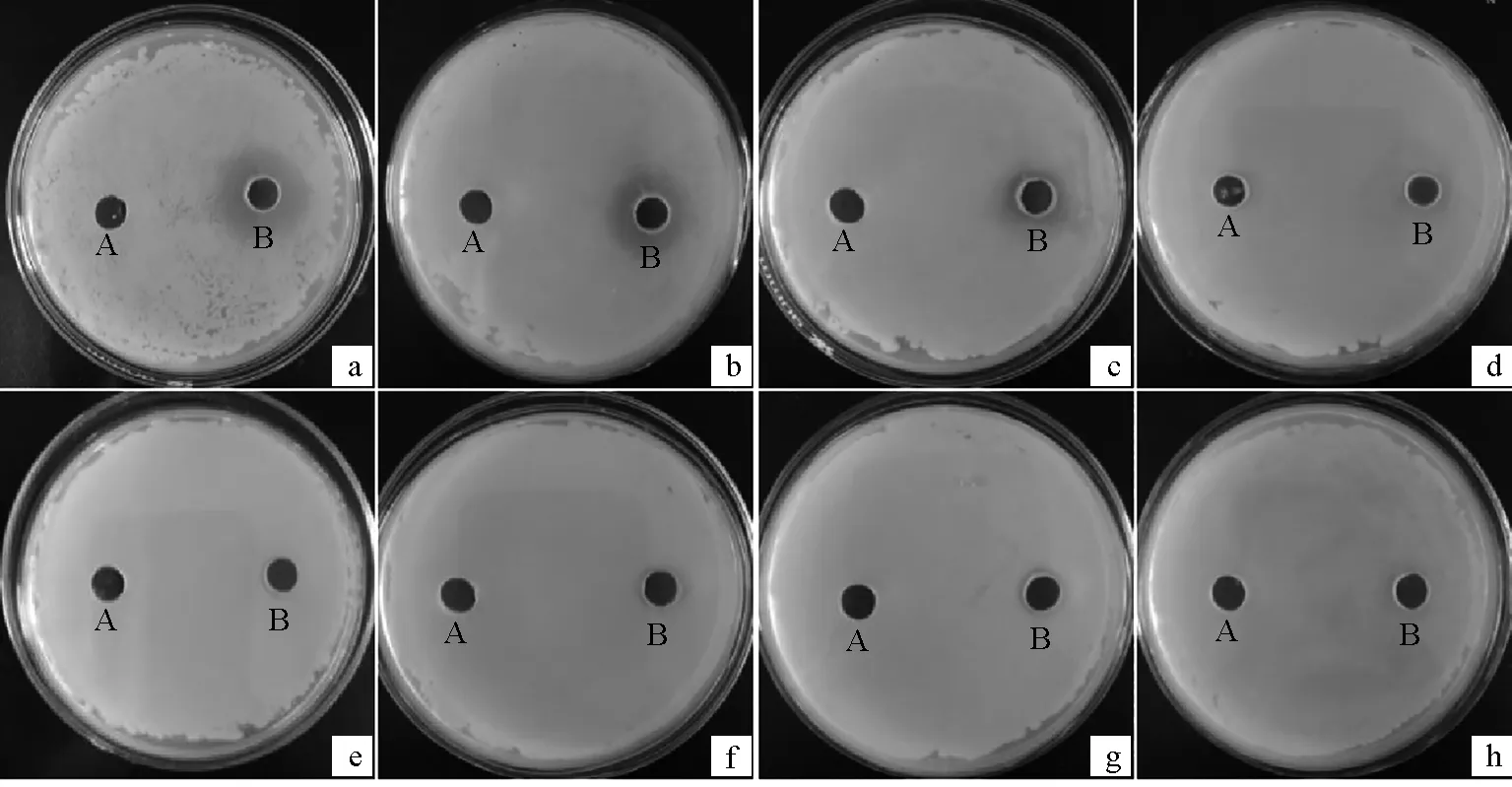
图7 拮抗菌的抗菌谱Fig.7 Antimicrobial spectrum of antagonistic bacteriuma.维氏气单胞菌JY5;b.副溶血弧菌;c.鳗弧菌;d.创伤弧菌;e.哈维氏弧菌;f.嗜水气单胞菌;g.温和气单胞菌;h.豚鼠气单胞菌;A.无菌LB液体培养基;B.发酵液.a.A. sveronii JY5;b.V. parahaemolyticus;c.V. anguillaris;d.V. vulnificus;e.V. havieri;f.A. hydrophila;g.A. sobria;h.A. caviae;A.sterile LB liquid medium;B.the fermented liquid.
3 讨 论
3.1 深入研究需增加管家基因序列测序
本试验中,因基于生产实践,以快速得到大致结果服务于生产,故只从菌种形态观察、生理生化鉴定、16S rDNA序列分析方面进行了初步鉴定。如果要在理论上进一步深入研究本试验涉及的2个菌株,则需要增加管家基因,如gyrB、cpn60、dnaJ等基因。
3.2 试验用病原菌维氏气单胞菌源于生产实践
维氏气单胞菌对鱼类具有较强的致病性,有研究表明,维氏气单胞菌能感染泥鳅[21]。笔者根据连云港某泥鳅养殖场泥鳅养殖过程中发生的鳃出血病,有针对性地分离得到1株致病性较强的菌株JY5,从形态特征、生理生化鉴定和16S rDNA序列分析等,初步判断该菌株为维氏气单胞菌,其结果与王颖等[4-6,22]的结果基本一致。有学者从泥鳅病灶部位筛选出维氏气单胞菌,鱼体有体表出血症状[4-5,22],但鳃出血症状未见报道。同时关于该病原菌的致病机理、致病途径等诸多方面的深化研究均有待进一步开展。
3.3 维氏气单胞菌拮抗菌筛选可为生物防治提供参考
近年来,筛选拮抗菌防治水产养殖病害的研究越来越多,拮抗菌作为生物防治的一种有效且环保的防治方法,目前被广泛应用。本试验中,有针对性地筛选维氏气单胞菌JY5的拮抗菌,获得具有较强拮抗作用的菌株CJT23。从形态特征、生理生化鉴定和16S rDNA序列分析等方面,初步判断该菌株为边缘假单胞菌,结果与甘琴华等[28]结果基本一致。关于水产动物拮抗菌的筛选已有报道,已筛选出的菌株有解淀粉芽孢杆菌[9,11]、枯草芽孢杆菌[23]、荧光假单胞菌[25]等,但边缘假单胞菌在水产养殖中作为拮抗菌且其活性物质的研究尚未见报道。这一试验结果扩充了维氏气单胞菌拮抗菌的类型,丰富了维氏气单胞菌拮抗菌资源库,为维氏气单胞菌引发的病害防治奠定了材料基础。笔者后续工作将分离纯化并鉴定边缘假单胞菌CJT23的活性物质,为揭示其拮抗机理以进一步开发利用奠定基础。
3.4 拮抗菌的研发使用为泥鳅养殖业发展和环境保护提供基础
在水产养殖中,传统防治病害的方法是使用化学药品和抗生素[22]。由于化学药品和抗生素的滥用,出现了诸多弊病。如药物残留,间接危害人体健康[36],破坏机体内微环境,破坏水环境的微生态平衡,使养殖水产品和病原菌产生耐药性并污染环境[37]。笔者主要对拮抗菌进行药敏试验,旨在在水产养殖中利用边缘假单胞菌抑制维氏气单胞菌时避免使用对边缘假单胞菌呈现敏感及中敏的药物。根据目前查阅的资料,国内外对维氏气单胞菌疫苗研究的报道较少[19,38],因此,研发新型微生物制剂或疫苗引起了科研工作者的关注,成为生物防治的研究热点[39]。通过生物防治的途径,可有效减少水产养殖业中水生动物病害的发生,能够有针对性地解决鱼类疾病,减少水产养殖过程中鱼类的发病率,降低水产养殖业的损失,同时避免水产养殖中使用抗生素而造成环境污染及药物残留,为水产养殖的可持续性发展和环境保护提供基础资源。
4 结 论
连云港某泥鳅养殖场的泥鳅出现鳃出血病是因为感染了维氏气单胞菌JY5,以维氏气单胞菌为指示菌分离筛选得到其拮抗菌边缘假单胞菌CJT23。边缘假单胞菌CJT23菌落呈圆形,白色,半透明,中央凸起,边缘整齐光滑,黏稠不易挑起;属革兰氏阴性菌,短杆状,无芽孢,有荚膜,有运动性。边缘假单胞菌CJT23淀粉水解、油脂水解、明胶水解均为阳性。边缘假单胞菌CJT23对环丙沙星、诺氟沙星、庆大霉素、链霉素、氯霉素、恩诺沙星、复方新诺明敏感性较强。边缘假单胞菌CJT23对维氏气单胞菌JY5抑菌性最强,抑菌圈直径最大达到(21.00±0.41) mm;对副溶血弧菌和鳗弧菌拮抗性较强,抑菌圈直径分别为(17.97±0.21)、(15.93±0.26) mm。
