CXCL10、CXCR3在成年人结节性胃炎患者胃黏膜中的表达及意义*
2022-09-20张红杨年媛媛孟宪梅陈洪锁
张红杨,年媛媛,孟宪梅,陈洪锁,武 勇,彭 飞
(包头医学院第二附属医院内蒙古消化病研究所,内蒙古包头 014030)
结节性胃炎(nodular gastritis,NG)是与幽门螺杆菌(helicobacterpylori,Hp)感染密切相关的一种特殊型胃炎,其特征是内镜下表现为弥漫性小结节或者颗粒样改变,以大致均匀的方式分布,主要发生在胃窦部,少数也表现为胃体或全胃受累[1];病理上主要表现为淋巴滤泡的形成以及淋巴细胞的浸润[2]。近年来研究发现,趋化因子配体10(chemokine CXC motif ligand 10,CXCL10)及其受体趋化因子受体3(CXC chemokine receptor 3,CXCR3)是在众多炎性疾病发病过程中起着重要作用的细胞因子。有研究表明CXCL10可能在Hp感染胃黏膜炎性病变中起着一定作用[3-4],但其发病机制尚不清楚。本研究检测了趋化因子CXCL10及其受体CXCR3在结节性胃炎及Hp阴性及阳性慢性非萎缩性胃炎患者胃黏膜中的表达水平,并对其临床意义作一讨论,以进一步了解其在结节性胃炎中可能的作用,为后续研究结节性胃炎的发病机制提供基础的理论依据。
1 对象与方法
1.1对象 选择2020年4月—2021年11月就诊于内蒙古科技大学包头医学院第二附属医院消化病研究所胃镜室的患者,根据内镜下表现入组结节性胃炎患者及慢性非萎缩性胃炎患者共64例,根据病理学检查及Hp呼气试验将入组患者分为结节性胃炎组(NG组)、Hp阳性慢性非萎缩胃炎组、Hp阴性慢性非萎缩胃炎组,收集其胃黏膜标本,年龄18~70岁,平均年龄为44.5岁。其中NG组33例,男性12例,女性21例,平均年龄为38.9岁;Hp阳性慢性非萎缩性胃炎组14例,男性8例,女性6例,平均年龄为50.4岁;Hp阴性慢性非萎缩性胃炎组17例,男性9例,女性8例,平均年龄为50.5岁。免疫组化共46例,NG组 27例,Hp阳性慢性非萎缩性胃炎组8例,Hp阴性慢性非萎缩性胃炎组11例;Western-blot共18例,NG组6例,Hp阳性慢性非萎缩性胃炎组6例,Hp阴性慢性非萎缩性胃炎组6例。NG组与慢性非萎缩胃炎组相比,患者年龄差异具有统计学意义(P<0.05),各组患者性别差异均无统计学意义(P>0.05)。
纳入标准:(1)年龄18~70岁;(2)性别不限;(3)均接受内镜检查,通过医院医学伦理委员会批准并签署内镜检查及活检知情同意书。NG组患者均经胃镜及病理检查确诊为结节性胃炎,另外选择胃镜及病理诊断为慢性非萎缩性胃炎患者作为对照组,根据Hp呼气试验分为Hp阳性慢性非萎缩性胃炎组与Hp阴性慢性非萎缩性胃炎组。
排除标准:(1)已行抑酸、抗Hp治疗;(2)患有消化道肿瘤、有消化道手术史、免疫性疾病、口服免疫抑制剂或激素;(3)孕妇、哺乳期妇女;(4)严重心、肺、肾、肝、脑及恶性肿瘤史;(5)有精神疾病、沟通障碍;(6)其他严重疾病及意识不清。
1.2方法
1.2.1胃镜检查及Hp诊断标准 电子胃镜行常规胃镜检查,结节性胃炎患者于胃窦小弯侧距幽门环5 cm内结节性改变最明显处取活检组织3-4块,慢性非萎缩性胃炎患者于胃窦小弯侧距幽门环5 cm取活检组织3-4块,分别行组织石蜡包埋、蛋白质提取。将Hp组织学染色阳性加上快速尿素酶试验阳性定义为Hp感染。
1.2.2免疫组化检测CXCL10、CXCR3蛋白阳性染色情况 将石蜡包埋组织连续切片后进行脱蜡、水化,微波炉内行抗原修复,3 %过氧化氢灭活内源性过氧化物酶,磷酸盐缓冲盐水缓冲液(PBS)冲洗,滴加山羊血清封闭液,一抗后4 ℃过夜,二抗室温孵育30 min,室温滴加显色剂,然后复染、脱水、透明、封片、镜检观察CXCL10、CXCR3在各组胃黏膜的着色情况。
免疫组化结果判定标准如下:阳性等级采用Sinicrope改良半定量法,显微镜下观察记录各切片中阳性细胞的百分数,按5级法计分。0分:阳性细胞数<5 %;1分:阳性细胞数5 %~25 %;2分:阳性细胞数26 %~50 %;3分:阳性细胞数51 %~75 %;4分:阳性细胞数>75 %。同时将染色强度分为4级,0分:不显色或显色不清;1分:浅黄色;2分:棕黄色;3分:深棕色。最后综合计分=(染色细胞分数+染色强度分数)/2;阴性:所得分数<0.5分;弱阳性(+):0.5分~1.5分;中度阳性(++):>1.5~2.5分;强阳性(+++):>2.5分。
1.2.3Western-blot检测CXCL10、CXCR3蛋白表达量 提取各组织总蛋白;按照BCA试剂盒检测组织蛋白浓度;制备浓缩胶和分离胶,按上样体积上样、电泳;进行转膜、一抗和二抗孵育、化学发光;将凝胶图像扫描拍照,用凝胶图像处理系统分析目标带的光密度值,以目的条带灰度值与内参条带灰度值的比值作为目的蛋白表达量。

2 结果
2.1CXCL10、CXCR3蛋白阳性染色结果 NG组、Hp阳性慢性非萎缩性胃炎组、Hp阴性慢性非萎缩性胃炎组间CXCL10、CXCR3蛋白均有阳性表达,表达部位集中在细胞质及细胞膜,各组中弱阳性表达较多,其中Hp阳性非萎缩胃炎组胃黏膜内CXCL10、CXCR3染色阳性率分别为87.5 %(7/8)、75.0 %(6/8),但各组间比较差异均无统计学意义(P>0.05)。见图1、表1。

图1 各组患者CXCL10和CXCR3蛋白阳性染色免疫组化图谱(×400)
CXCL10蛋白阳性染色:A为Hp阳性非萎缩胃炎组;B为NG组;C为Hp阴性非萎缩胃炎组。CXCR3蛋白阳性染色:D为Hp阳性非萎缩胃炎组;E为NG组;F为Hp阴性非萎缩胃炎组
2.2CXCL10、CXCR3蛋白表达量结果 CXCL10和CXCR3蛋白在三组间均有表达。进一步两两比较示,与NG组和Hp阴性慢性非萎缩胃炎组相比,Hp阳性慢性非萎缩胃炎组CXCL10、CXCR3蛋白表达更为显著,差异有统计学意义(P<0.05);NG组和Hp阴性慢性非萎缩胃炎组相比,差异无统计学意义(P>0.05)。见表2、图2。

表1 各组胃黏膜组织中CXCL10、CXCR3蛋白阳性染色结果比较[n(%)]
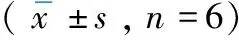
表2 各组胃黏膜组织中CXCL10和CXCR3蛋白表达

图2 Western blot 法检测各组胃黏膜组织CXCL10和CXCR3 蛋白表达(组1为NG组;组2为HP阳性慢性非萎缩胃炎组;组3为HP阴性慢性非萎缩胃炎组)
3 讨论
结节性胃炎,也称为淋巴网状增生、结节性增生、胃淋巴组织增生、滤泡性胃炎或淋巴细胞性胃炎,被认为是胃黏膜的一种炎症状态,与Hp感染密切相关[5-7]。根据报道,在结节性胃炎患者中Hp阳性率为87.5 %~100 %[1]。本研究中所有结节性胃炎患者均有Hp感染,进一步说明了结节性胃炎与Hp之间的相关性。结节性胃炎在普通人群中较为罕见,患病率在0.19 %~0.22 %,常见于儿童,但近年来随着结节性胃炎的检出率增高,研究报道成人结节性胃炎的病例数目亦呈上升趋势[7-8]。日本在成年人群中进行的研究表明,结节性胃炎患病率在0.93 %~2.9 %,年龄在40岁以下的患者和女性患病率呈增加趋势[9];另有国内研究回顾性分析了30例成年结节性胃炎患者,其中女性患者占66.67 %,平均年龄为36.84岁,表明结节性胃炎患者中以女性居多,且年纪较轻[6]。本研究结果也显示NG组患者平均年龄38.9岁显著低于Hp阳性慢性非萎缩胃炎组(50.4岁)与Hp阴性慢性非萎缩性胃炎组(50.5岁),其中女性占63.64 %,这一点与国内外相关研究结果一致。
趋化因子是一类能与靶细胞表面的受体结合可趋化免疫细胞至相应部位参与炎症、感染等多种病理生理过程的小分子分泌蛋白[9]。在趋化因子的分子中有4个保守的半胱氨酸(C),根据其半胱氨酸精确构型的变化可将人类趋化因子分为CXC、C-C、C及CX3C四类亚族[10]。而CXCL10又称干扰素γ诱导蛋白10,属于CXC趋化因子超家族,受多种诱导干扰素-α/β和适应性免疫细胞细胞因子干扰素-γ(IFN-γ)的天然刺激诱导。其受体为CXCR3,激活后可在幼稚T细胞上快速诱导,并优先在1型辅助性(Th1)CD4+T细胞、效应性CD8+T细胞和天然型淋巴细胞上保持高表达[11]。当CXCL10与其受体CXCR3结合后可趋化效应T细胞的产生,随后向Th1型炎症周围部位的迁移。研究表明,Hp感染的胃炎T淋巴细胞主要是Th1表型,且高分泌IFN-γ[12],Hp可激活IFN-γ的上游信号通路,从而增强胃黏膜上皮细胞对IFN-γ刺激的促炎信号,导致其调节的趋化因子CXCL10产生增加,促进炎症细胞向感染部位聚集[13]。本研究针对NG组与非NG组患者胃黏膜的免疫组化结果发现,NG组、Hp阳性慢性非萎缩性胃炎组、Hp阴性慢性非萎缩性胃炎组间CXCL10、CXCR3蛋白均有阳性表达,其中在Hp阳性非萎缩胃炎组表达最为显著,CXCL10、CXCR3染色阳性率分别为87.5 %、75.0 %,这一点与上述研究结果一致。此外,Eck 等[4]通过实验观察到在Hp感染的慢性胃炎中,CXCL10在T细胞密集区域高表达,认为CXCL10有助于T细胞向黏膜中的募集,并加重黏膜的损伤。综合以上表明,Hp感染后可能通过多种方式协同作用促进了趋化因子CXCL10的产生,且其表达量可能与疾病的严重程度之间呈正相关。
本研究进一步通过Western-blot检测了CXCL10、CXCR3蛋白的表达情况,发现Hp阳性慢性非萎缩胃炎组CXCL10、CXCR3蛋白表达最为显著。相反的是,本研究中NG组所有患者均有Hp感染,但NG组CXCL10、CXCR3蛋白表达显著低于Hp阳性慢性非萎缩胃炎组,差异有统计学意义。提示在结节性胃炎中,CXCL10、CXCR3的表达除Hp刺激的因素外,同时还受其他因素的调控。一项国外研究通过检测结节性胃炎中促炎因子的表达,同样发现与Hp感染但不伴有结节性胃炎的患者相比,Hp感染的结节性胃炎患者中的促炎细胞因子表达显著降低,表明免疫识别能力降低或免疫逃避。另外,该研究还测定了NG中Hp的细菌载量,认为细菌载量增高同样是导致免疫抑制的一个因素[14]。此外,在本研究结果中NG组与Hp阴性慢性非萎缩胃炎组相比,NG组CXCL10、CXCR3蛋白表达量低于Hp阴性慢性非萎缩胃炎组,但无统计学差异。根据病理结果显示,本研究中Hp阴性慢性非萎缩胃炎组患者炎症程度多呈轻度到中度,而NG组患者多呈重度,因此,CXCL10、CXCR3在NG组表达更低可能也是免疫反应被抑制的表现。综合以上,我们推测,CXCL10与CXCR3在Hp感染的结节性胃炎患者胃黏膜中表达降低,可能反映体内Th1细胞反应活性降低,表明结节性胃炎状态下,胃黏膜的免疫反应受到了抑制。
在大量配体-受体结合实验中已经证实,趋化因子与受体间的结合表现出冗余现象[15],趋化因子及其受体间的相互作用以多渠道方式参与免疫反应过程中T细胞运输的精细控制,特定的趋化因子可以识别其互补亚类的一个或多个受体,反之亦然[16]。因此,单一的趋化因子及其受体的结合产生的免疫反应不足以完全解释结节性胃炎的发生机制,CXCL10/CXCR3在结节性胃炎中的作用还需要更深入的研究,为后续研究结节性胃炎的发病机制提供基础的理论依据。
综上所述,成年人结节性胃炎与Hp感染密切相关,趋化因子CXCL10及其配体CXCR3在Hp感染患者胃黏膜中呈高表达,而在结节性胃炎中呈低表达可能代表了结节性胃炎状态下胃黏膜免疫反应的普遍抑制。
