大白猪血清免疫指标的检测及相关性分析
2022-09-20刘笑笑路玉洁田威龙肖有恩覃燕灵吴细波司景磊兰干球
刘笑笑 路玉洁 田威龙 肖有恩 覃燕灵 吴细波 司景磊 梁 晶 兰干球*
(1广西大学动物科学技术学院,广西南宁 530004;2广西农垦永新畜牧集团有限公司良圻原种猪场,广西南宁 530022)
血清免疫指标是衡量动物健康水平的重要指标,TNFα、IL-6、CRP是目前研究较多的血清免疫指标。白细胞介素-6(Interleukin-6,IL-6)是由活化的T细胞和成纤维细胞产生的一种多效应细胞因子,在调节免疫和炎症反应在宿主防御中发挥重要作用[1];C反应蛋白(C-reactive protein,CRP)是一种急性反应蛋白,是重要的机体炎性反应生物标志物,起到免疫调节和吞噬炎性反应的作用[2];肿瘤坏死因子α(Tumor necrosis factorα,TNF-α) 在机体发生炎症或病毒感染时,会通过自然杀伤细胞(NK细胞)被激活后,作为促炎细胞因子被优选出来,发挥杀伤被病毒感染的宿主细胞和免疫调节作用[3]。TNFα、IL-6、CRP在机体免疫和检测感染方面均具有重要作用[4]。试验对此3项免疫指标相关性进行分析及正态分布检验,得出3项免疫指标的相关性及群体分布情况,为猪育肥期免疫指标的正常范围值、健康检测及以大白猪为疾病模型的各时期免疫指标研究提供理论参考。
1 材料与方法
1.1 试验动物
试验猪乃来自广西南宁某大型核心种猪场,所有仔猪统一饲喂商业饲料,且未添加任何抗生素,70日龄统一转入育肥舍,待其适应后,统一进行血清样品的采集(80日龄)。
1.2 样品采集
使用20 mL注射器采取大白猪前腔静脉血后,注入5 mL一次性真空采血管内,常温静止1~2 h后4℃3 000 rmp离心15 min,吸取上清液(即血清)至1.5 mL离心管内备用。
1.3 试验方法
1.3.1 肿瘤坏死因子α的测定
采用九邦生物科技公司的猪肿瘤坏死因子α ELISA试剂盒检验血清样本中的肿瘤坏死因子α,具体操作步骤如下:①试剂盒4℃保存,试验开始前应先室温平衡20 min;②标准孔依次加入各梯度标准液50 μL,空白孔不加样;③样本孔加入50 μL待测血清样品;④样品孔和标准品孔加入100 μL HPR标记的检测抗体,封膜后37℃恒温箱孵育60 min后,弃去液体,每孔加入350 μL洗涤液并静置1 min后,弃去液体,反复操作5次;⑥所有孔内加入A液、B液各50 μL,37℃恒温箱孵育15 min;⑦所有孔内加入50 μL终止液,使用酶标仪450 nm波长测定各孔OD值;⑧根据测定的标准品孔的OD值及对应标准液浓度,使用Excel软件计算得出直线回归方程并绘制标准曲线,OD值代入方程即可计算所有样品TNFα的浓度。测定单位为pg/mL。
1.3.2 白细胞介素-6的测定
采用九邦生物科技公司的猪白细胞介素-6 ELISA试剂盒检验血清中的白细胞介素-6,测定单位为pg/mL,具体操作步骤同肿瘤坏死因子α的测定。
1.3.3 C-反应蛋白的测定
采用九邦生物科技公司的猪C-反应蛋白ELISA试剂盒检验血清样本中的C-反应蛋白,测定单位为mg/L,具体操作步骤同肿瘤坏死因子α的测定。
1.4 统计方法
运用R语言检验不同性别的显著性,其他数据均使用SPSS 19.0软件进行分析,包括:描述性统计、t检验、Person相关性分析、正态分布检验等。
2 结果与分析
2.1 显著性检验
使用R语言Wilcoxon秩和检验(rank sum test)进行显著性检验分析,结果如图1所示,公猪TNFα、IL-6、CRP的值均高于母猪,但各免疫指标差异均不显著(P>0.05)。

图1 公、母猪TNFα、IL-6、CRP指标显著性检验
2.2 各指标正态分布检验
使用Shapiro-wilk对TNFα、IL-6、CRP进行正态分布检验,结果如图2所示,IL-6、CRP均符合正分布,TNFα不符合正态分布。由于不是所有指标都满足正态分布,因此,运用wilcoxon秩和检验(rank sum test)对上述数据进行显著性检验分析(非参数检验)。非参数检验不需要利用总体的信息(总体分布),以样本信息对总体分布做出推断。
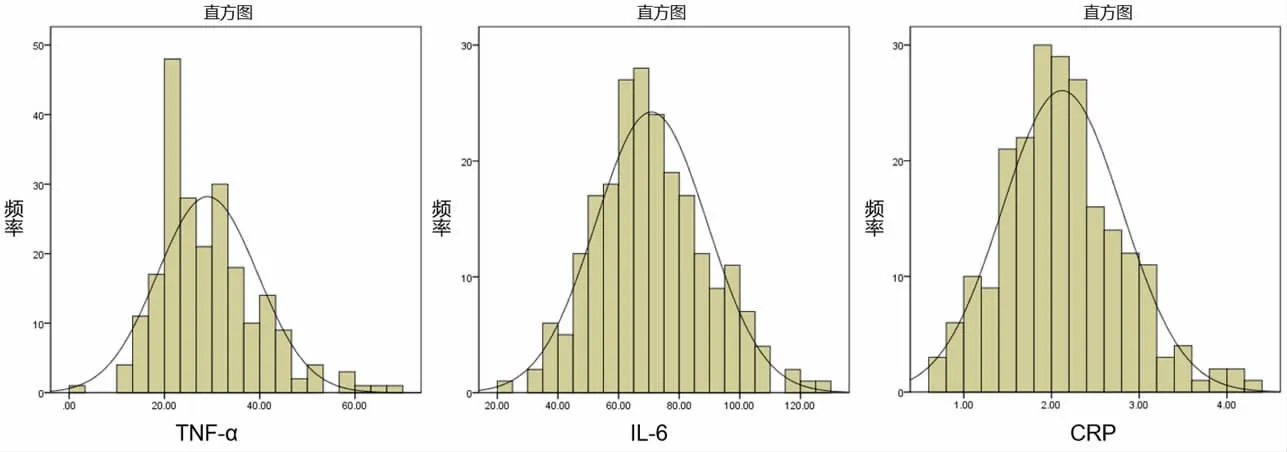
图2 TNFα、IL-6、CRP的指标正态分布检验
2.3 各指标描述性统计
TNFα、IL-6、CRP血清免疫指标的描述性统计如表1所示。3项血清免疫指标的均值分别为29.07 pg/mL、70.84 pg/mL和2.12 mg/L。各项结果中变异系数值较大,分别为36%、25%和32%,表明基于平均数为准的变异程度较大、TNFα、IL-6、CRP指标数据的离散程度较高。
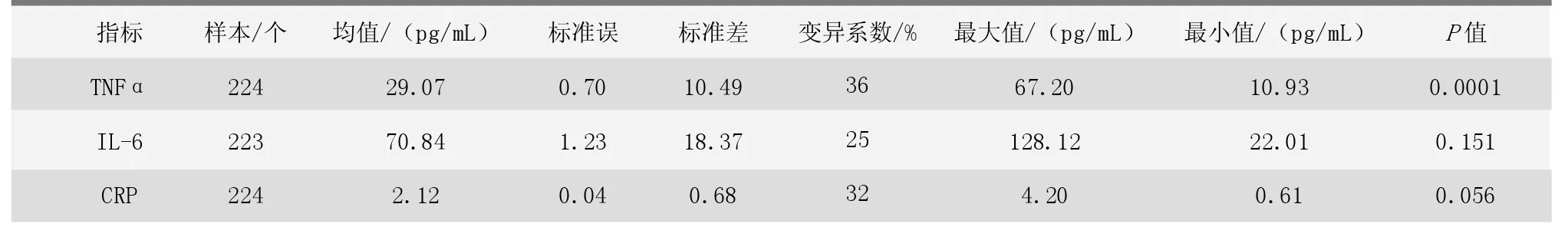
表1 3项指标描述性统计
2.4 各指标相关性分析
TNFα、IL-6、CRP指标的相关性分析及显著性检验如表2所示,各指标间相关系数均达到0.4以上,且均呈极显著相关(P<0.01),表明IL-6与TNFα、CRP与TNFα、CRP与IL-6等每2个指标间均具有中度相关性。

表2 TNFα、IL-6、CRP的相关性分析和显著性检验
3 讨论
3.1 各指标描述性统计及正态分布检验
血清免疫指标在一定程度上影响机体的健康水平[5],猪作为人类的理想疾病模型,研究其各个时期的免疫水平变化具有重要意义[6]。本研究的结果显示育肥期(80日龄)大白猪的公、母猪各指标差异均不具有显著性,表明该时期性别因素对TNFα、IL-6、CRP指标水平的影响不大。正态分布检验结果显示除TNFα外,其余2项指标符合正态分布,且TNFα数值远小于卢军锋[7]使用“杜长大”猪110 kg屠宰采样测得的数值,这表明TNFα在不同时期可能差异较大。描述性统计结果显示变异系数较大即数据的离散程度较大,表明80日龄大白猪的免疫指标数值差异较大,这可能是因为采样应激水平的影响,研究表明应激可对猪体内炎症因子水平产生一定影响[8];此外,可能由于性成熟前猪体内的免疫因子处于“上升阶段”且上升程度不一致所致[9]。大白猪在育肥期免疫因子出现个体水平差异较大的原因及其具体调控机制有待进一步探索。
3.2 各指标相关性分析及显著性检验
TNFα、IL-6、CRP相关性结果显示任意两指标之间相关性系数均在0.4以上,均呈极显著中度相关。腊晓琳等[10]研究表明免疫因子之间具有一定的相关性,会协同促进疾病的进展。结合前人研究,表明TNFα、IL-6、CRP等3项免疫因子水平具有一定相关性,其具体影响机制有待进一步研究。
4 结论
育肥期(80日龄) 大白猪的TNFα、IL-6、CRP指标间具有极显著相关性;性别因素对该时期指标的表型影响不显著。
