建立高效液相色谱法测定土霉素注射液含量
2022-09-20张美玉曹永慧谢彦军
张美玉,曹永慧,谢彦军
(山东鲁抗舍里乐药业有限公司高新区分公司,山东济宁 272000)
土霉素又称地霉素、氧四环素、5-羟基四环素, 是20 世纪40 年代末发现的四环素类抗生素,相对分子质量46044,分子式为C22H24N2O9,土霉素为淡黄色酸碱两性品体,微溶于水,具有较多的金属结合位点, 易与2 价或3 价阳离子结合形成复合物。 土霉素是龟裂链霉菌代谢产生的广谱抗生素, 具有抗菌谱广、 效能高的特点, 对革兰氏阴性菌和革兰氏阳性菌均有较好的抑制效果。 因此,作为一种广谱抗菌药物,土霉素常用于猪、牛、家禽等动物疾病的预防,并且由于其具有质优价廉、广谱抗菌的特点,作为抗菌促生长剂在畜禽生产中也得以广泛应用。其制剂土霉素注射液稳定性好, 制剂长久保存不变色,不氧化。
1 仪器与材料
1.1 仪器
岛津高效液相色谱仪, 梅特勒-托利多AB265-S 电子天平(梅特勒·托利多仪器上海有限公司)。
1.2 试剂
土霉素对照品 (含量:91.3%, 批号:k0031208 来源:中国兽医药品监察所),草酸铵、二甲基甲酰铵、磷酸氢二铵、盐酸;水为纯化水。土霉素注射液(50 微升:土霉素10 克,1000 万单位) 均为山东鲁抗舍里乐药业有限公司高新区分公司生产(均已用生物效价法测定含量)
2 方法与结果
2.1 测定方法
2.1.1 色谱条件 色谱柱:250×4.6 毫米,S-5微米,十八烷基硅烷键合硅胶为填充剂(pH 值适应范围大于8.0),检测波长280 纳米,流速1.0毫升分钟,柱温30℃,进样量20 微升,流动相:0.05 摩尔/升草酸铵溶液-二甲基甲酰铵-0.2 摩尔/升磷酸氢二铵溶液(75∶20∶5) 用氨试液调节pH 值为8.0±0.2。
2.1.2 溶液的制备 对照品溶液:精密称取土霉素对照品25 微克, 置50 微升容量瓶中,加0.1 摩尔/升盐酸溶液溶解并稀释至刻度, 摇匀,精密量取5 微升,置50 微升量瓶中,加0.01 摩尔/升盐酸溶液溶解并稀释至刻度,摇匀,作为对照品溶液[1]。
供试品溶液:精密称取本品适量(约相当于土霉素25 微克),置50 微升容量瓶中,加0.1 摩尔/升盐酸溶液溶解并稀释至刻度,摇匀[2],精密量取5 微升,置50 微升量瓶中,加0.01 摩尔/升盐酸溶液溶解并稀释至刻度,摇匀,作为供试品溶液[4]。
系统适用性溶液:取对照品溶液,精密量取对照品溶液各20 微升, 分别注入液相色谱仪,记录色谱图。
系统适用性要求: 系统适用性溶液色谱图中,主峰理论塔板数不少于3000,主峰的拖尾因子不得大于1.5。
系统适用性结果: 主峰的理论塔板数为5621,主峰的拖尾因子为0.92。 结果符合规定。
2.1.3 测定方法 分别精密量取上述溶液,各取20 微升进样分析,主峰与相邻峰的分离度大于1.5,主峰的理论塔板数不小于3000,峰形良好,有良好的对称性。
2.2 分析条件的优化
通过对流动相、波长、溶剂、进样量等条件进行选择,确定最佳试验条件。
2.2.1 流动相的选择 为了考察二甲基甲酰胺对检测结果的影响, 分别选择流动相为0.05摩尔/升草酸铵溶液-0.2 摩尔/升磷酸氢二铵溶液(75∶5)用氨试液调节pH 值为8.0±0.2,0.05 摩尔/升草酸铵溶液-二甲基甲酰铵-0.2 摩尔/升磷酸氢二铵溶液(75∶20∶5)用氨试液调节pH 值为8.0±0.2,0.05 摩尔/升草酸铵溶液-二甲基甲酰铵-0.2 摩尔/升磷酸氢二铵溶液(70∶25∶5)用氨试液调节pH 值为8.0±0.2。 结果表明,当二甲基甲酰胺比例为20%,草酸铵溶液浓度为0.05 摩尔/升时,主峰峰形最好,主峰和其他峰的分离度好;为了考察盐浓度的影响,固定二甲基甲酰胺比例为20%,分别比较当磷酸氢二铵溶液浓度为0.2摩尔/升和0.4 摩尔/升的检测结果, 发现0.2 摩尔/升的磷酸盐可检出的峰形更好, 且流动相中含盐浓度低,对色谱柱寿命影响相对较小,更符合方法学要求;固定磷酸氢二铵溶液浓度为0.2摩尔/升和二甲基甲酰胺的比例为20%时。 草酸铵溶液的浓度分别为0.05 摩尔/升和0.1 摩尔/升时, 发现0.05 摩尔/升的磷酸盐可检出的峰形更好,且流动相中含盐浓度低,对色谱柱寿命影响相对较小, 更符合方法学要求, 方法确定为0.05 摩尔/升草酸铵溶液-二甲基甲酰铵-0.2 摩尔/升磷酸氢二铵溶液(75∶20∶5) 用氨试液调节pH 值为8.0±0.2。
2.2.2 波长选择 采用紫外可见光检测器,对盐酸土霉素对照品在200~400 纳米波长内进行扫描,评价主峰的紫外吸收行为。 实际测得土霉素最大紫外吸收为280 纳米, 故选择280 纳米为测定波长是合理的。
2.2.3 溶剂选择 本品由于土霉素对照品极微溶于水,一般溶于酸性溶液,分别采用盐酸溶液和流动相作为空白溶剂, 比较二者的色谱行为。 试验表明,以流动相做空白溶剂时,所得图谱有小的倒峰出现,而且出现的杂峰较多,而第一步采用0.1 摩尔/升的盐酸溶液, 第二部采用0.01 摩尔/升的盐酸溶液,对照品溶解度较好,对检测干扰较少。 因此选择0.1 摩尔/升和0.01 摩尔/升的盐酸溶液为溶剂更佳[3]。
2.2.4 色谱柱选择 使用三种不同品牌的色谱柱进行试验,分别选用安捷伦、岛津、YMC 三个品牌,色谱柱粒径及长度均相同,检验结果表明使用安捷伦色谱柱分离度及理论塔板数均比其他色谱柱效果好。 因此选用安捷伦色谱柱作为液相检测的色谱柱。
2.2.5 进样量的选择 采用确定的方法配制标准溶液及对照品溶液, 分别吸取样品溶液20微升、25 微升、15 微升进样分析,观察进样后峰的分离度及主峰的理论塔板数,主峰与相邻峰的分离度大于1.5, 主峰的理论塔板数不小于3000,峰形良好,有良好的对称性。 结果表明当进样量为20 微升时候样品的分离度良好,干扰峰较少,峰型良好。
2.3 方法学考察
2.3.1 方法适用性试验
精密称取土霉素注射液样品6 份, 采用高效液相检测法每份进两针,取其平均值,土霉素注射液主峰出峰时间和标准品出峰时间保持一致,色谱图峰形很好,拖尾因子均小于1.5,理论塔板数均大于3000, 标示量结果偏差小于2%,说明所测物质相同,峰形良好[4]。 根据峰面积计算含量结果与按照《兽药质量标准》(2017 年版)生物等效法测定值一致,且生物效价法相对标准偏差为0.53%,说明结果稳定可靠,影响因素少[5]。
2.3.2 精密度试验
以0.05 摩尔/升的土霉素对照品溶液连续进样6 针,记录峰面积值,并计算相对标准偏差。
结果表明峰面积相对标准偏差为0.45%,说明精密度良好,数据可靠,仪器状态良好。
2.3.3 线性范围
配制标准浓度为0.1 微克/微升的对照品标准溶液, 精密量取1 微升、2 微升、3 微升、5 微升、6 微升、7 微升、8 微升、9 微升置10 微升容量瓶中, 配制成浓度为0.01 微克/微升~0.09 微克/微升的标准溶液。 各取20 微升进样, 记录色谱图,横坐标为样品浓度,纵坐标为样品峰面积做线性回归, 浓度在0.03 微克/微升~0.08 微克/微升范围内和峰面积呈线性相关,线性回归方程为y=5863.6x(r=0.9999)[6]。表明样品检测浓度为0.05微克/微升在线性范围内。
2.3.4 回收率试验
分别取土霉素注射液适量和对照品溶液混合配制成样品浓度为0.03 微克/微升、0.04 微克/微升、0.05 微克/微升、0.06 微克/微升、0.07 微克/微升的溶液,每个浓度做两次重复并计算平均回收率。 结果如表1 所示,结果表明当样品浓度在0.05 微克/微升时,回收率高于98.0%,说明试验结果稳定可靠,方法正确,准确度高[7](见表1)。
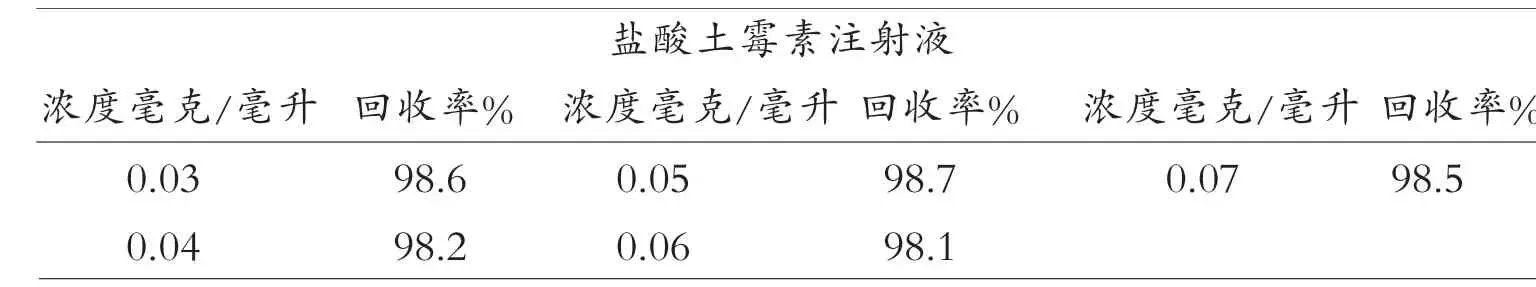
表1 回收率试验结果
2.3.5 耐用性试验
通过改变柱温、流速、检测波长、流动相pH值、流动相比例等参数,来评估色谱条件有微小变动时,测定结果不受影响的影响程度。 色谱条件改变见表4。 改变色谱条件后,取土霉素注射液三批进行测定。 试验要求当色谱条件有微小变化后,要求主峰的理论塔板数大于3000,主峰的拖尾因子小于1.5。 含量结果RSD 不得过2.0%[8](见表2)。

表2 土霉素注射液含量检测结果
在流速、柱温、流动相比例、流动相pH、流动相比例及不同色谱柱等色谱条件有微小变动时,理论塔板数、拖尾因子均符合要求,各条件下, 测得土霉素注射液的含量的RSD 值均小于2.0%。 表明本方法耐用性良好。
2.3.6 定量限与检测限
取土霉素对照品溶液, 采用逐步稀释的方法,信噪比(S/N =10)的样品浓度即为定量限浓度,测定6 次,信噪比(S/N =3)的溶液浓度即为检测限[9]。 结果定量限溶液的浓度为0.13 微克/微升,检测限溶液的浓度为0.45 微克/微升,6 份定量限溶液峰面积的RSD 为1.53%。
2.3.7 重复性与中间精密度
两位分析员,不同时间,两台不同仪器的情况下,每位分析员分别配制6 份供试品溶液和两份土霉素对照品溶液[10]。 取配制溶液各20 微升分别进样分析,结果表明, 两位分析员6 次含量测定重复性的RSD 分别为:0.15%(n =6)、0.12% (n =6),不同分析员12 次测定中间精密度的RSD 为0.14%(n =12),结果见表3。

表3 重复性与中间精密度考察结果
2.3.8 专属性
分别取本品适量,分别取经高温(80℃水浴加热2 分钟)、强酸(2摩尔/升的盐酸溶液破坏40 分钟)、强碱(0.1摩尔/升的氢氧化钠溶液破坏15 分钟)、强光(4500 勒克斯±500勒克斯强光下放置6.5 小时)照射、氧化(3%的过氧化氢溶液破坏10 分钟)条件破坏后制成的溶液,结果表明, 本品在以上破坏条件下均不稳定, 产生的各降解产物峰与土霉素峰分离度均>1.5, 峰型良好,该方法的专属性良好。
3 结论
本实验通过建立高效液相色谱法检验土霉素注射液的含量,能够高效测定兽药土霉素注射液的含量,方法可靠。稳定性好,和生物效价法相比较,大大缩短了检验周期,实现批量检验,可以很好的应用在生产样品的检验上,为兽药生产质量提供有力的保障。
