SARS-CoV-2疫苗接种对人体抗体产生和免疫功能的影响
2022-09-19谭美玉宣彬彬周丽达侯尚伟盛慧明
谭美玉,殳 洁,宣彬彬,周丽达,李 红,侯尚伟,盛慧明
(1.上海交通大学医学院附属同仁医院检验科,上海 200336;2.上海交通大学医学院附属同仁医院虹桥医学国际研究院,上海 200336)
2019年年底,新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARSCoV-2)的出现导致了新型冠状病毒肺炎(corona virus disease 2019,COVID-19)的全球大流行[1]。目前,世界各国学者已广泛开展对SARS-CoV-2的研究,在深入解析该病毒特性的同时,逐步开展疫苗、治疗性抗体和抗病毒药物的研究工作。《新冠病毒疫苗接种技术指南(第一版)》建议18周岁及以上人群接种新冠病毒灭活疫苗(Vero细胞)2剂,2剂之间的接种时间间隔≥3周,并在8周内尽早完成[2]。为了验证接种SARS-CoV-2灭活疫苗后机体的保护性抗体滴度,确认疫苗接种效果,本研究拟分析SARS-CoV-2灭活疫苗接种者的相关指标,探讨疫苗接种后中和抗体的产生情况,以及将外周血T细胞亚群作为疫苗接种后维持免疫力的标志物的可行性。
1 材料和方法
1.1 研究对象
选取2020年12月—2021年10月上海交通大学医学院附属同仁医院进行SARS-CoV-2灭活疫苗接种的医务人员志愿者121名,其中男43名、女78名,年龄20~59岁。排除标准:(1)有湖北省旅居史者,我国港、澳、台地区居民,其他国家或地区的居民,2019年12月以来报告的COVID-19患者;(2)既往感染严重急性呼吸综合征冠状病毒;(3)接种SARS-CoV-2灭活疫苗14 d内出现发烧、咳嗽、疼痛、腹泻、呼吸困难或呼吸急促等不良反应;(4)实验室检查异常,血清特异性IgM或IgG阳性;(5)处于孕期或哺乳期;(6)对疫苗中的任何成分过敏;(7)有癫痫发作或精神疾病史;(8)未按照知情同意书在规定时间内采集静脉血或采血量不足2 mL。所有受试者均接种北京生物制品研究所生产的新型冠状病毒灭活疫苗(Vero细胞)(6.5 U/0.5 mL)。将所有对象根据接种剂次分为2剂次组(接种2剂疫苗)和3剂次组(接种3剂疫苗),分组情况见表1。本研究通过上海交通大学医学院附属同仁医院伦理委员会审查(同仁伦审2021-007-01),所有志愿者均签署知情同意书。

表1 121名志愿者的一般情况
1.2 方法
1.2.1 样本采集 采集2剂次组接种第1针疫苗前和接种第2针疫苗后7 d静脉血2 mL;采集3剂次组接种第3针疫苗前(接种第2针后6个月)和接种第3针疫苗后7 d静脉血2 mL。所有血液样本均采用乙二胺四乙酸抗凝,离心分离血浆,置于-80℃冰箱保存,统一检测SARS-CoV-2总抗体(IgG+IgM+IgA)、SARS-CoV-2 IgG抗体、SARS-CoV-2受体结合域(receptor binding domain,RBD)特异性中和抗体。严格按实验室标准操作规程进行操作。
1.2.2 SARS-CoV-2总抗体、SARS-CoV-2 IgG抗体、SARS-CoV-2 RBD特异性中和抗体的检测 采用Caris2000全自动化学发光仪(厦门万泰公司)及配套试剂(化学发光微粒子免疫分析法)检测血浆SARS-CoV-2 IgG抗体和SARSCoV-2总抗体,以S/CO值≥1.0 COI判定为阳性。采用Lumigenex时间分辨荧光免疫分析仪[光景生物科技(苏州)有限公司]及配套试剂(时间分辨荧光免疫分析法)检测SARS-CoV-2 RBD特异性中和抗体,基本原理:结合垫中含有标记的SARS-CoV-2棘突(spike,S)蛋白RBD抗原,标记的RBD蛋白可与固定在测试线(T线)上的血管紧张素转化酶2(angiotensin-converting enzyme 2,ACE2)受体结合。当样本中含有中和抗体时,样本中的中和抗体竞争性和RBD蛋白结合,可降低RBD与ACE2的结合效率,T线信号显著下降,质控线(C线)信号不变。人体内产生的中和抗体含量越多,T/C值越小。
1.2.3 淋巴细胞亚群检测 采用FACSCanto Ⅱ流式细胞仪(美国BD公司)及配套试剂(CD19-FITC、CD45-APC、CD3-FITC、CD4-BV510、CD8-Percp、CD16CD56-PE、CXCR5-BV421、ICOS-PE)检测CD3+T细胞、CD3+CD4+辅助性T细胞、CD3+CD8+细胞毒性T细胞、CD19+B细胞、CD16+CD56+自然杀伤(natural killer,NK)细胞的百分比和绝对值,以及CD4+CXCR5+ICOS+滤泡辅助性T细胞(T follicular helper cell,Tfh)百分比。对于Tfh细胞的圈门,首先圈出FSC-SSC中的淋巴细胞群,然后圈出SSC-CD3+细胞,分别设门于CD3+CD4+细胞、CD4+CXCR5+细胞、CD4+CXCR5+ICOS+细胞。
1.2.4 血常规指标及细胞因子检测 采用BC-6800Plus全血细胞分析仪(深圳迈瑞公司)及配套试剂检测血常规指标[白细胞(white blood cell,WBC)计数、淋巴细胞计数、C反应蛋白(C-reactive protein,CRP)、单核细胞比值、嗜酸性粒细胞比值、嗜碱性粒细胞比值、中性粒细胞绝对值、单核细胞绝对值、嗜酸性粒细胞绝对值、嗜碱性粒细胞绝对值、红细胞计数、血红蛋白、血小板计数]。采用多重微球流式免疫荧光发光法检测白细胞介素(interleukin,IL)-1β、IL-2、IL-4、IL-5、IL-6、IL-8、IL-10、IL-12P70、IL-17、肿瘤坏死因子-α(tumor necrosis factoralpha,TNF-α)、α-干扰素(interferon alpha,IFN-α)、γ-干扰素(interferon gamma,IFN-γ),试剂购自青岛瑞斯凯尔生物科技有限公司,检测仪器为BriCyte E6流式细胞仪(深圳迈瑞公司)。
1.3 统计学方法
采用 GraphPad Prism 8.0.1软件进行统计分析。呈正态分布的计量资料以±s表示,2个组之间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 2剂次组SARS-CoV-2总抗体和IgG抗体检测结果
2剂次组配对的61名受试者中有57名在第2针疫苗接种后7 d检出SARS-CoV-2总抗体和IgG抗体,抗体产生的有效率均为93.44%(57/61)。2剂次组SARS-CoV-2总抗体检出值为0.09~590.24 COI,均值为(136.5±19.2)COI;IgG抗体检出值为0.01~21.29 COI,均值为(11.1±0.8)COI。男性、女性SARS-CoV-2总抗体分别为(139.5±27.1)、(134.7±26.0)COI;I g G抗体检出值分别为(11.3±1.3)、(11.1±0.9)COI;不同性别之间SARSCoV-2总抗体和IgG抗体差异均无统计学意义(P>0.05)。2剂次组接种第2针疫苗后7 d SARSCoV-2总抗体和IgG抗体的产生情况见图1。

图1 2剂次组接种第2针疫苗后7 d SARS-CoV-2总抗体和IgG抗体的产生情况
2.2 2剂次组SARS-CoV-2中和抗体检测结果
2剂次组中和抗体阳性率为8 1.9 6%(50/61),接种前和接种第2针疫苗后7 d的T/C值分别为2.247±0.072、2.058±0.099,二者比较差异有统计学意义(P<0.01)。
2.3 2剂次组接种前与接种第2针后7 d淋巴细胞亚群和细胞因子检测结果比较
2剂次组接种前与接种第2针后7 d血常规指标和CRP均正常。见表2。

表2 2剂次组接种前与接种第2针后7 d血常规和CRP检测结果
2剂次组接种前与接种第2针后7 d的CD3+T细胞、CD3+CD4+辅助性T细胞、CD3+CD8+细胞毒性T细胞、CD19+B细胞、CD16+CD56+NK细胞百分比和绝对值及IL-1β、IL-2、IL-4、IL-5、IL-6、IL-8、IL-10、IL-12、IL-17、IFN-α、IFN-γ、TNF-α水平差异均无统计学意义(P>0.05),接种第2针后7 d的Tfh百分比(11.4%)显著高于接种前(3.92%)(P<0.01),结果见图2、图3。

图2 2剂次组接种前与接种第2针后7 d淋巴细胞亚群和细胞因子检测结果比较

图3 2剂次组接种前与接种第2针后7 d Tfh检测结果比较
2.4 3剂次组第3针疫苗接种前后各项指标检测结果比较
3剂次组第3针疫苗接种前SARS-CoV-2总抗体、IgG抗体和中和抗体(T/C值)分别为(18.52±5.20)COI、(2.66±0.40)COI、2.30±0.05;第3针疫苗接种后7 d分别为(490.74±83.20)COI、(8.87±0.90)COI、1.87±0.05;SARS-CoV-2总抗体、IgG抗体的阳性率分别为100%(30/30)、93.33%(28/30)。3剂次组第3针疫苗接种前、后SARS-CoV-2各项抗体差异均有统计学意义(P<0.001)。见图4。

图4 3剂次组第3针疫苗接种前后各项抗体检测结果的比较
3剂次组第3针疫苗接种前、后CD3+T细胞、CD3+CD4+辅助T细胞、CD3+CD8+细胞毒性T细胞、CD19+B细胞、CD16+CD56+NK细胞百分比和绝对值及IL-1β、IL-2、IL-4、IL-5、IL-6、IL-8、IL-10、IL-12、IL-17、IFN-α、IFN-γ、TNF-α水平差异均无统计学意义(P>0.05)。见图5。
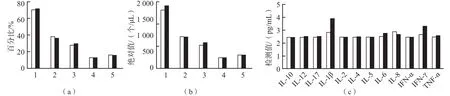
图5 3剂次组第3针疫苗接种前后淋巴细胞亚群及细胞因子检测结果比较
3 讨论
COVID-19传染性强,早期症状不典型,且无可用于治疗的特效药物[3-4],因此目前防控COVID-19疫情最有效的方法就是接种疫苗。本研究志愿者接种的疫苗为北京生物制品研究所生产的新型冠状病毒灭活疫苗。灭活疫苗与减毒活疫苗相比,采用的是非复制性抗原(死疫苗),其安全性好,但免疫原性较弱,因此必须加强免疫。
本研究共入组121名志愿者,年龄为20~59岁。由于最初采用的是2剂次免疫,因此本研究中2剂次组受试者完全配对。后根据防疫政策,改为接种加强针,因时间跨度比较大,3剂次组不能做到严格配对,第3针疫苗接种前和第3针疫苗接种后7 d各入组30名志愿者。本研究结果显示,2剂次组男性、女性之间SARS-CoV-2总抗体及IgG抗体差异无统计学意义(P>0.05)。有学者对COVID-19恢复期血浆捐献者做过评估,发现男性的抗体水平高于女性,较年长者的抗体水平高于较年轻者[5]。本研究结果与文献报道[5]不一致,提示疫苗接种后的体液免疫状况与真实感染后的免疫状况有所不同。疫苗接种后抗体产生的年龄段差异及性别差异,以及抗体持续时间需进一步扩大样本量后深入分析。
本研究结果显示,2剂次组第2针疫苗接种后7 d总抗体、IgG抗体产生的有效率均为93.44%(57/61),3剂次组第3针疫苗接种后7 d SARS-CoV-2总抗体、IgG抗体的阳性率分别为100.00%、93.33%,提示接种SARS-CoV-2疫苗后,人体体液免疫被激活。本研究结果还显示,在第3针疫苗接种前SARS-CoV-2总抗体和IgG抗体水平显著降低,第3针疫苗接种后7 d SARS-CoV-2总抗体和IgG抗体水平显著升高。说明加强针疫苗刺激了接种者体内原有的记忆B细胞、记忆T细胞快速产生大量抗体,提示按免疫程序接种2针疫苗后,再次接种疫苗加强针是非常有必要的。
SARS-CoV-2可通过S蛋白结合ACE2进入人体细胞进行复制并诱导膜融合[6]。有研究发现,与SARS-CoV-2 S蛋白受体结构域结合的抗体可防止病毒附着于宿主细胞并中和病毒[7],功能性中和抗体的生成具有保护作用[8]。本研究结果显示,2剂次组SARS-CoV-2 RBD中和抗体的阳性率为81.96%。3剂次组中和抗体接种前T/C值为2.30±0.05,接种后为1.87±0.05,其接种前、后的T/C值差异有统计学意义(P<0.001)。提示接种SARS-CoV-2灭活疫苗后人体能产生有效的中和抗体。本研究2剂次组中和抗体阳性率低于同一疫苗在国外Ⅲ期临床试验的数据(中和抗体阳性率为99.52%)[9-10],原因可能与本研究入组例数较少以及采血时间点不同有关。
从人体防御机制上看,病毒会被抗原呈递细胞摄入,呈递给辅助性T细胞,进而激活B细胞,产生抗体[11]。Tfh的主要功能是参与B细胞分化过程中的信息传递,协助激活B细胞,促进生发中心的形成和免疫球蛋白类别的转换,维持长时间的体液免疫应答。Tfh对免疫系统的建立以及功能的完善非常重要,特别是针对感染性疾病的体液免疫起决定性调节作用。本研究结果显示,2剂次组接种第2针疫苗后7 d的Tfh百分比(11.4%)显著高于接种前(3.92%)(P<0.01)。提示接种SARS-CoV-2灭活疫苗后机体产生了有效的细胞免疫应答。后续将对疫苗接种后的细胞免疫应答进行跟踪和评价,分析Tfh及其他细胞亚群与疫苗接种后免疫力维持之间的关系,全面探讨疫苗接种对人体各种免疫功能状态的影响。
机体对抗外来感染是一系列免疫相关功能表达的综合作用,COVID-19重症患者可因细胞因子的大量释放而导致细胞因子风暴。细胞因子风暴是病毒性肺炎患者已知的死因之一[12]。石玉玲等[13]的研究结果显示,有多种炎症指标,如CRP、IL-6、IL-8的水平变化与COVID-19关系密切。COVID-19患者在疾病的发生、发展中,IL-6和CRP均高于参考区间上限,并处于持续升高状态,CD4+T淋巴细胞和CD8+T淋巴细胞数量显著下降,并随着患者病情的好转而逐渐恢复[14]。本研究结果显示,2剂次组接种前与接种第2针后7 d、3剂次组第3针疫苗接种前与接种后7 d的12种细胞因子(IL-1β、IL-2、IL-4、IL-5、IL-6、IL-8、IL-10、IL-12、IL-17、IFN-α、IFN-γ、TNF-α)水平差异均无统计学意义(P>0.05)。提示接种SARS-CoV-2灭活疫苗不会对人体免疫功能造成影响。
综上所述,接种SARS-CoV-2灭活疫苗后机体可产生中和抗体和反应性抗体,且不会影响人体免疫功能。后续研究将进一步探讨边缘区B细胞对调控SARS-CoV-2 S蛋白的免疫记忆机制,为COVID-19的早诊早治提供实验室依据。
