2 型糖尿病患者并发糖尿病肾病的影响因素分析
2022-09-17马晓喻肖芝梅谭卓菁
马晓喻 肖芝梅 谭卓菁
江苏省如皋市人民医院肾内科,江苏如皋 226500
研究发现,糖尿病患者往往合并多种靶器官损伤[1],如肾脏损伤[2],最终引起糖尿病肾病(diabetic nephropathy,DN)[3-4]。DN 是糖尿病并发症,是肾衰竭的主要病因[2],属严重并发症[5]。损伤的肾小管周围存在巨噬细胞积聚和活化[6-7],减少肾组织中巨噬细胞聚集后,尿白蛋白水平及小管间质损伤程度均显著下降[8-9],巨噬细胞参与DN 的机制主要因其释放大量的炎症因子及促纤维化因子等物质[8]。
细胞微粒根据细胞来源分为血小板源微颗粒(platelet microparticles,PMPs)[10]、白细胞源性微颗粒[11],内皮细胞源性膜微粒[12]及红细胞微粒或微泡等[13],其在DN 患者中表达水平显著升高[14]。PMPs 促进单核细胞黏附内皮细胞,促进白细胞运送至炎症部位,参与炎症反应等病理生理过程[13,15]。但目前关于PMPs 在DN 患者外周血中表达变化及临床意义尚不可知,拟通过本研究阐明上述问题。
1 对象与方法
1.1 研究对象
选取2015 年9 月至2017 年12 月就诊于江苏省如皋市人民医院(以下简称“我院”)内分泌科明确诊断为DN 的患者为DN 组(116 例),选取同期就诊于我院内分泌科的116 例2 型糖尿病(type 2 diabetes mellitus,T2DM)患者归为T2DM 组。T2DM 诊断标准:临床表现为典型糖尿病症状(包括但不仅限于多饮、多尿、多食及体重减轻)及下列任意一点:①随机血糖或餐后2 h 血糖≥11.1 mmol/L,②空腹血糖≥7.0 mmol/L[16];DN 的诊断主要是根据T2DM 患者尿白蛋白排泄率(urinary albumin excretion rate,UAER),UAER 为30~300 mg/d[17]。纳入标准:临床明确诊断且同意入组。排除标准:①存在其他原因所致肾功能不全;②目前合并感染以及存在传染性疾病;③透析;④伴恶性肿瘤。本研究由我院医学伦理委员会审批通过(批准号:2020xjso1-07)。
1.2 资料收集
1.2.1 临床基线资料 收集患者临床基线资料,包括年龄、性别、合并慢性基础疾病史(高血压、高血脂)、糖尿病病程。
1.2.2 实验室指标 严格留取24 h 尿液标本,采用免疫比浊法测定尿白蛋白水平,并计算UAER;检测肌酐(creatinine,Cr)、估算肾小球滤过率(estimated glomerular filtration rate,eGFR)、血尿素氮(blood urea nitrogen,BUN)及糖化血红蛋白(glycosylated hemoglobin,HbA1c)等。
1.3 PMPs 水平测定
收集患者外周血离心(110 r/min,15 min)后提取富含血小板的上清液至抗凝管中,再次离心(710 r/min,15 min)弃去上清液留取血小板沉淀,CGS 缓冲液及Tyrode’s 缓冲液重洗调整血小板浓度为300×109/L 后加入20 μmol/L 的ADP,37℃水浴锅中静置10 min 激活血小板产生PMPs,浓度为300×109/L,第三次离心(710 r/min,15 min)收集含PMPs 的上清液,应用FITCCD61(美国eBioscience 公司)及荧光抗体作为荧光标记物,通过FACSCanto Ⅱ流式细胞仪(美国BD 公司)检测PMPs 水平。
1.4 统计学方法
采用SPSS 13.0 软件进行数据分析,计量资料用均数±标准差(±s)表示,组间比较采用t 检验;计数资料用例数或百分率表示,组间比较采用χ2检验;多因素分析采用logistic 回归分析;受试者操作特征(receiver operating characteristics,ROC)曲线评估PMPs等指标诊断DN 的价值。以P <0.05 为差异有统计学意义。
2 结果
2.1 T2DM 并发DN 的单因素分析结果
DN 组糖尿病病程、HbA1c、UAER、Cr、BUN、PMPs水平高于T2DM 组,eGFR 水平低于T2DM 组(P<0.05)。见表1。
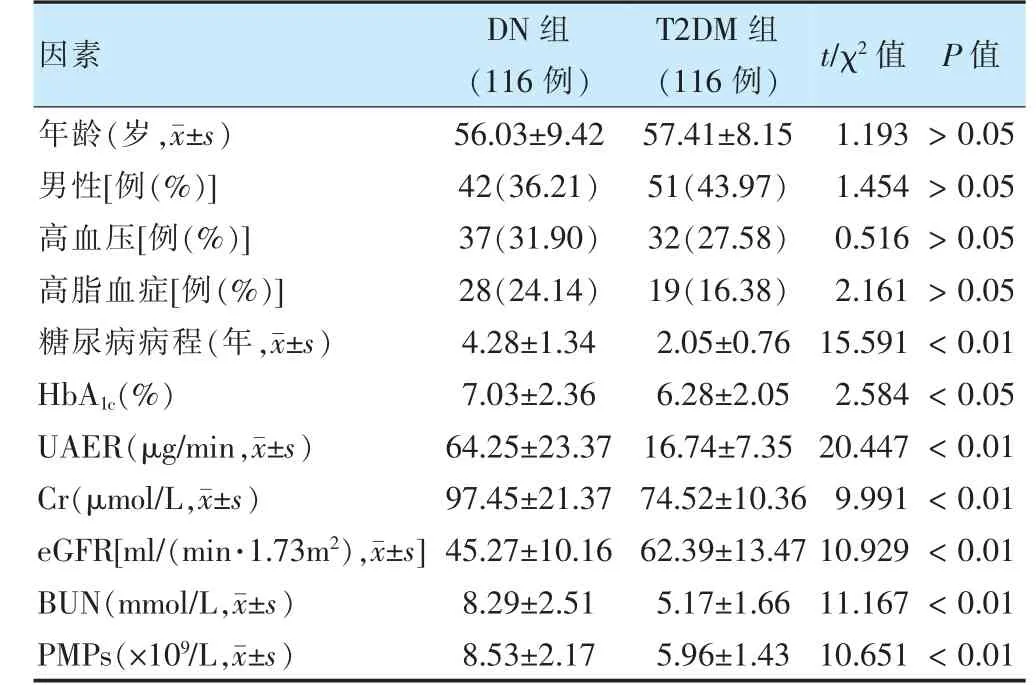
表1 T2DM 并发DN 的单因素分析结果
2.2 T2DM 并发DN 的多因素分析结果
将糖尿病病程、HbA1c、UAER、Cr、eGFR、BUN 及PMPs 作为自变量,以T2DM 患者是否并发糖尿病肾病为因变量(是=1,否=0)行多因素logistic 回归分析。结果显示,HbA1c、UAER 及PMPs 是DN 的独立危险因素(OR >1,P <0.05)。见表2。
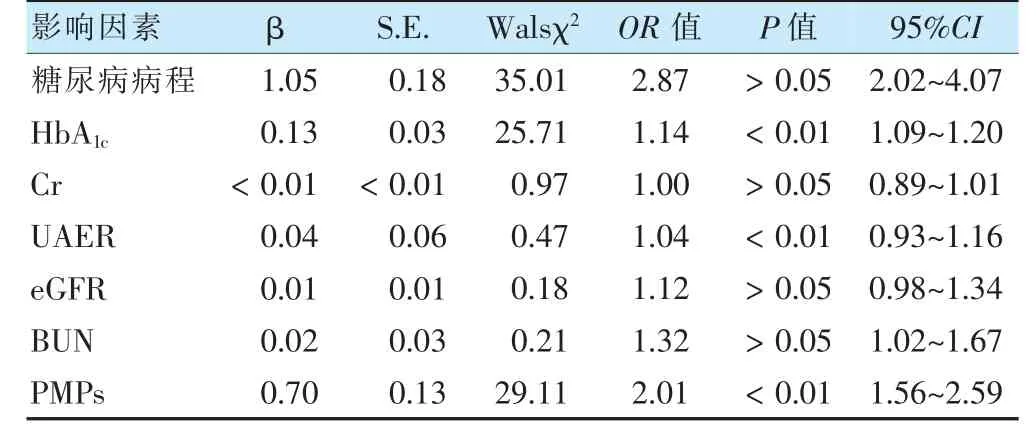
表2 T2DM 并发DN 的多因素分析结果
2.3 ROC 曲线结果
UAER、HbA1c及PMPs 联合检测DN 的曲线下面积高于UAER、PMPs 及HbA1c单独检测。见表3、图1。

图1 ROC 曲线

表3 ROC 曲线结果
3 讨论
DN 发病率增加[18],已成为临床常见继发性肾脏疾病,临床表现为蛋白尿[19]、高血压[20]等,增加了心血管事件的发病率及死亡率[7],影响居民的生命健康[21]。传统DN 危险因素为高血压史、应用胰岛素、HbA1c、eGFR、尿蛋白阳性等[22]。本研究结果显示,DN 组HbA1c、UAER、Cr、BUN、PMPs 水平高于T2DM 组,eGFR 水平低于T2DM 组。提示DN 患者血糖控制更差,肾功能不佳,外周血PMPs 表达上调。内皮细胞微粒在DN 患者中表达水平显著升高[5-6]。HbA1c反映了过去2~3 个月糖尿病患者血糖控制整体水平,是糖尿病患者微血管或大血管病变的危险因素[23-24]。糖尿病病程是患者出现各种并发症的主要危险因素,更是肾脏并发症的首要危险因素,糖尿病病程超过5 年,即可出现微量蛋白尿,如不积极干预则可进展至DN[25-27];动物实验也证实了DN 动物模型肾小管损伤程度与肌酐、尿白蛋白水平和肾小球硬化及间质纤维化呈正相关[3-4]。本研究结果显示,DN 患者糖尿病病程长于单纯T2DM 患者,但糖尿病病程并非DN 的独立危险因素,可能是纳入样本量少导致统计学偏倚。
本研究结果显示,DN 患者PMPs 表达显著增加,既往有学者研究发现,PMPs 在病程超过2 年的T2DM 患者中显著升高,病程越长,PMPs 水平越高,而且PMPs 与微血管病变指标呈正相关[28]。多因素logistic 回归分析显示PMPs 是DN 的独立危险因素。而T2DM 患者循环PMPs 升高的原因可能与微血管病变造成血流剪切力激活血小板密切相关[25]。
