PVA 包膜改性树脂制备及性能探究
2022-09-17宰文静张婷芳孔金龙李嘉嘉刘志远崔景强
宰文静,张婷芳,孔金龙,李嘉嘉,刘志远,张 镭,程 杰,崔景强
(1.河南省医用高分子材料技术与应用重点实验室,河南 新乡 453400;2.河南省驼人医疗科技有限公司,河南 新乡 453400;3.甘肃省医疗器械检验检测所,甘肃 兰州 730070)
随着中国人口老龄化进程的加快,慢性肾脏病(CKD)的患者人数日益增多[1]。目前,中国实际慢性肾脏病患者人数已接近300 万,且未来3~5年可能以15%左右的复合增长率持续增长[2]。血液灌流(HP)市场规模预计到2024年将达到35.6 亿元,对各适应症的理论市场规模将达到200 亿元人民币,市场空间广阔[3-4]。
血液灌流是将患者的血液引入装有固态吸附剂的灌流器中,通过吸附作用,清除血液中透析不能清除的外源性或内源性毒素、药物或代谢废物的一种血液净化技术。核心技术主要是内部的吸附树脂,目前市场上用的吸附树脂主要有活性炭类、多糖类和合成树脂类,其中合成树脂在机械强度、化学稳定性以及孔结构和功能基团的可控性上具有优势;市场上现有产品中,全血灌流常用大孔吸附树脂。通过物理吸附、范德华力、氢键作用等实现吸附过程[5-6]。
目前市售树脂大多属于化工产品,在物理性能、吸附性能、生物相容性能等方面参差不齐,严重影响了灌流器市场的发展,并且树脂吸附性能缺少特异性,大多吸附剂在清除血液中有害物质的同时,也吸附了诸如白蛋白等对人体有益的物质,这就带来了较大的副作用[7]。本文选用安全性较好的PVA(PolyvinylAlcohol)成膜材料,采用包膜技术对树脂进行改性。制备了PVA包膜改性树脂,并对其吸附性能进行了探究,树脂具有较好的吸附β2 微球蛋白效果,对白蛋白的黏附较小,同时微粒脱落和生物安全性较好,能够满足目前血液灌流的性能要求,具有较好的临床意义[8-10]。
1 实验部分
1.1 材料及设备
选择的材料如下:树脂,型号为TRBL-1,购于江苏色可赛思树脂有限公司;医用级聚乙烯醇,型号为1788 型,购于江西阿尔法高科药业有限公司;戊二醛,50%水溶液,购于上海阿拉丁生化科技股份有限公司;H2SO4,0.5 mol/L,购于烟台双双化工有限公司;β2微球蛋白,购于大连康元医疗科技有限公司;牛血浆,500 mL,购于平睿生物科技有限公司;其他试剂均购自国药化学试剂有限公司(上海)。
选择的设备如下:微粒分析仪,型号为GWF-8JD,购于天津天河分析仪器有限公司;电热鼓风干燥箱,型号为DHG-9245A,购于上海一恒科技有限公司;恒温水浴振荡器,型号为SHA-B,购于常州天瑞仪器有限公司;比表面积与孔径分析仪,型号为Belsorp MiniX,购于大昌华嘉香港有限公司;全自动生化分析仪,型号为BS-430,购于深圳迈瑞生物医疗电子股份有限公司;全自动凝血分析仪,型号为RAC-030,购于雷杜生命科学股份有限公司。
1.2 树脂改性
树脂改性的步骤如下:①配置PVA 水溶液(质量分数为0.1%~5%),用电子天平称取一定质量的纯化水,置于单口烧瓶中,磁力搅拌条件下,加入PVA,待分散均匀后由常温25 ℃升至80 ℃,搅拌3 h 后得到充分溶解的PVA 水溶液;②三口烧瓶中,加入配置好的2%PVA 水溶液后,机械搅拌下,加入一定量的戊二醛(50%水溶液),而后滴加0.5 mol/L 的硫酸(硫酸溶液与所述PVA水溶液的体积比为1∶50~1∶30),溶液进行交联反应1 h,得到PVA 交联液;③量筒量取一定量的中性大孔树脂(所述PVA 水溶液与树脂的体积比为10∶1~5∶4),加入到制得的PVA交联液中,搅拌包膜5 min,抽滤,得到粗产品树脂,随后加入用无水乙醇将吸附剂充分分散,再用纯化水冲洗至中性,最终得到包覆PVA 膜的血液灌流树脂吸附剂[11]。
交联度的公式如下:
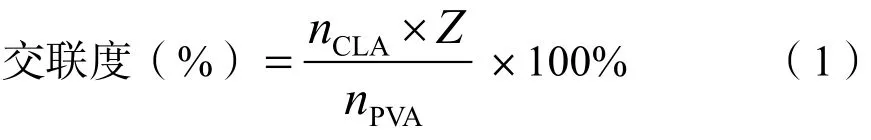
式(1)中:nCLA为交联剂的物质的量;Z为交联剂与PVA 上OH 的结合数,当CLA 为戊二醛时,Z=4;nPVA为PVA 单体的物质的量。
1.3 树脂测试与表征
1.3.1 外观与物理性质表征
1.3.1.1 外观
树脂包膜前后均为白色球状固体颗粒,粒径为300~800 μm。
1.3.1.2 BET 表征
将包膜后的树脂在150 ℃真空下干燥8 h 后,用Belsorp MiniX 比表面积与孔隙度分析仪进行分析。
1.3.1.3 SEM 表征
吸附树脂经离子溅射仪真空喷金后,采用美国-FEI-Quanta FEG 250(能谱:EDAX Element)进行观察。
1.3.2 表面结构表征
吸附树脂采用美国-赛默飞-Thermo Scientific ESCALAB Xi+进行XPS 分析[12]。
1.3.3 树脂吸附试验
按照YY/T 0464—2019 方法进行树脂吸附试验。
1.3.4 微粒脱落试验
按照YY/T 0464—2019 方法进行树脂微粒脱落实验。
1.3.5 生物项试验
参考GB/T 16886.5 中方法进行细胞毒性试验,Viab.%值大于等于70%时,表示无潜在细胞毒性;参考GB/T 16886.4 中方法进行树脂溶血试验,溶血率应小于等于5%;参考GB/T 16886.4 中方法进行凝血试验,结果与对照相比在统计学上无显著差异或优于对照组。
2 结果与讨论
2.1 外观与物理性质表征
树脂比表面积与孔径分析如表1所示。从表中可以看出,当交联度在10%~30%时,树脂的比表面积与平均孔径变化较小,几乎没有改变孔径结构;当交联度提升至50%以上时,树脂的比表面积明显降低,平均孔径明显变小,可能是由于交联度的提升,交联膜黏度增大,导致孔径堵塞。说明在低交联度时,这种改性方式保留了树脂本身的微孔结构,可能不会对树脂本身的吸附性能造成影响。
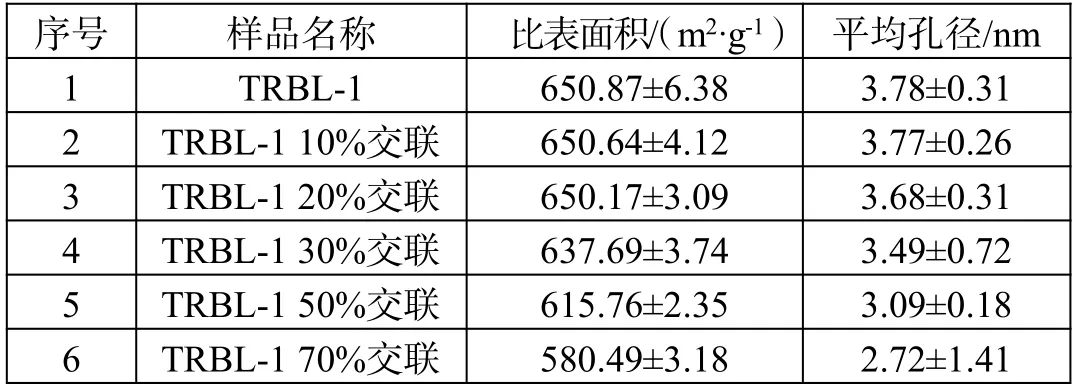
表1 树脂比表面积与孔径分析
树脂包膜前、后SEM 表征如图1所示。图1(a)为树脂包膜前SEM 图,将图1(b)、图1(c)和图1(d)与其对比可以看出,当树脂交联度小于30%时,表面结构未发现明显变化,可能保留了树脂本身的微孔结构。从图1(e)和图1(f)中可以看出,当交联度超过50%时,能够看到树脂表面的颗粒感和PVA 交联膜网状结构,说明树脂包膜交联度过高,可能引起微粒脱落和堵孔的风险。

图1 树脂包膜前、后SEM 表征
2.2 表面结构表征
PVA 改性原理如图2所示。

图2 PVA 改性原理
树脂包膜前、后XPS 表征如图3所示。从图3(a)和图3(c)中可以看出,树脂包膜前、后氧的峰强度增加,说明包膜后氧元素含量上升;从图3(b)和图3(d)中可以看出,包膜后出现286.2 C-O 键的特征峰。结合PVA 改性原理中可以得出,PVA 与戊二醛发生缩合反应,形成了改性PVA 交联膜,并存在于树脂表面。
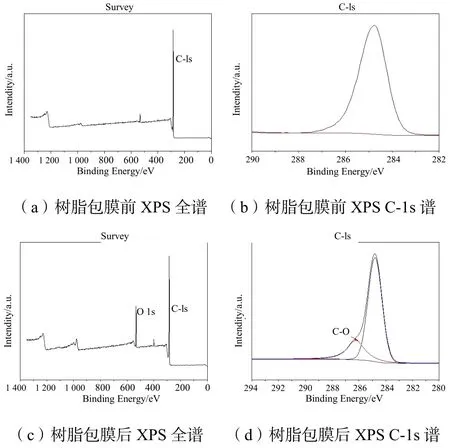
图3 树脂包膜前、后XPS 表征
2.3 不同交联度对树脂吸附性能的影响
不同交联度对树脂吸附性能的影响如表2所示。从表中可以看出,随着交联度的提升,树脂对白蛋白的黏附有下降的趋势,当交联度大于30%后,抗黏附效果不再明显提升,但对β2 微球蛋白吸附率逐渐下降。结合树脂比表面积数据进行分析,可能是交联度的提升会增加树脂的团聚、交联膜堵孔的可能,同时也会增加树脂微粒脱落等风险,故选择交联度在10%~30%之间,既有较好的抗白蛋白黏附效果,又不明显降低对β2 微球蛋白的吸附。另外树脂的吸附性能也可能与裸树脂本身的材质及物理性能、化学性能等有一定的关系[13]。

表2 不同交联度对树脂吸附性能的影响
2.4 微粒脱落
通过不同交联度对树脂吸附性能影响的分析,选用TRBL-1 和TRBL-1 20%交联度进行微粒脱落试验,包膜前、后微粒脱落如表3所示。从表中可以看出,包膜改性前树脂的微粒数较多,接近标准值,有一定的微粒脱落风险。经过包膜改性之后微粒数明显减少,说明包膜改性不仅能降低白蛋白的黏附率,还降低了微粒脱落的风险。

表3 包膜前、后微粒脱落
2.5 生物学评价
树脂包膜前、后生物学评价如表4所示。从表中可以看出,对包膜改性后的树脂进行细胞毒性、溶血、凝血测试,结果表明包膜后树脂没有潜在的细胞毒性,溶血率均小于5%,并且有一定的抗凝血效果,说明包膜改性并没有影响吸附树脂的生物安全性,为树脂进入临床验证提供了很好的参考。

表4 树脂包膜前、后生物学评价
3 结论
包膜改性是贴着树脂的微观结构进行的,没有改变树脂本身的比表面积和孔径结构;包膜树脂在对β2微球蛋白的吸附性能不低于90%的前提下,增加了抗白蛋白黏附效果,具有较好的临床意义;包膜改性后树脂微粒脱落数明显下降,降低了医疗风险;包膜改性后树脂细胞毒性、溶血、凝血均符合行标要求,说明改性方式相对安全。
4 展望
树脂吸附剂可以为肾衰竭患者吸附体内的毒素,为病人提供良好的临床效果,是血液灌流领域的重要发展方向,但降低对血液中有益物质的吸附仍然是一项需长久解决的问题。对吸附树脂包膜改性是一种有效途径,但是从合成树脂的源头引入抗白蛋白等有益物质的吸附无论从产业化的方向还是对患者的治疗方面,都将具有重要的意义。
