水中pH值测定的方法验证及影响因素分析
2022-09-16孙振红
孙振红,马 健,王 莉
(天津港保税区环境监测站,天津 300308)
0 引言
pH值是水中氢离子活度的负对数,可间接表示水的酸碱程度[1]。天然水和污水排放控制中,pH值的控制范围要求多在6~9。pH值不仅可直接影响水中生物的生存,或通过改变水环境中其他理化及生物因子从而间接作用于生物,而且对色度[2]、氨氮和总硬度等其他指标的测定也有影响。
随着环境管理的逐步加强,水质得到了逐步改善。pH值测定作为环境监测中常用和重要的检验项目之一,其准确性对环境管理有重要的保证作用。目前常用的测定pH值的方法主要有电极法和比色法,本文以实验室常用的电极法为例,对《水质pH值的测定 电极法》(HJ1147-2020)开展方法验证,并对影响pH值结果的因素进行探讨。
1 实验部分
1.1 检测方法及原理
检测方法依据《水质pH值的测定电极法》(HJ1147-2020),并根据《环境监测分析方法标准制修订技术导则》(HJ168-2020)对该方法精密度和准确度进行验证[3]。
pH值由测量电池的电动势而得。该电池通常由参比电极和氢离子指示电极组成。溶液每变化1个pH单位,在同一温度下电位差的改变是常数,据此在仪器上直接以pH的读数表示。
1.2 仪器设备与试剂
pH计,型号ORION 3 STAR,精确度0.01个pH单位,具有良好的温度补偿功能;标准缓冲溶液,pH计自带的标准缓冲溶液,pH=4.01(25 ℃)、pH=7.00(25 ℃)、pH=10.01(25 ℃);实验用水:新制备的去除二氧化碳的蒸馏水;250 mL的容量瓶;10 mL的移液管;聚乙烯洗瓶;烧杯。
1.3 实验过程
1.3.1 现场采样
按照地表水和污水监测技术规范的相关规定采集样品,现场测定;或采集样品于聚乙烯采样瓶中,样品充满容器立即密封,2 h内完成测定。
1.3.2 测定前准备
打开仪器电源,仪器开机预热30 min,按照使用说明书对电极进行活化和维护,确认仪器正常工作。现场测定应先了解现场环境条件及样品的来源和性质,初步判断是否存在强酸碱、高电解质、低电解质、高氟化物等干扰,并进行相应的准备。
1.3.3 仪器校准
使用pH广泛试纸粗测样品的pH值,根据样品的pH值大小选择两种合适的校准用标准缓冲溶液,两种标准缓冲溶液的pH值相差约3个pH单位。样品pH值尽量在两种标准缓冲溶液pH值范围之间,若超出范围,样品pH值则应与其中一个标准缓冲溶液pH值之差不超过2个pH单位。
采用两点校准法,按照仪器说明书选择校准模式,先用中性标准缓冲液(pH7.00)校正,再用与被测样品pH值接近的缓冲液进行校正(如pH4.01或pH10.01),仪器的示值与标准缓冲溶液的pH值之差应≤0.05个pH单位,否则重复校准,直至合格。
1.3.4 样品测定
用实验用水冲洗电极并用滤纸边缘吸去电极表面水分,测定时将样品沿杯壁倒入烧杯中,并立即将电极浸入样品中,缓慢水平搅拌,避免产生气泡。待读数稳定后记下pH值。酸度计1 min内读数变化小于0.05个pH单位即可视为读数稳定。
每个样品测定完成后均用实验用水冲洗电极。使用后,用实验用水清洗电极至初始值。关闭电源,拔下电极并浸泡在储备液中保存[4]。
1.3.5 验证内容
笔者根据仪器使用方法,对该方法的精密度、准确度进行验证,并进行了实验室人员比对验证。
2 实验结果
2.1 方法精密度数据汇总
结论:实验室分别对地表水、生活污水和工业废水样品进行平行测定7次,地表水平均值为8.30,标准偏差为0.005,极差为0.01;生活污水平均值为7.77,标准偏差为0.007,极差为0.02;工业废水平均值为8.08,标准偏差为0.005,极差为0.01。
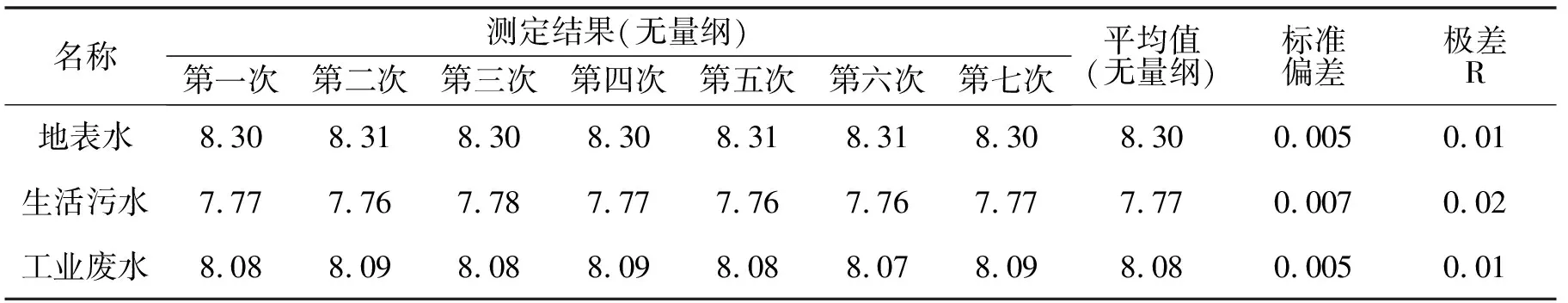
表1 精密度测试数据汇总
2.2 方法准确度结果汇总

表2 准确度测试数据汇总
结论:实验室对pH值分别为4.12±0.05、7.36±0.05、9.06±0.07的有证标准样品进行测定、测定结果均在给定的保证值范围内,绝对误差分别为-0.02、0.01、0.04。
2.3 人员比对验证结果
实验室人员比对验证结果如下:地表水测定结果分别为8.30和8.31,生活污水测定结果分别为7.77和7.77,工业废水测定结果分别为8.08和8.08。
3 测定的影响因素及控制
水样的颜色、胶体物质、浊度、还原剂和氧化剂均不干扰pH值电极法的测定。当水样pH值小于1或者大于10时,会产生误差,应采用耐酸碱的pH电极测定,当水样含有高浓度氟的酸性样品时,应采用耐氢氟酸pH电极测定。
水中pH值测定影响因素主要有pH计的校准、pH电极的性能、标准缓冲溶液、空气中二氧化碳、样品的温度和pH计的维护与保养等。
3.1 pH计的校准
每次使用pH计之前,都需要用缓冲溶液重新校准。pH计的校准一般采用两点校准模式,先用中性标准缓冲液校正,再用酸性或碱性标准缓冲溶液校准。如果pH计示值与标准缓冲溶液pH值大于0.05个pH单位,则需要重新校准。
3.2 pH计电极的性能
利用pH计缓冲溶液校准完成后,对电极的性能进行检查。若电极斜率在92%-102%之间,则表明电极状态良好,可以正常使用;若电极斜率大于102%,则需要对标准缓冲溶液进行监测;如果电极斜率低于92%,那么电极就需要保养或者更换。
3.3 标准缓冲溶液
将邻苯二甲酸氢钾、无水磷酸氢二钠、磷酸二氢钾分别于110℃~120℃下干燥2h,分别置于干燥器中保存,备用。按照标准要求配制缓冲溶液,其中实验用水必须是新制备的去除二氧化碳的蒸馏水,这样配制的标准缓冲溶液的pH是已知的,也可以购买市售合格的标准缓冲溶液,按照说明书使用即可。每次更换标准缓冲溶液前,应用实验用水充分冲洗电极,且不允许使用过的标准缓冲溶液再倒回原瓶中。配制的标准缓冲溶液于4℃以下冷藏可保存2~3 个月,若发现溶液有混浊、发霉或沉淀等现象,则不能继续使用。
3.4 空气中的二氧化碳
空气中二氧化碳气体会溶入样品,或者样品中的二氧化碳会挥发,从而引起样品pH值的变化。为了减少空气中二氧化碳的影响,或减少样品中相应物质的挥发,测定前不应打开采样瓶,且采样后应在2 h内测量。
3.5 样品的温度
温度对水样的电离平衡有影响,会导致水样的pH值发生变化。实际上,pH计的温度补偿能补偿对于pH电极的影响,但不能补偿温度对样品的影响[5]。测定样品时,pH计自动测量样品实际温度并对电极斜率进行补偿,测定结果(仪器示值)为水样实际温度下的pH 值。这是pH值测量过程中无法回避温度带来的测量上的固有误差,研究人员要尽可能保持水样温度的恒定,并使之接近于工作环境。
3.6 pH计的维护与保养
按照pH计说明书,定期对仪器进行维护与保养。测定完样品后,用去离子水冲洗电极,并将电极浸泡在电极储存液中保存[6]。电极填充液腔要时刻保持被填充液填充的状态。避免电极被强酸、强碱样品长时间浸泡,测定完后即刻对电极进行清洗。
4 结论
通过对该方法的精密度、准确度和实验室人员比对验证分析,该实验室具有水中pH值测定的检测能力。测定pH值过程中,影响因素主要来自pH计的校准、pH电极的性能、标准缓冲溶液、空气中二氧化碳、样品的温度和pH计的维护与保养。在实际检测过程中需提高实验人员的专业技术水平,控制好每个影响检测结果的因素,切实提高pH值检测结果的准确性和可靠性。
