植物乳杆菌P-8对小鼠肠道菌群及抗氧化抗炎能力的研究
2022-09-16胡梦莹徐浩原韩金鹏张连中牛策王志斌
胡梦莹,徐浩原,韩金鹏,张连中,牛策,王志斌
1(北京中医药大学 中药学院,北京,100029)2(北京联合大学 生物化学工程学院,北京,100023) 3(北京鸿测科技发展有限公司,北京,100176)
肠道菌群绝大多数属于拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)[1],其中拟杆菌门主要包括拟杆菌属﹑普氏菌属和木杆菌属,厚壁菌门主要包括梭状芽孢杆菌属﹑乳杆菌属和瘤胃球菌属以及产丁酸盐的Eubacterium、Fecalibacterium和Roseburia[2]。
肠道菌群与免疫系统相互协调,在维持宿主的健康中发挥着重要作用。肠道菌群(拟杆菌属、乳杆菌属等)可以诱导抗菌肽、免疫球蛋白A的表达,从而防御病原体[3]。肠道菌群也可以通过激活自身表位进而驱动Th1、Th17和调节性T细胞(CD4+、CD25+、Foxp3+)分化、B细胞反应,促进机体对无害抗原的耐受,参与宿主的免疫应答和组织修复[4]。肠道菌群及其代谢产物还可以与免疫系统相互作用,传递促进免疫细胞成熟和免疫功能正常发育的神经信号[5],还可以通过抑制组蛋白去乙酰化酶,并激活GPR41、GPR43、TLR4-TRIF信号通路以促进缺氧诱导因子lα(hypoxia inducible factor 1α,HIF1α)及芳香经受体(aryl hydrocarbon receptor,AhR)、干扰素刺激基因的表达,促进细胞因子白介素(IL-6、IL-22、IL-18等)的产生,从而调节肠道巨噬细胞的活性,促进病原体清除,维持免疫内环境的稳定和阻止自身免疫疾病的发展[6-7]。
肠道菌群的组成、结构或分布等发生变化时,就会打乱宿主体内平衡,影响宿主代谢,从而导致疾病。但是这种平衡状态极易受外界环境和宿主自身因素的影响。目前,科学领域中最为认可的、能够快速且有效调节肠道菌群、修复肠道微生态的主要途径为补充益生菌[8]。适当剂量益生菌可协助恢复肠道屏障的完整性,并引起肠道微生物群结构和功能的有利变化[9]。目前,研究较多的益生菌主要包括乳杆菌和双歧杆菌属。植物乳杆菌为乳杆菌属,圆端直杆菌,单个、成对或短链状,革兰氏阳性,无芽孢,兼性厌氧,通常最适温度为30 ℃~35 ℃(T/CSWSL 005—2018 《饲料添加剂 植物乳杆菌》),其代谢产物有机酸能够抑制有害微生物的生长。植物乳杆菌(Lactobacillusplantarum)P-8是一株2005年从内蒙古巴彦淖尔草原牧民家庭中自然发酵酸牛乳中分离获得的菌株[10],有很强的抗菌活性,对酸性环境和胆盐有良好的耐受力,在pH 2.5的人工胃液中处理3 h后存活率达90.16%,在pH 8.0的人工肠液中处理24 h,活菌数不受影响[11]。植物乳杆菌P-8可以通过其表面蛋白黏附定植于人体肠道中,定植时间超过4个月[12]。定植于肠道后,一方面与有害菌竞争营养物质,另一方面代谢产生多种具有抑制有害菌功能的物质(乳酸﹑细菌素和双乙酰等),从而抑制病原菌在肠道的定植,进而改善肠道微生物菌群的平衡[13]。另有研究发现,在日粮中添加植物乳杆菌P-8可显著提高肉鸡42日龄肠道中总细菌、乳杆菌属、链球菌属、梭杆菌亚种和双歧杆菌属等有益菌的数量,同时极大降低埃希氏菌属、脱硫弧菌属和弯曲杆菌属等潜在致病菌的数量[14]。
目前,植物乳杆菌P-8因其能够在肠道中长期稳定的定植并发挥益生功能,在家禽生产应用上得到广泛研究。其在人用产品生产应用上的研究主要集中在对肠道菌群的影响及改善抑郁症状,对于植物乳杆菌P-8是否具有抗氧化和抗炎功能尚未报道。本研究采用植物乳杆菌P-8灌胃健康小鼠,考察其对小鼠肠道菌群的影响,同时研究其对小鼠的抗氧化能力和抗炎反应,以期为揭示植物乳杆菌P-8的益生、保健功能及相关益生菌制剂的开发利用提供依据。
1 材料与方法
1.1 动物、材料与试剂
健康SPF级BALB/c雄性小鼠52只,体质量18~20 g,购于北京华阜康生物科技股份有限公司,实验动物使用许可证号:SYXK(京)2017—0038。所有小鼠饲养于北京联合大学应用文理学院SPF级动物房,饲养室温度为(20±2) ℃,相对湿度为45%~60%。本研究动物实验设计和实施方案通过了北京联合大学伦理委员会审核和批准(实验动物伦理委员会意见书编号2021—6)。
植物乳杆菌(Lactobacillusplantarum)P-8,北京科拓恒通生物技术股份有限公司;谷胱甘肽(glutathione, GSH)测定试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)测定试剂盒、总超氧化物歧化酶(total superoxide dismutase, T-SOD)测定试剂盒、丙二醛(malondialdehyde, MDA)测定试剂盒,南京建成生物工程研究所;伊红美蓝琼脂(eosin-methylene blue, EMB)培养基、肠球菌培养基(叠氮钠-结晶紫-七叶苷琼脂)、双歧杆菌琼脂培养基(BBL)、乳杆菌选择性培养基(LBS琼脂)、胰胨-亚硫酸盐-环丝氨酸琼脂培养基,北京陆桥技术股份有限公司;ELISA试剂盒,武汉华美生物工程有限公司;BCA蛋白浓度测定试剂盒,北京鼎国昌盛生物技术有限责任公司。
1.2 仪器与设备
LB943酶标仪,Bert hold Technologles;JA2003电子天平,上海舜宇恒平科学仪器有限公司;TGL-16M离心机,湖南湘仪实验室仪器款开发有限公司;WH-1漩涡混合器,常州市凯航仪器有限公司;SMART-N超纯水机,上海康雷分析仪器有限公司;UV—1800紫外可见分光光度计,上海美谱达仪器有限公司;WDX4000荧光仪,江苏天瑞仪器股份有限公司。
1.3 方法
1.3.1 动物分组及分组处理
将52只Balb/c雄性鼠,适应性饲养7 d后,随机分为空白组、低剂量组、中剂量组和高剂量组,每组13只,低、中、高剂量组每天分别按照2.5×107、5×107、1.5×108CFU/kg剂量灌胃植物乳杆菌P-8,空白组灌胃等体积的生理盐水,连续灌胃30 d。实验过程中小鼠自由摄食和饮水。灌胃期间每天监测小鼠体质量和摄食情况并记录。
1.3.2 小鼠粪便细菌计数
分别在灌胃的第0天和第30天,无菌操作取小鼠粪便0.1 g,加稀释液后振荡混匀,按照10倍梯度稀释至10-8,分别用EMB培养基、肠球菌培养基、LBS琼脂培养基、BBL培养基和胰胨-亚硫酸盐-环丝氨酸琼脂培养基,于37 ℃培养箱中,厌氧或有氧条件下培养24~48 h,观察菌落形态和生化反应等,对平板上的菌落进行计数并鉴定,计算粪便中肠杆菌、肠球菌、乳杆菌、双歧杆菌及产气荚膜梭菌的活菌数(lg CFU/g)。
1.3.3 小鼠粪便的16S rDNA高通量测序分析
在灌胃植物乳杆菌P-8的30 d后,采集各组小鼠的新鲜粪便作为样品,对小鼠粪便样品进行DNA提取和检测,利用引物515F和806R对细菌16S rRNA的V3~V4区进行扩增,纯化PCR产物,构建小片段文库,基于Illumina NovaSeq测序平台进行高通量测序,利用QIIME对97%的相似水平下聚类而成的操作分类单元(operational taxonomic unit, OTU)进行生物信息统计分析和物种注释分析,样品数据进行均一化处理,获得物种丰度及多样性等数据。
1.3.4 脏器系数和肠道长度测定
灌胃30 d后,将小鼠脱颈处死解剖,之后取出心、肝、脾、肺、肾等脏器称质量,再根据小鼠的体质量,按公式(1)计算脏器系数。测量小肠质量及长度,比较各组小鼠小肠质量和长度的变化。
脏器系数/%=脏器平均质量(g)/平均体质量(g)×100
(1)
1.3.5 抗氧化水平测定
小鼠解剖后取出小肠、肝脏组织,利用试剂盒测定小肠、肝脏组织中T-SOD、MDA、GSH及GSH-Px含量。
1.3.6 炎症因子水平测定
小鼠剪眼球取血后离心,取血清,利用酶标仪和ELISA试剂盒测定IL-1β、IL-6的含量。
1.4 统计学方法
用SPSS 19.0进行显著性分析,采用单因素方差分析(analysis of variance, ANOVA),所有数据均以平均值±标准偏差表示。小鼠粪便细菌计数实验采用独立样本t检验,各组自身前后比较采用成对t检验。P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 植物乳杆菌P-8对小鼠体质量、摄食的影响
如图1所示,实验整个过程中,各组小鼠的体质量缓慢增加,且各组差异不显著(P>0.05),组间摄食、饮水量无显著性差异(P>0.05),表明植物乳杆菌P-8干预对健康小鼠体质量及摄食无影响。
2.2 植物乳杆菌P-8对小鼠脏器系数的影响
对小鼠体质量和脏器系数的影响是评价益生菌安全性的重要指标,其中脏器系数可反映动物内脏的功能状态,一般选用肝、肾、脑、肺、脾、心等主要脏器进行试验。正常时各脏器与体质量的比值相对恒定。当出现感染等异常现象时,受损脏器质量会发生改变。由表1可知,空白组及低、中、高剂量组小鼠各脏器系数不存在显著性差异(P>0.05)。一般来说,脏器系数增大,表示脏器水肿或增生肥大等;脏器系数减小,表示脏器萎缩及其他退行性改变[15]。本研究中并未观察到相关现象,表明灌胃植物乳杆菌P-8对小鼠脏器无不良影响。
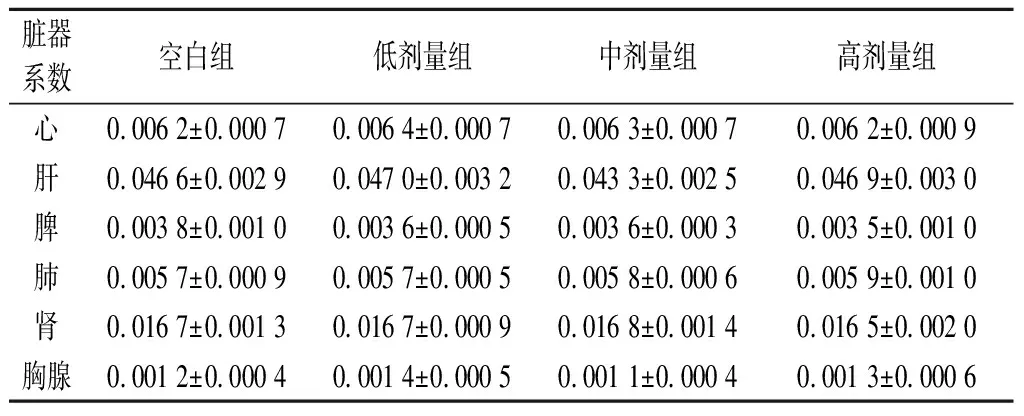
表1 植物乳杆菌P-8对小鼠脏器系数的影响(n=13)Table 1 Effect of L.plantarum P-8 on organ coefficient of mice(n=13)
2.3 植物乳杆菌P-8对小鼠小肠长度和质量的影响
对小鼠的小肠长度和质量进行了测定,该指标反映了小鼠对营养物质的消化吸收能力,与机体的健康状况相关。如图2所示各组间的小肠长度和质量无显著差异。表明灌胃植物乳杆菌P-8对小鼠小肠没有产生影响。
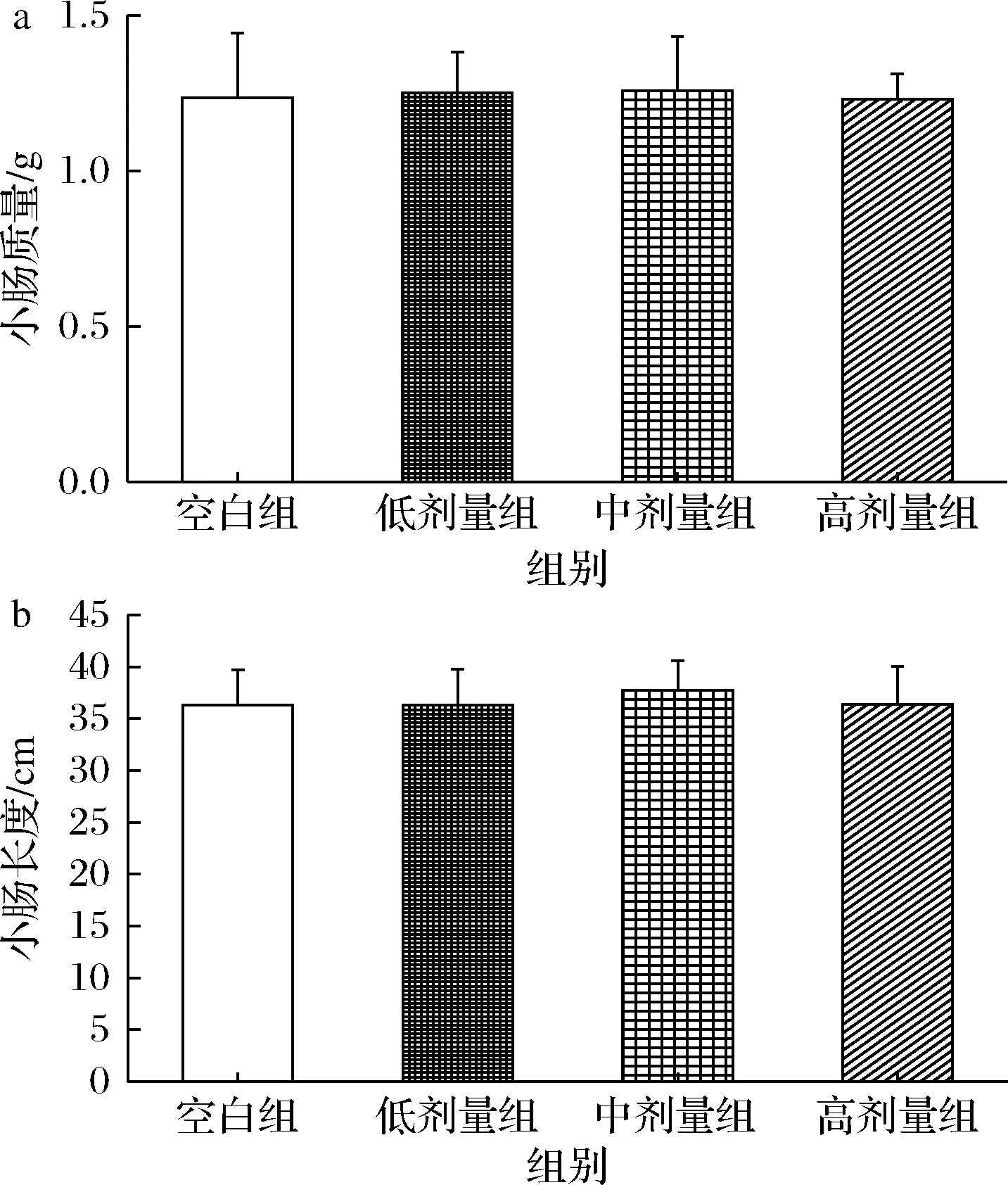
a-小肠质量;b-小肠长度图2 植物乳杆菌P-8对小鼠小肠质量和 长度的影响(n=13)Fig.2 Effect of L.plantarum P-8 on small intestinal in mice(n=13)
2.4 植物乳杆菌P-8对小鼠抗氧化能力和抗炎反应的影响
2.4.1 植物乳杆菌P-8对小鼠小肠、肝脏组织抗氧化能力的影响
SOD、GSH、GSH-Px、MDA是反映机体内氧自由基代谢的主要指标,其中SOD、GSH、GSH-Px可有效地清除氧自由基,从而阻止脂质过氧化。MDA含量与体内脂质过氧化的程度呈正相关,间接地反映细胞受损程度[16]。对各组小鼠小肠及肝脏组织中氧化应激相关指标进行检测,结果如表2所示。
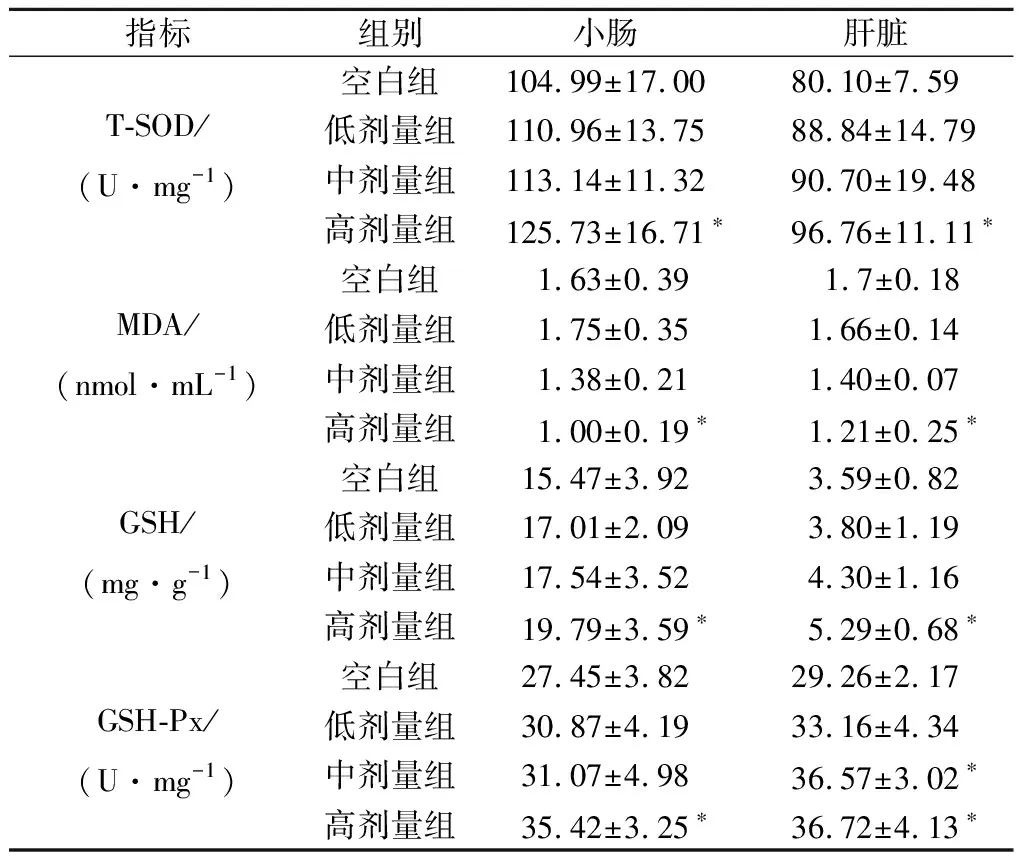
表2 植物乳杆菌P-8对小鼠小肠组织T-SOD、 MDA、GSH和GSH-Px的影响(n=13)Table 2 Effect of L.plantarum P-8 on T-SOD, MDA, GSH and GSH-Px level in small intestine of mice (n=13)
在小肠组织中,与空白组小鼠相比,高剂量组小鼠的GSH水平及GSH-Px、T-SOD活力显著升高(P<0.05);MDA水平显著降低(P<0.05)。在肝脏组织中,与空白组小鼠相比,高剂量组小鼠的GSH水平及GSH-Px、T-SOD活力显著升高(P<0.05),MDA水平显著降低(P<0.05),中剂量组GSH-Px活力显著升高(P<0.05),说明植物乳杆菌P-8能够提高小鼠小肠和肝脏的抗氧化能力,加强小鼠小肠、肝脏内的氧化防御系统功能,帮助机体抵御氧化应激。
2.4.2 植物乳杆菌P-8对小鼠抗炎症反应的影响
IL-1β等促炎因子和炎症反应关系密切,当感染或某些其他疾病出现时,IL-1β能快速被诱导升高,启动免疫功能,引起机体正常组织受损[17]。IL-1β的升高可以通过刺激炎症产生,影响内脏敏感性,引起肠易激综合征[18]。研究表明,在许多癌症中IL-6的表达会升高,如皮肤癌、乳腺癌、肺癌等[19]。对各组小鼠血清中IL-1β和IL-6水平进行分析,如图3所示,与空白组相比,高剂量组血清中IL-1β、IL-6显著降低(P<0.05),说明植物乳杆菌P-8能够有效降低小鼠机体中的炎症因子水平,低水平的IL-1β、IL-6 可提高细胞免疫反应、激活机体防御功能[20]。
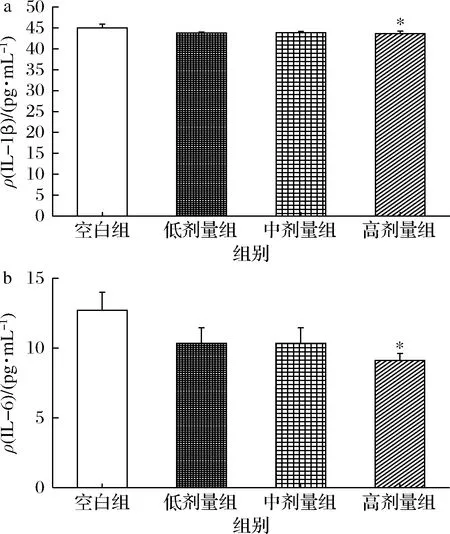
a-IL-1β;b-IL-6图3 植物乳杆菌P-8对小鼠IL-1β和 IL-6的影响(n=13)Fig.3 Effect of IL-2, TNF-α, IL-1β and IL-6 in small intestine of mice by L.plantarum P-8(n=13)
2.5 益生菌对小鼠肠道微生物的影响
2.5.1 植物乳杆菌P-8对常见肠道微生物的影响
由表3可见,灌胃受试物前,空白组及低中高各剂量组的肠杆菌、肠球菌、乳杆菌、双歧杆菌和产气荚膜梭菌菌落总数无显著性差异(P>0.05),灌胃30 d后,空白组和低、中剂量组各类微生物数量与灌胃前相比无显著性差异,而高剂量组与灌胃前相比乳杆菌、双歧杆菌的数量显著增加(P<0.05)。
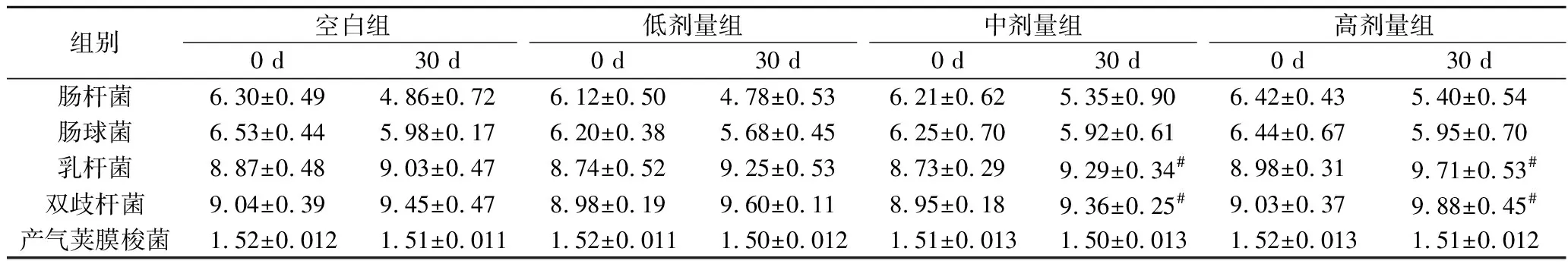
表3 植物乳杆菌P-8对小鼠肠道菌群的影响(n=13) 单位:lg CFU/g
2.5.2 植物乳杆菌P-8对肠道微生物多样性的影响
从门水平上(图4-a)分析物种组成发现,各组主要以拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)为主,空白组中拟杆菌门、厚壁菌门、变形菌门分别占61.76%、27.83%、0.82%,占总序列数的90.42%。与空白组相比,高剂量组中拟杆菌门的丰度下降至44.12%;厚壁菌门和变形菌门的丰度分别上升至45.00%、2.43%。
从属水平上(图4-b)分析物种组成发现,以拟杆菌属(Bacteroides)、Lachnospiraceae_NK4A136_group属、理研菌属(Alistipes)和乳杆菌属(Lactobacillus)为主。
对各组进行差异物种分析(图5),在属水平上,与空白对照相比,低剂量组Lactobacillus的丰度显著增加(P<0.05),中高剂量组Lactobacillus的丰度极显著上升(P<0.01);高剂量组Odoribacter的丰度极显著增加(P<0.01),Muribaculum、芽孢杆菌属(Bacillus)的丰度显著降低(P<0.05)。
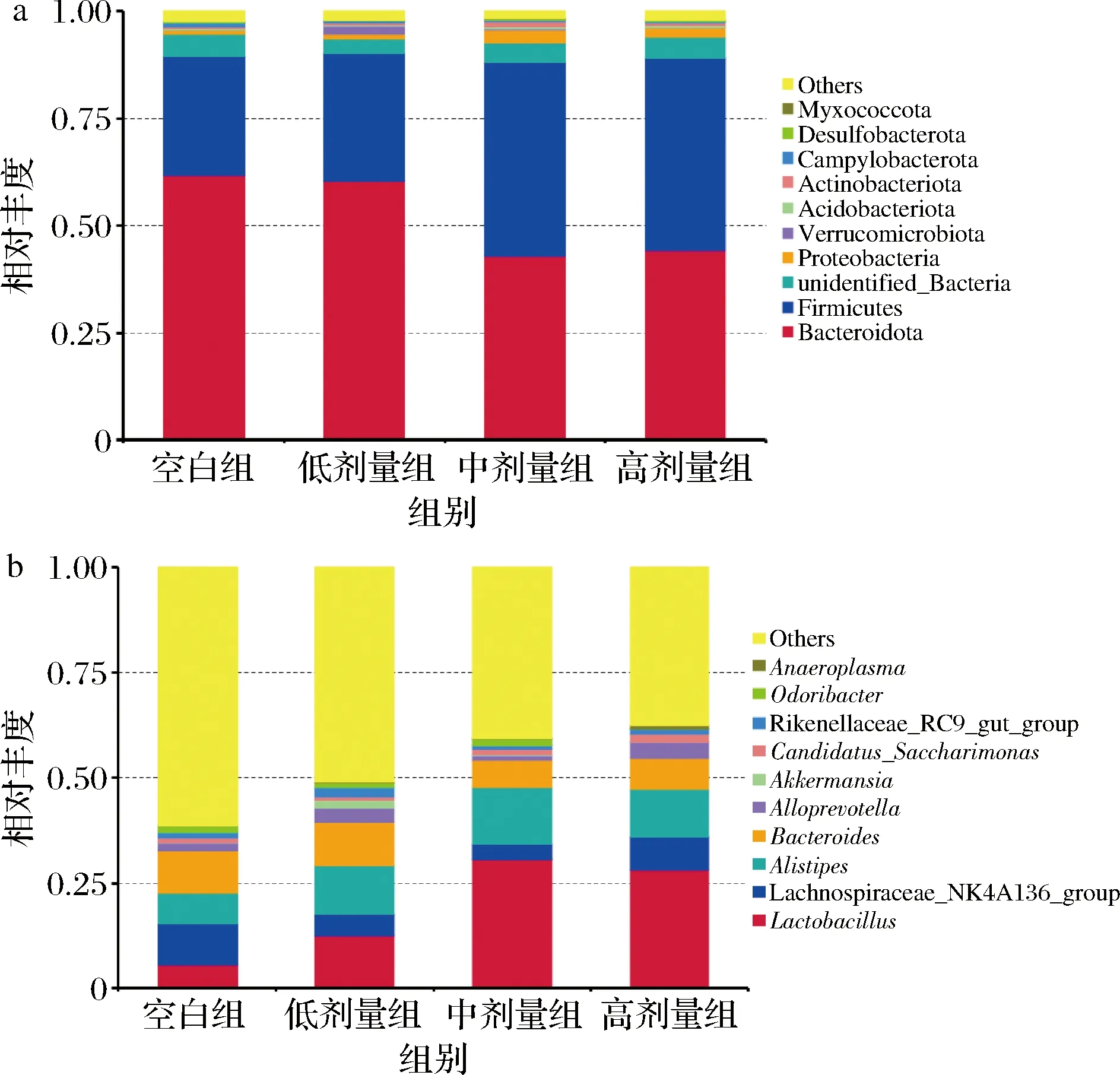
图4 各组小鼠肠道菌群门水平(a)及属 水平(b)的物种丰度图Fig.4 Species abundance at phylum(a) and genus(b) level of intestinal microflora of mice in each group
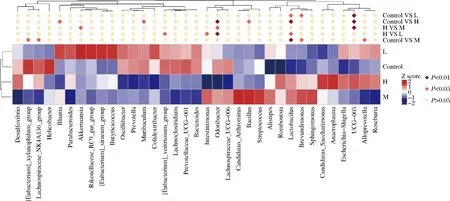
图5 物种相对丰度聚类热图Fig.5 Species abundance from clustering heatmap注:Control-空白组;L-低剂量组;M-中剂量组;H-高剂量组
Lactobacillus具有增强免疫、促进能量代谢、抗炎、调节肠道菌群、降血糖和降血脂等生理活性,其丰度是人体健康的重要指征[21-23]。Lactobacillus在生长代谢过程中,会产生乳酸、醋酸、甲酸、丁酸等代谢产物,这些产物能够降低体系的pH值,抑制其它一些不耐酸的杂菌的生长[24],这是大部分乳酸菌的抑菌机制。Odoribacter是人体肠道微生物中常见的一种产生短链脂肪酸的微生物,其丰度与非酒精性脂肪肝、囊性纤维化和炎症性肠病等疾病的发生负相关,是一种与宿主相互作用的有益共生菌[25]。上述结果表明,植物乳杆菌P-8能在一定程度上调节小鼠肠道菌群组成,增加Lactobacillus、Odoribacter等菌属丰度。
3 结论
本研究探究了植物乳杆菌P-8对健康小鼠肠道菌群、抗氧化能力及炎症水平的影响。结果表明植物乳杆菌P-8可以有效增加小鼠的小肠和肝脏组织中GSH水平及T-SOD、GSH-Px活力,降低MDA水平,降低炎症因子IL-1β、IL-6水平,促进双歧杆菌、乳杆菌类有益菌的生长。植物乳杆菌P-8在调节肠道微生物组成及抗炎抗氧化方面表现出较好的效果,研究结果为揭示植物乳杆菌P-8的益生、保健功能及相关益生菌制剂的开发利用提供依据。
