可基因编码点击化学在材料合成生物学中的应用
2022-09-16易琪昆孙晨博杨中光王日寇松姿李朝霞孙飞
易琪昆,孙晨博,杨中光,王日,寇松姿,李朝霞,孙飞,
(1香港科技大学化学及生物工程学系,中国香港 000000;2深圳湾实验室粤港澳生物医学创新中心,广东 深圳 518000;3盐城工学院海洋与生物工程学院,江苏 盐城 224000)
点击化学的灵感源于自然界生物分子的合成,着眼于化学反应的高效、选择性与模块化。自其问世以来[1],点击化学,以铜催化的叠氮-炔基Husigen环加成反应为代表,发展成为一系列近乎“理想”的化学反应,开辟了以碳-杂原子键(C-XC)合成为基础的组合化学新方法,进而简单高效地获得了结构的多样性。点击化学是颠覆性的[2],重塑了材料学、生物学等诸多领域。然而,当传统的点击化学应用于复杂生物系统时,通常需要对生物分子进行额外的化学修饰,以引入非天然官能团,而这些修饰往往难以在敏感的生物分子或者复杂的生命体系中实现。此外,由于缺乏有效的理性设计与快速的筛选工具,在传统的化学空间里寻找新的点击化学反应是极其困难的。可喜的是,得益于定向进化与理性设计等蛋白质工程的手段,研究者已经能够有效地探索生物分子(如天然氨基酸)序列空间,这为很多现实问题提供了新答案、新工具、新方法,包括寻找新的点击化学。应用蛋白质工程开发新的化学反应目前已在合成生物学中蔚然成风。
近年来革兰氏阳性细菌黏附素中异肽键的发现推动了一系列基于多肽/蛋白质共价反应对的发展[3]。迄今为止,这些新的反应对包括第1代的pilin-C/isopeptag-C和pilin-N/isopeptag-N[4],后来被广泛应用的谍化学[SpyTag/SpyCatcher,图1(a)]及其正交版本SnoopTag/SnoopCatcher,优化后的升级版本Spy002和Spy003[图1(b)][5-9],非共价反应的SpyDock可逆系统[图1(c)][10],以及三组分的反应体系SpyStapler/BDTag/SpyTag[图1(d)][11]。因其特异且极稳定的结合能力,这些反应对也被称为“细菌超能胶”(bacterial superglue)[12-20]。以谍化学为例,这类蛋白质化学的独特之处在于该反应集分子识别和自发的异肽键形成于一体,不仅具有传统点击化学的特征,包括快速的动力学、高产率、等摩尔配比、模块化、化学选择性和单一反应轨迹等,而且超越了其他常见的蛋白分子连接技术(如sortase、split intein等),能够发生在蛋白分子的任意位点(N,C两端或者中间),极大拓展了对蛋白分子的结构控制[21-23]。更重要的是,谍化学的底物完全由天然氨基酸构成,可实现基因编码[21]。由此观之,谍化学是一种近乎理想的蛋白质-多肽反应对,既有点击化学的基本特征又可以在基因层面进行编码。因此,谍化学是一种可基因编码点击化学(genetically encoded click chemistry,GECC)。

图1 可基因编码点击化学(GECC)概览(a)代表性的可基因编码点击化学——谍化学(SpyTag/SpyCatcher chemistry)。伴随着SpyTag与SpyCatcher的特异性的分子识别与结合,天冬氨酸与赖氨酸的侧链自发形成异肽键[5-7]。SpyTag/SpyCatcher复合物结构的PDB编号为4MLI。(b)谍化学及其优化版本(Spy002与Spy003)的二级反应动力学常数[8,9]。(c)无异肽键的SpyTag/SpyDock可逆反应体系[10]。SpyDock为SpyCatcher-E77A突变体,失去了形成异肽键的能力。(d)三组分SpyStapler/SpyTag/BDTag反应体系及其二级反应动力学常数[11]Fig.1 Overview of genetically encoded click chemistry(GECC)(a)SpyChemistry(SpyTag/SpyCatcher Chemistry),a representative GECC.The side chains of aspartic acid and lysine spontaneously form isopeptide bond when SpyTag and SpyCatcher specifically recognize and react with each other[5-7].PDB ID of SpyTag/SpyCatcher complex:4MLI.(b)Second order reaction kinetic constants of SpyChemistry and its optimized systems(Spy002 and Spy003)[8-9].(c)Reversible SpyTag/SpyDock system without isopeptide bond[10].SpyDock is the E77A mutant of SpyCatcher,which loses the ability to form isopeptide bond.(d)Three-component SpyStapler/SpyTag/BDTag reaction system and its second order reaction kinetic constant[11].
伴随着合成生物学的发展,材料学科亦迎来了新机遇。作为合成生物学的一个新的分支,材料合成生物学有望从根本上改变人类对新材料的开发与获取方式。在此过程中,以GECC为代表的新的蛋白质化学已经并将持续为材料合成生物学提供有力的工具[11-12,19,24]。此文将着重阐述GECC在材料合成生物学中的已知应用,并探讨可能的新发展。
1 可基因编码点击化学与蛋白质拓扑工程
与传统化学合成相比,大分子的生物合成有如下优势:①能够对大分子的尺寸、序列及立体化学实现精确控制;②可利用自然进化的成果,引入天然的蛋白质序列,实现生物功能;③可借助定向进化等手段进行优化。然而生物合成并不完美:从拓扑结构上看,中心法则中的3类生物大分子DNA、RNA与蛋白质多是线性大分子。虽然很多RNA与蛋白质可通过折叠形成三维结构,但本质上仍为线性大分子。学术界面临的一个根本问题便是:能否利用生物体系精确地合成非线性的大分子?若能实现这一点,便有望拓展蛋白质工程,发展新的生物材料,并为生物学研究提供新的思路。
天然蛋白质多为线性分子,即氨基酸从N端到C端依次通过肽键连接起来,而不会产生分支、闭环甚至更高等级的复杂拓扑结构。但自然进化仍然产生了少量具有非线性结构的蛋白质分子,比如环形的细菌素AS-48和防御素RTD-1、打结型的甲基转移酶YbeA和泛素羧基末端水解酶UCH-L3、索烃型的二硫化碳水解酶、嗜气杆菌柠檬酸合成酶等等[25-30]。这些拓扑结构对于蛋白质的热稳定性、蛋白酶抗性、机械稳定性等具有重要的意义,因此,通过拓扑工程改变蛋白质性质逐渐成为蛋白质工程的一个新的维度。
一直以来,蛋白质拓扑工程依赖于有限的几种工具,包括内含肽、转肽酶以及蝶豆黏酶等[31-33]。但是这些工具能够实现的拓扑结构极其有限,且转化率和反应速率不高,这大大限制了蛋白质拓扑工程的应用范围。GECC作为一种模块化的快速蛋白质偶联方法,亦可作为蛋白质拓扑工程的工具。近年来,通过GECC构建具有高级拓扑结构蛋白质的研究层出不穷。例如将SpyTag和SpyCatcher对应的基因插入到弹性蛋白ELP(elastin-like polypeptide)的基因中,构建了多种非线性的蛋白分子,包括分支状、H型、环型、蝌蚪型等多种拓扑结构(图2)[34]。Zhang等[21]在此基础上,进一步插入了能够相互交叉形成二聚体的p53结构域,令大肠杆菌表达SpyTagp53-SpyCatcher重组蛋白并在细胞内互相反应,高产率地得到多种具有不同拓扑结构的蛋白质索烃。

图2 蛋白质拓扑结构的控制Fig.2 Controlling the protein topological structures
在构建多种复杂拓扑结构的基础上,蛋白质拓扑工程能够进一步优化蛋白质功能。Howarth等[35]将SpyTag和SpyCatcher分别放置于β-内酰胺酶的N端和C端,通过控制蛋白的表达条件可以直接获得环化的β-内酰胺酶。经过环化,在酶活性几乎不发生改变的同时,β-内酰胺酶能够耐受100℃的高温,相较于野生型的37℃有了显著提升。对于二氢叶酸还原酶、苯丙氨酸脱氢酶、海藻糖合成酶等,SpyTag/SpyCatcher介导的环化有相似的效果[35-37]。除了热稳定性,这种环化策略对于蛋白的化学稳定性、蛋白酶抗性等亦有显著提升。在SpyTag/SpyCatcher和p53介导的蛋白索烃的构建中,研究人员在基因中插入了二氢叶酸还原酶,使得生成的索烃相套两环中各有一个。这样的构造使得酶熔化温度提升了4℃,并将催化效率提升了27%,显著高于线性酶和环化酶,证明了索烃结构对于酶学性质的重要影响[12]。利用相似的策略,Zheng等[38]将工业用耐热γ-lactamase的活性提高了1.8~2.4倍,说明该技术具有很强的实用价值。
综上所述,利用GECC技术,不仅能够方便快捷地创造非天然拓扑形式的功能蛋白,还能借此调节分子的性质,优化其功能。可见,随着GECC工具包的拓展,对于蛋白质多样化拓扑结构的构造与性质研究亦会获得明显助益。
2 可基因编码点击化学与全蛋白水凝胶材料
水凝胶是具有极高含水量的亲水聚合物分子网络,其存在由聚合物链之间的交联作用与分子网络在溶液中的溶解过程所达成的微妙平衡所维持[39-40]。由于可高度模拟天然细胞外基质(extracellular matrix,ECM)的生物物理特性,水凝胶被视为生物大分子和干细胞的理想载体,有着诸多生物医学应用,包括组织工程、干细胞疗法和药物递送等,极具发展前景[41-43]。
化学合成的水凝胶材料虽然易得,但是受限于生物活性的匮乏[43-44]。利用蛋白质来构建具有生物活性的水凝胶有望将生物分子多样性、生物活性与可工程优化(定向进化)等优势充分整合到聚合物学科中[45]。蛋白质的性质(包括其高级结构、稳定性和生物功能)基本由其氨基酸序列决定,因而利用蛋白质构建的水凝胶材料可通过基因编码实现对其生化和机械性能的调控,这一优势令全蛋白水凝胶相较大多数天然和合成生物材料更具有吸引力[46]。
可基因编码点击化学(GECC)无须借助任何化学修饰力量,便可在温和条件下实现蛋白质的共价组装,进而形成稳定的分子网络。基于GECC的共价组装技术相较于其他基于分子的物理相互作用或者酶促反应构建的蛋白水凝胶具有更加稳定高效的优势[33,47]。利用GECC设计蛋白网络可以通过基因编码引入各种天然甚至“从头设计”(de novodesign)的功能蛋白或多肽序列[48],从而实现了将功能从分子层面到宏观材料层面的无损转移[49-56]。
作为蛋白质拓扑工程的一个延伸性应用,Sun等利用GECC合成了具有生物活性的全蛋白分子网络——“谍网络”(spy network)[图3(a)][49],并以此为灵感进一步构建了各类智能响应的全蛋白质水凝胶材料[52]。
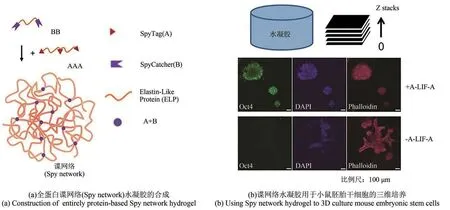
图3 利用GECC构建全蛋白水凝胶材料LIF—白血病抑制因子;A-LIF-A—SpyTag-ELP-LIF-ELP-SpyTagFig.3 Development of entirely protein-based hydrogels based on GECC(Adapted from Ref.49 with permission from National Academy of Sciences,copyright 2014.)LIF—Leukemia inhibitory factor;A-LIF-A—SpyTag-ELP-LIF-LEP-SpyTag
“谍网络”由含有多个GECC反应基团的重组蛋 白 如SpyTag-ELP-SpyTag-ELP-SpyTag(AAA)和SpyCatcher-ELP-SpyCatcher(BB)自组装形成,并且可以通过基因工程引入各种具有生物活性的蛋白序列,包括细胞结合配体Arg-Gly-Asp(RGD),帮助细胞进行对细胞外基质(ECM)重塑的金属蛋白酶(MMP)识别位点,以及用于维持干细胞多能性(pluripotency)的白血病抑制因子(LIF)。Gao等[56]利用相似的原理将一种球状蛋白(GB1)共价交联成分子网络,获得了具有高机械强度的生物相容的水凝胶材料,并用于细胞的3D培养。
GECC还被用于构建智能水凝胶。Wang等[52]利用谍化学组装光响应蛋白CarHC,构建了一类依赖B12的光响应全蛋白水凝胶[图4(a)]。CarH是细菌内控制类胡萝卜素合成的光敏转录调控因子,其C端结构域(CarHC)在黑暗条件下与AdoB12结合并形成四聚体,在绿光下随着AdoB12的光解而分解成单体[57-59]。通过重组蛋白质SpyTag-ELPCarHC-ELP-SpyTag(ACA)和SpyCatcher-ELP-CarHCELP-SpyCatcher(BCB)的等当量混合所得的线性聚合物(溶液),能够在AdoB12诱导下快速组装形成水凝胶(固体),实现液固相变;在光照下,CarHC四聚体解离,继而经历快速的固液相变[52]。Luo等[60-61]则利用了生物体系中普遍存在的钙调蛋白(CaM)与其结合肽(M13)构建钙离子响应的蛋白质水凝胶。在CaM、Ca2+的诱导下,从富含helix的闭合结构变为哑铃状结构,进而与其配体M13结合[62]。受此启发,该研究利用 谍化学将CaM/M13直接组装成了聚合物,成功构建了Ca2+依赖、具有可控黏弹性(viscoelasticity)和应力松弛行为(stress relaxation)的动态水凝胶。Yang等[55]则利用绿色荧光蛋白裂分片段(splitGFP)的自主重构直接在大肠杆菌细胞内合成了一种四臂星状蛋白——(SpyCatcher)4GFP。这一星状蛋白可通过谍化学进一步共价组装成具有规整空间结构的分子网络。
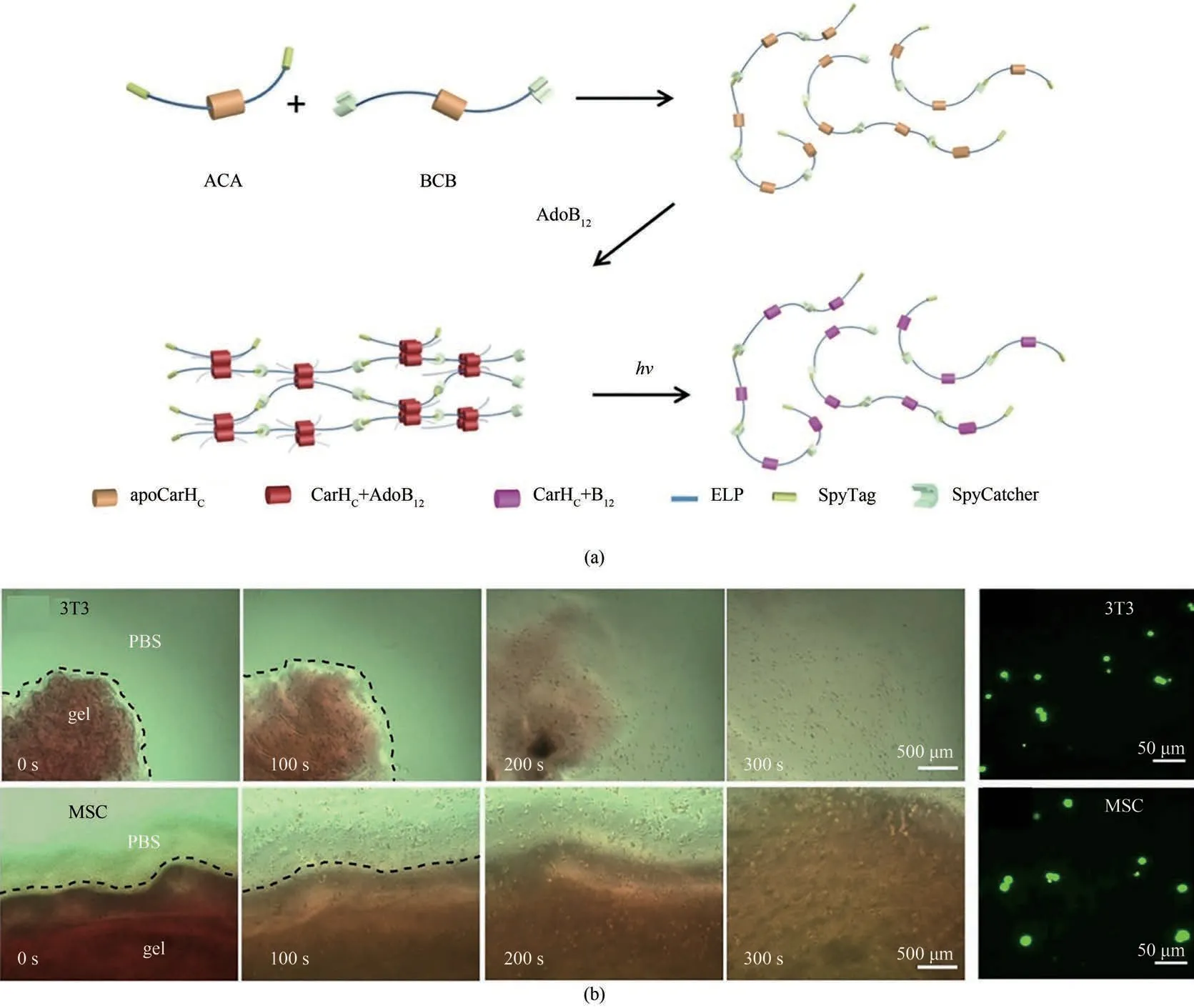
图4 利用GECC制备“智能”光响应水凝胶(a)利用谍化学将CarHc组装成线性聚合物,后者在黑暗条件下经历AdoB12诱导的液固相变与光诱导的固液相变。(b)光诱导的细胞释放。3T3—成纤维细胞;hMSCs—人间充质干细胞。Fig.4 Development of smart photo-responsive hydrogel based on GECC Adapted from Ref.52 with permission from National Academy of Sciences,copyright 2017.(a)Constructing CarHc into linear polymer utilizing SpyChemistry,which can undergo liquid-to-solid phase transition induced by AdoB12,and solid-to-liquid phase transition induced by light.(b)Photo-induced release of 3T3 cells or hMSCs.
由于在可基因编码性(genetic programmability)和生物功能化(biofunctionalization)方面的优势,上述基于GECC的全蛋白水凝胶在细胞三维培养和组织工程等领域中有巨大的应用前景。上文提到的Spy network水凝胶,经过白血病抑制因子(LIF)修饰后,可用于小鼠胚胎干细胞(mESC)的三维培养并且能够维持其多能性[图3(b)][49]。科研人员也利用GECC以成胶后修饰的方式将LIF整合到全蛋白水凝胶中,后者作为激活JAK/STAT3通路的关键细胞因子,可以促进神经元的轴突生长[53,63]。
目前面临细胞三维培养的一个关键挑战便是如何从培养基质中回收并传代细胞。尽管不少水凝胶都可以用于细胞三维培养,却无法实现细胞的有效释放与回收。Wang等[52]合成的CarHC水凝胶在B12的诱导下可以完成快速的液固相变,从而实现对3T3成纤维细胞和人间充质干细胞(hMSCs)的三维封装;在三维培养之后,这些水凝胶可在白光或绿光照射下迅速液化,释放这些细胞,而且释放后的细胞拥有良好的存活率[图4(b)]。该体系是为数不多的能够实现多代细胞三维培养及无害转移的体系。
具有可控药物递送能力的水凝胶,尤其是由具有高时空精度和低侵害特性的光响应水凝胶,在生物医学领域有较高需求[63-64]。Yang等[55]利用GECC合成了四臂星状蛋白(CarHC)4GFP,后者所具备的可控相变行为,包括AdoB12诱导的液固相变和光诱导的固液相变,被用于生物被膜降解酶PslG的封装和光控释放。该体系可以有效抑制细菌生物被膜的形成,有望用来对抗由多重耐药细菌病原体引起的慢性感染。Jiang等[65]以CarHC为基元设计了另外一种可注射的光响应全蛋白水凝胶。研究者利用金属离子(Zn2+/His6-tag的配位以及AdoB12诱导的CarHC四聚这两种反应机理构建水凝胶网络。该体系兼具了可注射(源自物理交联)与光响应(源自CarHC)这两个主要特性。该体系,作为LIF的载体,被注射到小鼠视神经的缺损位置,可以长期激活JAK/STAT3信号传导,并增强轴突再生,验证了其在药物递送和神经再生等领域的应用潜力。
由于其优异的止血与伤口闭合效果,防水生物黏合剂被视为外科手术中传统缝合线和缝合钉的理想替代品[66-67]。常用的生物黏合剂如合成聚合物(例如聚氰基丙烯酸酯[68]和PEG[67])或生物大分子(例如纤维蛋白[69]、明胶[70]或多糖[71])具有降解性差、毒性高、引起炎症和组织坏死可能性高等风险。具有高生物相容性的防水蛋白黏合剂原则上可以规避这些缺陷。自然界的贻贝足蛋白(Mfp)是海洋贻贝(Mytilus edulis)实现水下黏附的主要原因,其分子机制启发了众多涂层和黏合剂材料的开发[72-73]。Sun课题组利用重组抗生素链霉菌酪氨酸酶(Streptomyces antibioticustyrosinase)[74]对重组贻贝足蛋白Mfp3或者具有Mfp序列特征的多肽进行氧化修饰,进而合成了具有水下黏合能力的全蛋白水凝胶[75-76]。这些材料具有强防水黏合和高细胞相容性的特点,同时这些材料含有SpyTag或SpyCatcher等反应基元,因此可以通过GECC以成胶后修饰的形式将具有生物活性的蛋白分子整合到材料之中。
蛋白质材料也为能源与环境问题的解决提供了新的思路。在这个亟需替代能源的时代,核裂变在可预见的将来依然是低碳能源的主要来源。迄今为止,几乎所有的铀燃料都来自陆地开采。然而陆地铀矿储量有限,并非取之不尽,而且当前的采矿工艺对环境的破坏巨大。另一方面,海洋中的铀储量巨大,为陆地储量的1000倍。但海水铀(UO2+2)的绝对浓度极低(约14 nmol/L),加上海水中大量的钙镁及碳酸根离子,使得大规模低成本提取海水铀的设想依旧停留在理论或小规模的试验阶段[77]。自然进化与蛋白质工程技术已经提供了各类特异的金属离子结合蛋白,但是这些蛋白的应用常常受限于稳定性差、成本高、可扩展性差等缺点[78]。将这些蛋白组装成宏观材料可以提高蛋白分子的稳定性,实现重复使用,进而降低成本。Kou等[51]利用GECC将重组超级铀酰结合蛋白(SUP)——一种对铀具有飞摩尔级别结合能力的金属蛋白——及其优化的突变体SUP-E64D[79]共价组装成全蛋白水凝胶材料,并利用微流体装置制造了单分散的SUP水凝胶微珠,成功从海水中提取UO2+2(图5)。类似的分离技术也可以扩展至重金属离子的去除等其他环境问题[80]。Kou等[51]将钼酸盐/铬酸盐结合蛋白ModA共价组装成分子网络,用于去除自来水中的污染物之一——铬酸盐。

图5 利用GECC合成重金属结合蛋白水凝胶(a)超级铀酰吸附蛋白材料与铬酸根吸附蛋白材料的合成。(b)SUP水凝胶与拥有更强铀酰结合能力的突变体SUP(E64D)水凝胶从天然海水中富集铀元素。富集指数是指富集后蛋白材料中铀的浓度与水体中铀的浓度的比值。(c)ModA水凝胶去除自来水样品中的铬酸盐。去除比例是指吸附后水体中铬酸盐的减少比例。去除效率是指蛋白材料吸附铬酸盐的实际质量与理论上最大可能质量的比例Fig.5 Applying GECC to develop heavy-metal binding protein hydrogel Adapted from Ref.51 with permission from The Royal Society of Chemistry,copyright 2017.(a)Synthesis of super uranyl-binding protein(SUP)materials and chromate-binding protein materials.(b)Uranium extraction from seawater using the hydrogels comprising SUP or its mutant,SUP-E64D,which exhibits stronger uranyl binding.Enrichment index was calculated as the ratio of uranium concentration in protien material to that in water body after enrichment.(c)Removal of chromate from tap water using ModA hydrogels.Removal percentage was calculated as the reduced percentage of chromate in water body after removal.Removal efficiency was calculated as the ratio of the actual amount of chromate absorbed by the material to the theoretical maximum by the material.
3 可基因编码点击化学与合成疫苗
疫苗依赖于机体的免疫系统来识别外源蛋白从而产生免疫应答,并通过产生获得性免疫来抵御真正病原体的入侵。100多年来,疫苗的诞生已经拯救了无数生命。但是传统的灭活或者减毒活疫苗在生物安全性上依旧不够完美,而且其研发与生产工艺较为缓慢。随着气候变化、生态变迁、人口增长,人类面临越来越多的大流行疾病的威胁。考虑到病原体的进化速度之快,人类必须能够迅速开发出更加高效安全的新型疫苗。相比于传统的灭活或者减毒活疫苗,由高度纯化的抗原蛋白基元合成的现代疫苗更加安全,但是其诱导保护性免疫的效果较低[81-82]。为了提高合成疫苗的保护效果,研究者致力于发展相对安全的类病毒颗粒(virus-like particle,VLP),后者表面可以有效结合并有序展示相应的抗原,以模拟病原体、提高免疫原性[83-84]。一些病毒或非病毒来源的天然蛋白或者人工设计的蛋白分子可自组装成纳米颗粒,且具有高度对称性与稳定性,直径为10~150 nm,适合作为类病毒疫苗载体[18]。而如何在这些纳米颗粒表面以可控且可靠的方式连接抗原蛋白便成了一大技术难点。利用传统重组DNA技术直接合成融合蛋白可能会影响抗原蛋白的折叠或者VLP有效组装[85]。另一种途径便是以天然的或工程化的蛋白质纳米颗粒作为支架,将异源表达的抗原通过GECC等蛋白共价组装技术添加到蛋白质纳米颗粒上。这种模块化的策略可作为一个强大的合成疫苗“工具包”,实现含有多种单抗原甚至组合抗原的VLP的设计与合成。
首先针对疟疾的疫苗研发,Brune等[86]利用大肠杆菌表达了一类重组噬菌体蛋白,后者可自组装形成类病毒颗粒(VLP)。研究者进一步利用谍化学将疟疾抗原蛋白共价连接到VLP表面,并证明了这些修饰后的类病毒颗粒经一次注射后便可以有效诱导小鼠的抗体响应,显示了这种简单、高效、模块化的疫苗合成策略的可行性[87-90]。Brune等[91]还同时利用两种正交的GECC反应对SpyTag/SpyCatcher和SnoopTag/SnoopCatcher将 多抗原与VLP进行连接。同时展示两种疟疾抗原Pfs25和Pfs2可以增强小鼠体内抗体响应,效果好于单一抗原体系。这种基于GECC的多抗原展示平台有望为抗击疟疾和其他传染性疾病提供有力武器[图6(a)]。最近,纯理性设计的基于Mi3的多孔十二面体蛋白质纳米颗粒[92]也被应用于合成疫苗的设计,Brune等将SpyCatcher展示于纳米颗粒表面,并通过谍化学与抗原蛋白连接[图6(b)],结果证实该种完全计算设计的蛋白质纳米颗粒疫苗亦能引起较强的抗体响应。计算设计出的形成纳米笼的蛋白(包括Mi3)通常在组成、结构和折叠方式方面会有所不同,继而会影响其表面所展示抗原的空间位置、方向与数量,而这些因素会共同影响合成疫苗的免疫原性,因此疫苗的设计与优化需要考虑这些因素[93]。
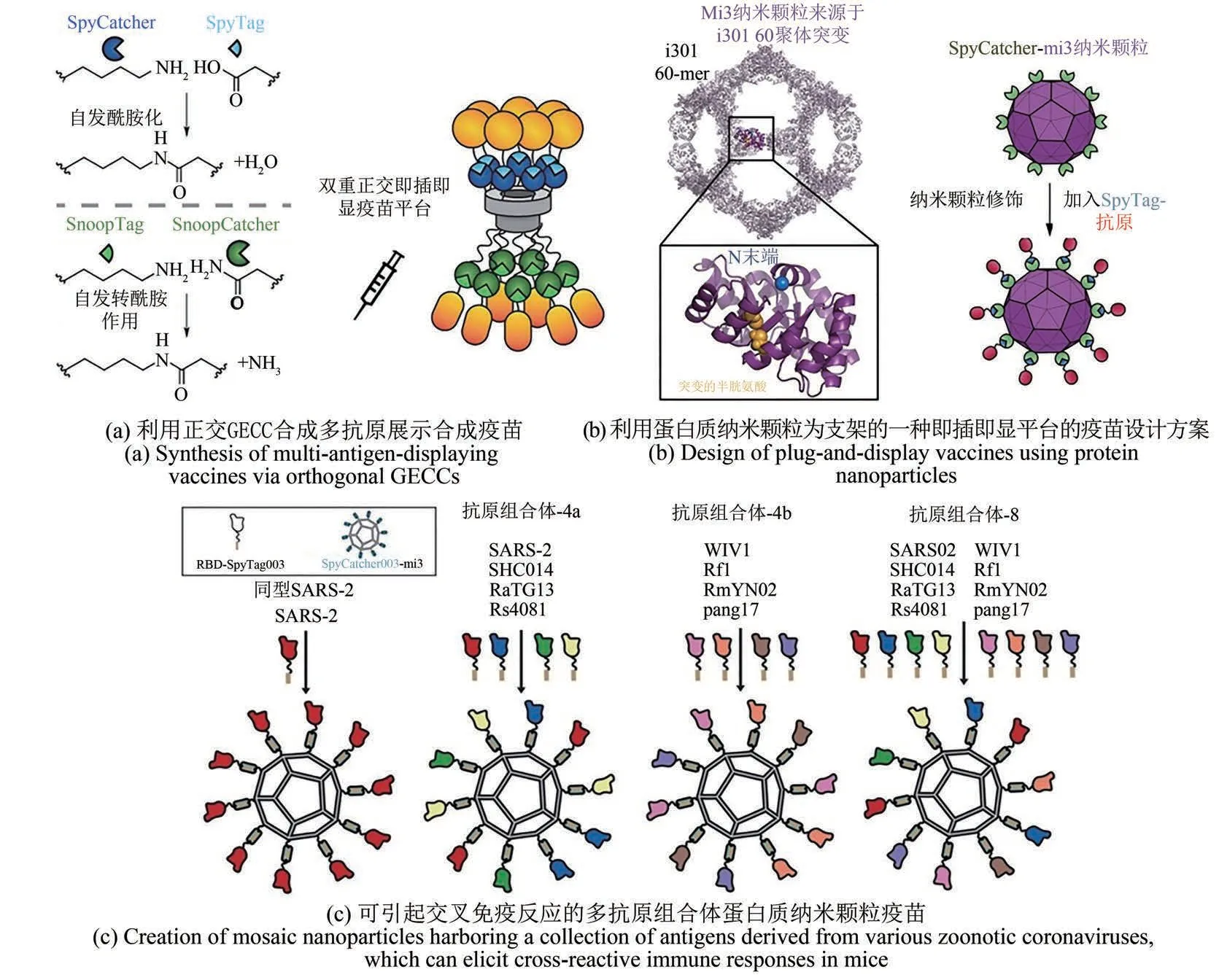
图6 GECC在重组蛋白质疫苗中的应用Fig.6 Application of GECC in recombinant protein vaccines Adapted from Ref.91,92 and 98 with permissions.
利用肿瘤新生抗原发展个体化治疗性疫苗是肿瘤免疫疗法的重要方向之一。而相关疫苗设计的关键在于快速鉴别获取新抗原并实现在疫苗颗粒表面的有效展示。Wang等[94]利用铁蛋白(ferritin)纳米颗粒来作为肿瘤抗原的载体,其表面通过GECC得以展示特异性肿瘤抗原。修饰后的铁蛋白纳米颗粒可迅速被淋巴结并靶向树突状细胞识别,进而产生特异的免疫T细胞响应。该成果展示了基于GECC的合成疫苗平台在个性化肿瘤免疫疗法这一领域的巨大潜力。
始于2019年末的新型冠状病毒(SARS-CoV-2)已造成席卷全球的疫情大流行,各类疫苗包括全蛋白的合成疫苗已成为人类应对这场公共健康危机的有力武器。目前已有不少基于GECC的新冠疫苗的设计与研究,在此做一些简单的总结。
利用GECC可以实现快速多样的疫苗设计与合成,以应对SARS-CoV2的不断突变。天然的二氧四氢蝶啶合酶(lumazine synthase,LuS)和铁蛋白ferritin可分别自组装成60聚体和24聚体的纳米颗粒[95],Zhang等利用此特点,构建了带有SpyTag的LuS和ferritin纳米颗粒。这些纳米颗粒进一步与融合了SpyCatcher的SARS-CoV-2抗原——刺突糖蛋白受体结合区域(spike glycoprotein RBD)——共价结合。最终生成的全蛋白合成疫苗在体内能够引起非常强的中和抗体反应,为对照组(未经修饰的S蛋白)的约25倍。Kang等[96]则利用谍化学同时构建了3类蛋白质纳米颗粒候选疫苗,包括RBD-ferritin(24聚体)、RBD-Mi3(60聚体)和RBD-I53-50(120聚体)。研究结果显示所得这些设计在小鼠体内引起的中和抗体活性比单体RBD高8~120倍,而且所产生的小鼠血清在体外能有效阻断RBD与人体细胞表面受体ACE2的结合。Ma等[97]开发了另一类合成疫苗。他们通过谍化学将SARS-CoV-2的受体结合区域(RBD)和七肽重复区(HR)连接到了铁蛋白纳米颗粒上。接种此疫苗后,感染了SARS-CoV-2的转基因小鼠的肺部病毒载量显著降低。整合了RBD或RBD-HR的疫苗在小鼠上同时引起了中和抗体响应与较强的T细胞免疫响应。RBD-HR疫苗更是引起了针对其他冠状病毒的交叉免疫响应。基于恒河猴的活体实验进一步证实此种疫苗产生持续(3个月以上)免疫响应的能力(包括中和抗体响应与T细胞响应等)。这些结果进一步证实了GECC是实现快速多样的构建疫苗的有效工具。除了当前的SARSCoV2,自然界冠状病毒的种类纷繁,宿主多样,因而人类必将持续面对这类病毒的威胁。理想的疫苗应当能够保护人体免于多种冠状病毒的侵染。Cohen等[98]利用GECC将多种冠状病毒(包括SARS-CoV-2和一些寄生于动物的β-冠状病毒)的RBD连接到Mi3蛋白纳米颗粒上,构建了原则上可以针对数种冠状病毒的普适疫苗。这类多抗原的组合疫苗在小鼠体内产生的抗体响应可识别多种异源RBD,中和抗体效应也有所增强。该方法表明这种含多抗原的组合体合成疫苗策略有望应对现有的和潜在的冠状病毒对公共健康的威胁[图6(c)]。值得注意的是,该课题组[99]用类似的方法将8种来自流感病毒的血球凝集素蛋白(hemagglutinin,HA)整合到疫苗颗粒表面,所产生的多抗原组合体相较于同抗原纳米颗粒的混合物并不能更有效地引起免疫反应,这结果表明多抗原组合体疫苗的设计策略的普适性还需进一步提高。
新冠疫情的全球蔓延为疫苗的贮存运输分配带来了巨大挑战,尤其是在发展中国家、基础设施薄弱及偏远地区,这对疫苗的稳定性及可靠度提出了新的要求。Tan等[100-101]利用了第3代谍化学Spy003在Mi3蛋白纳米颗粒表面实现了对不同对称性的抗原(包括S蛋白RBD)的展示。所产生的蛋白纳米颗粒显示了更特异的免疫原性,而且耐高温、抗冻,有望在实际应用中可减少对冷链的依赖。
4 可基因编码点击化学与工程活体材料
自然界中的生命体能够通过基因编码的方式发展出多种不同尺度、不同功能的生物复合材料,例如木质纤维、贝壳、肌肉组织,这类材料能帮助生命体适应外部环境的变化,并对外界刺激做出响应,同时往往还具有自我修复的能力。受此启发,“工程活体材料”(engineered living material,ELM)这一概念被提出,并在近年有了广泛的研究发展。在工程活体材料中,活体细胞(如细菌、真菌、哺乳动物细胞)作为主体,通过产生不同类型的生物大分子聚合物(如蛋白质、纤维素),或者通过与外加的高分子、微粒或其他骨架反应,自组装形成更大规模的材料[102-105]。相较于传统材料,工程活体材料不仅能人为机械控制其组装过程和材料的拓扑形态,还能通过活体细胞基因表达这一高稳健性的方式进行自我调节;同样的通过基因编辑的方式,工程活体材料能对特定的外界刺激进行动态响应,或表现出特定的生物功能;活体细胞的存在也给予了工程活体材料自我修复、自我生长的特性[图7(a)][102,106]。基于这些特点,工程活体材料在生物传感、生物催化、药物释放等领域均有建树[107-109]。
GECC因其高共价键强度、高效率、高度特异性,在工程活体材料的发展中被广泛运用。大肠杆菌curli生物被膜是一种常见的工程活体材料,主要通过基因工程使大肠杆菌分泌淀粉样蛋白CsgA,并以此为基元互相连接形成,一般通过对CsgA蛋白的修饰来改变材料的性能。然而,研究表明CsgA蛋白与大于260个氨基酸的蛋白融合表达会严重影响生物被膜的形成[110]。Joshi等[111-112]将SpyTag基因插入淀粉样蛋白CsgA基因中,使SpyTag在不影响CsgA蛋白功能的前提下融合,并共表达在生物被膜上,同时将SpyCatcher与功能蛋白融合,再利用这一特异性点击反应,将功能蛋白固定在生物被膜上,通过基因编辑的方式成功实现了对生物被膜的功能控制,并将多种酶固定在生物薄膜上以用于生物催化[图7(b)]。Chen等[113]则在此基础上将SpyCatcher与金纳米颗粒或量子点融合,制作出具有良好导电效应的生物被膜纳米电子元件。利用GECC对生物被膜进行功能化修饰已经成为一种普适的方法。
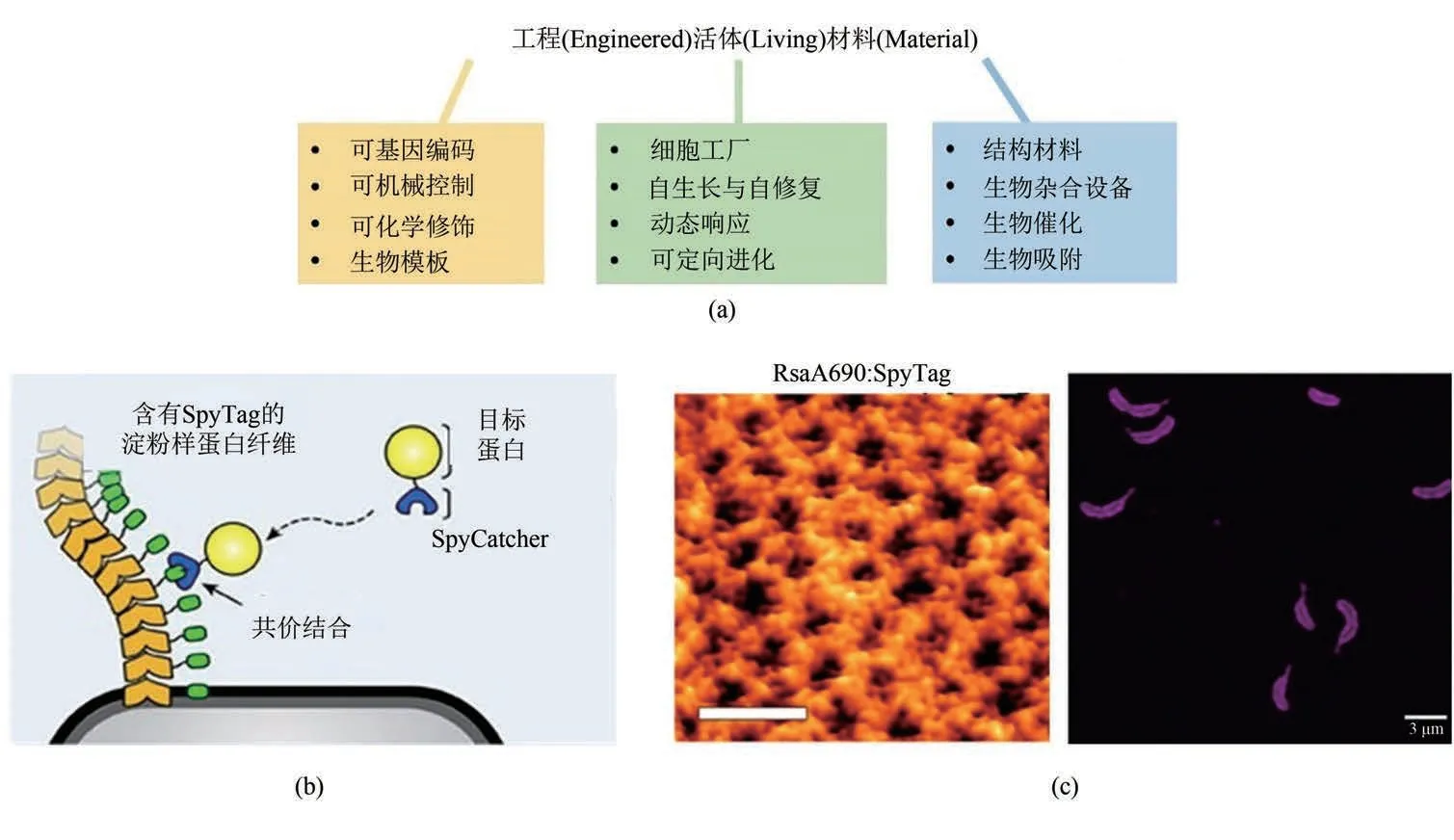
图7 GECC与工程活体材料(a)工程活体材料的特点[102]。(b)利用GECC修饰大肠杆菌生物被膜[111]。(c)利用GECC修饰新月柄杆菌表层蛋白晶格。左图:原子力显微镜下修饰有SpyTag的新月柄杆菌表层蛋白晶格结构,比例尺40 nm;右图:用SpyCatcher-mRFP1荧光蛋白特异性标记的含SpyTag的新月柄杆菌材料,比例尺3 μm[114]Fig.7 GECC and engineered living materials(a)Features of engineered living materials.(b)Decoration of E.coli biofilm via GECC.(c)Decoration of 2D hexameric protein lattice(S-layer)on the surface of C.crescentus via GECC.Left:SpyTagged S-layer visualized by AFM.Scale bar:40 nm.Right:the C.crescentus material labelled with SpyCatcher-mRFP1 imaged via fluorescence microscopy.Scale bar:3 μm.
新月柄杆菌(Caulobacter crescentus)的表层是由RsaA蛋白组成的高度有序二维晶格结构,每个细菌表面约有450 000个晶胞,加之其相较大肠杆菌的低内毒素水平和致病性,是一种潜在的高密度生物功能材料基底。Charrier等[114]通过基因编辑,将SpyTag插入到RsaA中,使其展示在新月柄杆菌的表面,再利用GECC对其进行功能化修饰,从而制成了一种具有二维高度有序结构的工程活体材料。这种材料可被含有SpyCatcher的荧光蛋白特异性标记[图7(c)]。此外,他们还发现通过将SpyTag插入到RsaA蛋白的不同位点,得到的细菌与SpyCatcher的反应率不同,由此可以证明该材料的功能化程度可以通过基因控制的方法实现。
在此基础上,Orozco-Hidalgo等[115]发展出了一种可自组装并自封装的工程活体材料。他们通过基因编辑改造了一种新月柄杆菌,使其表达并分泌与SpyCatcher融合的ELP蛋白,产率高达60 mg/L,再将这种杆菌与表面有SpyTag的杆菌混合,SpyCacher-ELP蛋白会与SpyTag反应形成三维网状结构,最终形成黏附在杆菌外表面的水凝胶,并将杆菌封装在其中。这种合成的细胞外基质不仅具有极高的表达效率和良好的机械强度,同时能通过GECC对其进一步功能化。
传统的生物制造工业往往只能进行大批量生产,且需要多种复杂的设备协作,在物流、技术人员等方面也有各种限制。为了弥补这些不足,Dai等[116]发展了一种基于刺激相应的细胞-材料反馈的通用的生物制造技术,他们将基因编辑过的可产生目的产物的大肠杆菌包裹在天然壳聚糖胶囊中进行培养,当大肠杆菌在胶囊中的局部浓度足够高时,它们会自动发生局部自裂解,释放目的小分子或蛋白;培养过程中的环境变化会导致胶囊体积改变,产生挤压效应,促进目的产物转运到胶囊外部,而大肠杆菌仍留在内部;最后,通过补充营养物质,能重置胶囊内部环境条件,使大肠杆菌数量恢复[图8(a)]。通过这种思路,构建了一种用于生产的微生物群机器人平台,是一种可以模块化的工程活体材料。用这种方法合成酶可以直接与后续的模块一起,流水线化进行定量的酶活性检测。他们以修饰有SpyTag的mCherry和融合了SpyCatcher的GFP为例,令平台同时生产这两种蛋白,随着蛋白被排出胶囊,进入监测单元,两种荧光蛋白会因点击化学而相互结合,产生荧光共振能量转移信号(FRET),而在监测单元中被定量测定其活性[图8(b)]。

图8 基于GECC的智能化平台Fig.8 Smart production platform enabled by GECC.
基于这种工程活体材料,他们发展了一种新的互穿插的聚合物网络结构[117]。通过基因编辑让上述大肠杆菌表达含有多个SpyTag或SpyCatcher的类弹性蛋白多肽(elastin-like protein,ELP),以此作为单体;将两种大肠杆菌在高聚物胶囊中共同培养,随着大肠杆菌的自裂解,两种单体释放到胶囊中,通过点击化学反应自组装成穿插在胶囊内的高分子网状结构[图8(c)]。这种工程活体材料有更强的机械性能,且可以通过基因编辑在ELP上融合更多功能蛋白,赋予其更多功能。通过将β-内酰胺酶加入体系中,这种胶囊可以帮助降解小鼠肠胃内积累的多余的内酰胺抗生素,减少使用内酰胺时对肠道微生物群的扰动。
直接以GECC连接细胞的方式构筑工程活体材料的研究也有所进展。Kozlowski等[118]通过基因编辑,在大肠杆菌表面分别表达了SpyTag和SpyCatcher蛋白,再将这两种细菌混合,通过点击反应使其自然相互结合、聚集成网状结构材料[图9(a)]。通过让大肠杆菌同时在体内表达不同的荧光蛋白,可以对这两种大肠杆菌在聚集体中的分布进行准确的定位。而通过控制两种大肠杆菌的混合比例及顺序,可以合成壳层结构的聚集体[图9(b)]。作者推测形成的聚集体大小与大肠杆菌表面表达的蛋白数量有关,于是通过基因编辑减少了近4倍的蛋白表达并通过免疫染色等方法验证,随后用这些新编码过的大肠杆菌自组装成聚集体,发现聚集体的体积减少了近1个数量级,证明可以通过控制蛋白表达的方式对聚集体的大小进行控制。最后,通过引入哈维弧菌(Vibrio harveyi)的群聚感应系统LuxR-LuxI到这种工程化大肠杆菌中,该系统能够被自诱导剂AHL激活进而表达特定基因,此处他们选择mWasabi荧光蛋白作为报告基因[图9(c)]。研究者们认为这种通过点击化学形成的聚集体能够使得自诱导剂AHL的局部浓度增加,进而不断地激活这个系统,促使细菌产生群聚感应效应,最终整个聚集体产生绿色荧光;而作为对照,当未表达SpyTag/SpyCatcher的大肠杆菌与外源性AHL混合时,仅少量细菌会产生荧光;该实验证明这种材料能产生群聚感应效应,能自我调节基因表达。这种基于GECC的新型工程活体材料优点众多,尤其是其群聚感应特性,在全细胞生物催化等领域颇具潜力,而这种构建方法和思路也能推广开来,用于发展基于其他微生物的工程活体材料。
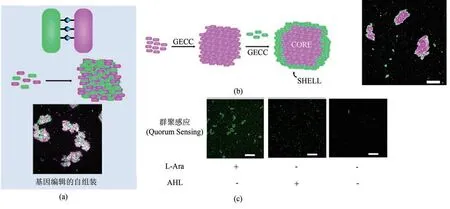
图9 基于GECC自组装的大肠杆菌活体材料及其特点(a)基于GECC自组装的大肠杆菌活体材料示意图[118]。(b)自组装形成的壳层结构工程活体材料,比例尺100 μm。(c)基于SpyTag/SpyCatcher的组装能够激活细菌的群聚感应。AHL—N-Acyl-Homoserine Lactone,群聚感应(quorum sensing)的自诱导剂。群聚感应的报告基因为绿色荧光蛋白mWasabi。阿拉伯糖(L-Arabinose或者L-Ara)用于诱导SpyTag/SpyCatcher的表达。比例尺100 μmFig.9 GECC-based self-assembled E.coli living material and its features(a)Diagram of GECC-based self-assembled E.coli living material[118].(b)Self-assembled engineered living materials with core-shell structure,scale bar:100 μm.(c)Intercellular assembly enabled by Spy chemistry activates quorum sensing.AHL,N-Acyl-Homoserine Lactone,an autoinducer of quorum sening.The green fluorescent protein,mWasabi,served as a reporter of quorum sensing.L-Arabinose(L-Ara)was used to induce the expression of SpyTag and SpyCatcher.Scale bar:100 μm.
5 展望与结论
尽管GECC在合成生物学领域已经初露锋芒,我们也需承认目前的GECC工具存在的不足。在诸如有机溶剂等变性环境下,蛋白质间的点击反应将无法发生——不过目前GECC的主要应用领域均要求有高生物相容性,这一缺点暂可不计。在蛋白质拓扑工程的实践中,研究者们发现目前的GECC反应效率略有不足(60%~90%),这一策略的动力学特性仍待优化[23]。此外,有研究显示SpyTag/SpyCatcher在细胞内进行反应时,反应程度通常会因为低效率而难以完全,这一问题可能需要优化过的反应对如SpyTag003/SpyCather003来解决[119]。此外,还可以通过蛋白质工程进一步在反应多样性、反应程度和与其他工具相结合的能力方面拓展和优化。因此,蛋白质工程的相关研究和发展,包括从自然界中发现更多GECC基序以及赋予GECC更多的特征,都有助于解决现有的困境。
GECC问世至今已迭代出多种不同的版本,我们也期待这一工具包的进一步拓展。原则上,基于异肽键的蛋白质化学只是其中一种方式,而GECC并不局限于此——任何高效特异的具有“点击”特征的蛋白质或多肽的连接化学都将丰富这一概念。鉴于目前GECC多是基于自发形成异肽键的单一化学反应模式,而且缺乏信号响应等控制手段,Yang等[120]通过拆分B12/光响应蛋白CarHC,构建了一套全新的类GECC的蛋白质化学,实现了小分子B12和光诱导的高效特异的蛋白连接。其产物亦因双组氨酸/钴离子(Bis-His/Co)的络合作用而极其稳定。研究者进而合成了一系列智能响应的蛋白质水凝胶材料,展示了其在材料合成生物学中的应用。这种全新的蛋白质化学拓展了已有的GECC的设计范式,可作为GECC的一个重要补充。
从广义的合成化学角度来看,GECC可视为一种“信息编码的化学反应”。有关其化学反应性的信息完全编码在反应组分的序列中,通过链折叠和分子识别读出,并通过自催化转化为化学键。它代表了一种通过改变信息或特定序列来调整化学反应性的独特方法。如果有关化学结构的信息可以以简单直接的方式表示,我们认为这种反应控制模式可以扩展到更广泛意义上的合成分子。例如,我们推测主客体化学(host-guest chemistry)和自催化键形成的结合可能会导致一种新的超分子相互作用模式,其中二级相互作用和化学键能够相互加强[23],而这种相互作用模式能催生出更多具有全新性质的材料。
拥有高特异性、强稳定性、快反应速率、可编码等特性,可基因编码点击化学(GECC)已经成为材料合成生物学的一个重要工具。大量基于GECC的合成生物学材料被设计发展并得到应用,以一种全新的体系为人类应对健康、能源、环境等领域的重大挑战提供了新的思路。其中,利用GECC设计的重组疫苗更是为解决新冠肺炎疫情这一紧急公共卫生事件添砖加瓦。在可预见的将来,强大的蛋白质工程手段如定向进化与理性设计等必将会生成更多的“完美”的蛋白质化学与生物组装策略,继而助力材料合成生物学以解决关乎国计民生的重大应用问题。
