577nm微脉冲激光治疗慢性中心性浆液性脉络膜视网膜病变
2022-09-16张少华申亚贤杨梦娜
张少华,张 超,申亚贤,王 倩,杨梦娜
作者单位:(710016)中国陕西省西安市,西安大兴医院眼科
0引言
中心性浆液性脉络膜视网膜病变(central serous chorioretinopathy, CSC)是临床常见眼底疾病之一,属肥厚型脉络膜谱系疾病,其典型的临床特征为黄斑区浆液性视网膜神经上皮脱离和/或视网膜色素上皮层(retinal pigment epithelium, RPE)脱离,主要临床症状包括视物变形、变暗或者视力下降[1-2],其形成机制尚不清楚。CSC在39~51岁中年人群中高发。其中,男性发病率为9.9/10万、女性发病率为1.7/10万[3]。对于首次发作的急性CSC而言,患者视网膜下液通常可自行消退,患眼视力也可在3mo恢复[4]。但对于部分慢性CSC而言,即病程超过3mo的患者[5],由于患眼视网膜下液持续存在或病情反复发作,可导致永久性RPE和光感受器萎缩,使患眼对比敏感度以及中心视力永久受损[6]。此外,约2%慢性CSC可继发脉络膜新生血管(choroidal neovascularization, CNV)、囊样黄斑变性、视网膜下纤维化以及脉络膜萎缩等病理性改变[7]。目前,针对CSC的治疗主要为对症治疗[8]。如荧光眼底血管造影(fluorescein fundus angiography, FFA)引导的局灶性视网膜激光光凝一直是急性CSC的一线治疗方案。激光光凝可刺激RPE细胞增殖继而使得渗漏部位的RPE封闭或改善RPE的“泵”功能。但激光光凝可导致RPE及对应部位视网膜神经上皮永久受损,甚至继发医源性CNV,且不适用于慢性CSC的治疗[8]。而吲哚菁绿血管造影(indocyanine green angiography, ICGA)引导的光动力疗法(photodynamic therapy, PDT)虽然可降低脉络膜血管通透性,促进视网膜下液吸收,但治疗的经济性不佳,且PDT涉及的光敏剂维替泊芬及690nm激光器在眼科临床应用范围较窄,这些因素限制了PDT在治疗慢性CSC领域的开展[8]。577nm阈下微脉冲激光(SML)为短促、高频的重复脉冲激光,在治疗过程中不伴有视网膜热损伤,可用于黄斑区疾病的治疗[9]。为了探讨SML治疗慢性CSC的有效性和安全性,我们对一组慢性CSC患者进行了治疗,并对治疗结果进行了分析和探讨。
1对象和方法
1.1对象前瞻性单臂病例研究。选取2019-10/2021-10在我院确诊为慢性CSC的24例32眼患者纳入本研究。纳入标准:(1)年龄18~65岁;(2)CSC病程大于3mo;(3)FFA检查提示RPE有荧光素渗漏灶以及光学相干断层扫描(optical coherence tomography, OCT)检查显示视网膜下液,且累及黄斑中心凹;(4)患眼未接受过PDT、眼内抗血管内皮生长因子(vascular endothelial growth factor, VEGF)注射以及视网膜激光光凝治疗;(5)无系统性疾病如糖尿病、高血压以及眼部外伤史;(6)无全身糖皮质激素治疗史;(7)已签署知情同意书。排除标准:(1)合并糖尿病视网膜病变、黄斑前膜、视网膜静脉阻塞、葡萄膜炎、年龄相关性黄斑变性等视网膜疾病;(2)除CSC以外的肥厚性脉络膜病变[2];(3)既往接受过其他激光治疗。本研究通过西安大兴医院伦理委员会审核批准,研究过程符合《赫尔辛基宣言》。
1.2方法
1.2.1SML治疗方案使用Supra Scan 577眼底多点扫描激光治疗仪对患者进行SML。治疗前使用复方托吡卡胺滴眼液散大患眼瞳孔,向患眼结膜囊内滴盐酸奥布卡因滴眼液行眼球表面麻醉,将Ocular三面通用激光镜(型号:OG3MA-13)置于患眼角膜前。选择光斑直径为160μm、曝光时间设置为0.2s,设置初始激光功率为500mW,将激光斑聚焦于鼻侧后极部视网膜,逐渐上调激光功率直至视网膜光凝部位出现浅灰白色激光斑时即达到能量阈值。将此时设置的激光功率减少50%,即为SML治疗功率,将占空比设置为5%[10]。针对FFA图像上显示的RPE渗漏区域及周围由同一位眼底病专科医师仔细定位渗漏位置后对渗漏点及其外周约100μm的视网膜进行零间距覆盖性微脉冲光凝。SML治疗后3mo,若FFA检查发现患眼仍有RPE荧光素渗漏,则对该患眼进行重复SML治疗。
1.2.2随访时间及检查项目SML治疗后嘱患者每月随访共计6mo。每月随访时检查患者双眼最佳矫正视力(best corrected visual acuity, BCVA,LogMAR)、眼压、裂隙灯显微镜下眼前节检查、眼底彩色照像以及OCT,于SML治疗后1、3、6mo行FFA。
1.2.3OCT检查由同一位医师操作OCT检查仪(Spectralis OCT)进行检查,除对黄斑区进行常规线状扫描外,用黄斑厚度地图(Macular Cube)模式(分辨率:3.9μm×6μm)自动获得自内界膜至RPE间的黄斑中心凹视网膜厚度(central retinal thickness, CRT)。
统计学分析:采用SPSS23.0软件对获得的数据进行统计学分析。对患眼经SML治疗前后BCVA及CRT的比较采用重复测量数据的单因素方差分析,进一步行两两比较采用LSD-t检验。P<0.05表示差异具有统计学意义。
2结果
共有24例32眼慢性CSC患者符合入组标准,接受了SML治疗且完成了为期6mo的研究访视。患者年龄41.34±10.09(30~55)岁。病程3~9(平均4.94±3.68)mo。
2.1SML治疗慢性CSC前后视网膜下液及RPE渗漏情况SML治疗1mo时,慢性CSC 32眼中有21眼(66%)已无视网膜下液,在OCT图像上表现为视网膜神经上皮与RPE已完全贴附,且FFA显示该患眼RPE无荧光素渗漏。另有11眼(34%)仍存在视网膜下液,其中5眼(16%)仍存在RPE荧光素渗漏。
SML治疗3mo时,慢性CSC 32眼中有27眼(84%)视网膜神经上皮下无积液且FFA显示该患眼RPE无荧光素渗漏(图1)。另有5眼(16%)仍存在视网膜下液,且这5眼的RPE仍有荧光素渗漏。对FFA显示RPE仍有荧光素渗漏且OCT显示视网膜下仍有积液的5眼再次行SML(治疗能量及治疗区域确定过程同前)。

图1 一名53岁女性慢性CSC患者经SML治疗前后FFA及OCT图像 A1:治疗前FFA显示左眼黄斑中心凹上方RPE荧光渗漏,红色线圈为渗漏点;A2:治疗前OCT显示左眼黄斑区视网膜神经上皮层下积液;B1:经SML治疗后1mo,OCT显示左眼黄斑区视网膜下液较治疗前无明显吸收,上皮层下高反射物质减少;B2:经SML治疗后2mo,OCT显示左眼黄斑区视网膜下液较治疗前明显吸收;B3:患者经SML治疗后3mo,FFA显示左眼黄斑中心凹上方RPE无荧光渗漏,如红色线圈所示;B4:经SML治疗后3mo,OCT显示左眼黄斑区视网膜下液完全吸收,黄斑区结构基本恢复正常。
SML治疗6mo时,慢性CSC 32眼中有29眼(91%)的视网膜神经上皮与RPE保持贴附。有3眼(9%)存在视网膜神经上皮下积液,FFA显示2眼(6%)的RPE仍有荧光素渗漏(图1)。
2.2SML治疗慢性CSC前后BCVA变化在基线期时,慢性CSC 32眼的BCVA为0.46±0.34,治疗后1、2、3、4、5、6mo,患眼BCVA分别为0.43±0.27、0.42±0.22、0.39±0.26、0.25±0.29、0.27±0.35、0.19±0.47,差异有统计学意义(F=3.405,P<0.05)。与基线期相比患眼治疗后4、5、6mo BCVA明显改善,差异均有统计学意义(P<0.05)。治疗后5、6mo BCVA相比治疗后4mo BCVA无明显改善,差异均无统计学意义(P>0.05),见图2。
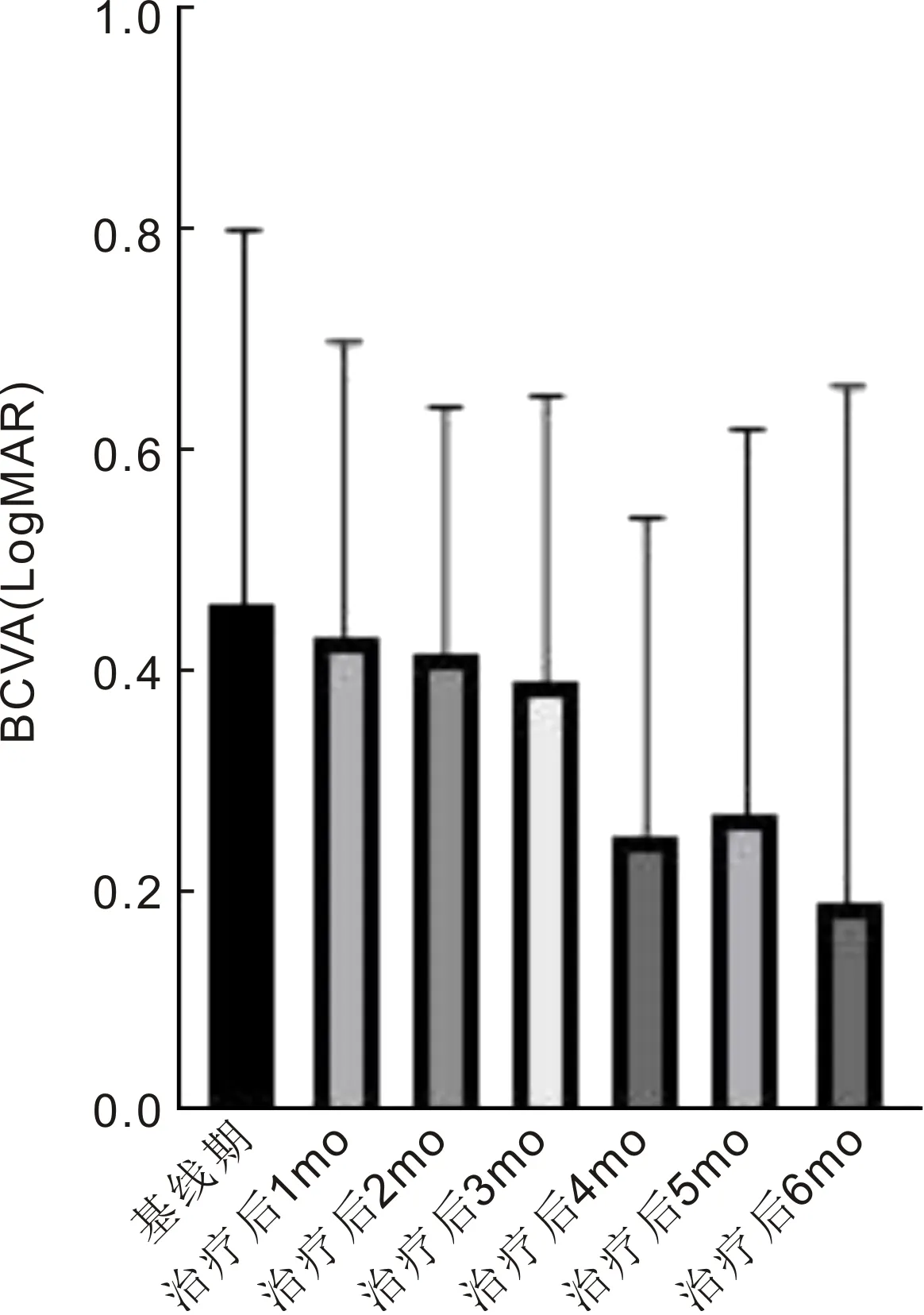
图2 SML治疗慢性CSC前后BCVA(LogMAR)变化。
2.3SML治疗慢性CSC前后CRT变化在基线期时,慢性CSC 32眼的CRT为259.15±57.54μm。治疗后1、2、3、4、5、6mo,患眼CRT为232.13±42.58、231.57±37.65、231.26±49.25、226.92±37.71、223.01±41.54、217.25±35.54μm,差异有统计学意义(F=2.961,P<0.05)。与基线期相比,患眼治疗后1、2、3、4、5、6mo CRT明显降低,差异均有统计学意义(P<0.05)。与治疗后1mo相比,治疗后2、3、4、5、6mo CRT厚度无明显降低,差异均无统计学意义(P>0.05),见图3。

图3 SML治疗慢性CSC前后CRT变化。
3讨论
CSC的具体发病机制尚未明确,目前主流学说认为是脉络膜增厚使脉络膜静水压增高,引起脉络膜血管高渗漏,进一步导致RPE-Bruch膜复合体结构受损,使RPE细胞紧密连接受到破坏,引起局灶性或弥漫性渗漏[2]。部分研究显示,阻塞性睡眠呼吸障碍、内源性皮质类固醇分泌增加或外源性皮质类固醇摄入增多以及A型性格、应激状态等是CSC发病的危险因素[4]。这些因素可导致与脉络膜循环调节相关的自主神经功能紊乱,从而引发脉络膜缺血、RPE功能异常及脉络膜血管通透性增加[3]。脉络膜静水压增高、炎症及缺血均可以引起RPE屏障功能受损及“泵”功能不良,从而引起视网膜神经上皮下积液[10]。
虽然CSC为自限性疾病,但长期存在的视网膜下液仍可导致部分CSC患者视功能严重受损[11]。针对慢性CSC(病程长于3mo),目前已有多种治疗方案可供临床选择且其疗效均已被临床研究所证实。除PDT及激光光凝已应用于CSC的治疗外,抗雄激素药物非那雄胺、盐皮质激素抑制剂螺内酯和依普利酮等也被证实对于慢性CSC有效[12-13]。此外,一些研究也证实了抗VEGF药物如贝伐单抗、雷珠单抗和阿柏西普在治疗急性和慢性CSC中的作用。虽然没有明确证据表明CSC患眼中的VEGF水平增加,但研究者认为抗VEGF药物可降低脉络膜血管通透性,理论上可用于对CSC的治疗[14]。但这些治疗方法目前仍处于临床探索阶段,且均为小样本、短期临床研究,缺乏严格的随机对照和长期随访,其潜在的副作用如男性乳房增生、肝脏损害、高钾血症等也不应被忽视[15-16]。
SML仅作用于病变部位,与传统激光相比,SML为高频、短促的脉冲激光,不伴有视网膜的热损伤,可用于黄斑区疾病的治疗。由于激光能量首先被RPE细胞吸收,在治疗过程,SML将RPE的温度提高至略低于蛋白质变性的阈值。一些研究已经证实了SML治疗CSC的安全性和有效性[8]。Vignesh等[17]对慢性CSC 28眼进行了SML治疗,8mo后,12眼(42.8%)的视网膜下液完全消退。Scholz等[18]针对PDT治疗无效的慢性CSC患者进行SML治疗,有61%的患眼在治疗后视网膜下液消退。其他的研究也证实波长为810nm或577nm的SML均有助于慢性CSC病情改善[19]。但研究者对于激光器的参数如曝光时间、光斑直径和功率及治疗区域的选择等各不相同。由于国人与国外相关研究中纳入的研究对象在RPE色素含量方面存在不同。因此,SML对于国内外CSC患者的治疗效果可能存在差异。目前有关SML治疗CSC的研究主要由欧美研究者主导,而国内少有此类治疗学研究开展。这可能与国内SML仪器数量相对有限、SML治疗参数难于确定等因素有关。
在本研究中,我们使用577nm SML治疗慢性CSC。由于CSC主要发生于黄斑区,此区域光感受器密集,其结构及功能的异常程度与对比敏感度、中心视力、明适应能力等密切相关,且富含叶黄素。因此,对于黄斑区RPE的治疗应首选易于穿透视网膜神经上皮、不易被视网膜神经上皮吸收,且又能有效作用于RPE的激光波长[19]。577nm波长位于黄色波谱范围,黄斑区叶黄素对黄光的吸收率最低,激光能量在视网膜神经上皮中的传导较少,因此,对病变部位相对正常的神经感觉层损伤较少[17]。而较低能量的激光仍可导致RPE局部受热,促使失代偿的RPE细胞破坏,刺激相邻部位正常RPE细胞增生、移行,使得视网膜外层屏障得以修复,即所谓的“激光扩创术”[8]。廖丹等[20]使用577nm SML对慢性CSC 12眼进行了治疗,在治疗后6mo,6眼(50%)视网膜下液完全消失,6眼(50%)仍然有视网膜下液存在。
但在本研究中我们发现,32眼在末次随访(治疗后6mo)时仅有3眼(9%)仍存在视网膜下液,且患眼BCVA(0.19±0.47)及CRT(217.25±35.54μm)均较基线期(BCVA:0.46±0.34,CRT:259.15±57.54μm)有显著改善(P<0.05)。这可能与5眼(16%)在SML治疗3mo后因RPE有荧光素渗漏且视网膜下仍有积液而再次接受SML有关。本研究发现,慢性CSC患者接受577nm SML治疗1mo后,患眼CRT厚度即明显降低并趋于稳定,而患眼视力提高晚于CRT厚度降低,于治疗后4mo明显提高并趋于稳定,我们考虑这可能与黄斑区形态学好转先于视功能恢复有关。本研究中SML治疗6mo时,仍有3眼(9%)存在视网膜下液,FFA显示2眼(6%)的RPE仍有荧光素渗漏,理论上SML能刺激、诱导RPE细胞的完整性及“泵”功能,恢复外屏障功能,最终促进视网膜下液的吸收[9],但CSC的发病机制主要与脉络膜扩张及压力增高有关[2],我们考虑仅通过对症治疗,脉络膜异常循环仍存在,则部分患者治疗效果不佳。对于这类SML治疗反应欠佳的患者,也可予以半剂量光动力治疗或口服醛固酮抑制剂如依普利酮[12],以改善脉络膜血管扩张及渗漏。但与光动力及口服醛固酮抑制剂相比,SML仅作用于局部眼组织,对全身并无影响,且其价格低廉且可以多次治疗,优势突出。对于部分慢性CSC而言,由于患眼视网膜下液持续存在或病情反复发作,可导致永久性RPE和光感受器萎缩,使患眼对比敏感度以及中心视力永久受损,Mrejen等[21]研究发现未经治疗的慢性CSC可导致12.8%的患者低于0.1,本研究显示,SML治疗后4mo,可明显改善视力。基于我们利用SML对慢性CSC 32眼进行的治疗学研究,我们认为577nm SML治疗慢性CSC安全且有效。
然而本研究纳入的患者数量较少,仅有患者24例32眼接受研究,且研究时限也仅为6mo,这可能导致研究结果及结论存在偏倚。因此,有关SML治疗CSC的长期效果仍需在大样本量、多中心性研究的基础上进一步证实。
