预后营养指数对老年重症COPD病人预后的预测价值
2022-09-16杨君红梁兰玉单清
杨君红 梁兰玉 单清
COPD已经成为全球公共卫生的重大挑战,在我国,COPD已成为继高血压、糖尿病之后的第三大慢性病,所造成的总医疗费用是人均收入的1.2倍以上,严重阻碍了公共卫生和社会经济的进步[1-2]。COPD在急性加重期常有全身炎症的进一步激活,导致机体衰弱和器官衰竭,蛋白质分解代谢增加,若老年病人再合并营养不良或不健康饮食方式,可导致机体抵抗力下降,感染加重及病情反复,并由此形成恶性循环[3]。预后营养指数(PNI)是基于白蛋白和淋巴细胞计数之和的一种简单、客观的营养不良筛查指标,与肿瘤病人不良预后、多种手术并发症、急性心肌梗死、慢性肾功能衰竭均有关[4-7]。
目前多使用PNI<45作为营养不良的判断标准,但老年重症COPD病人由于病程长、一般情况差、多病共存等原因,常表现出更差的营养状况。为更加精确地判断老年重症COPD病人营养水平与预后的关系,本研究探讨了PNI对老年重症COPD病人死亡的预测价值。
1 资料与方法
1.1 研究对象 回顾性选取2016年1月至2019年12月因COPD急性加重入住扬州大学附属医院ICU的132例老年重症病人。入选标准:(1)符合慢性阻塞性肺疾病全球倡议指南(GOLD)中COPD及急性加重的诊断;(2)年龄≥60岁;(3)使用有创辅助通气;(4)病历资料齐全。排除标准:(1)合并其他通气功能障碍的呼吸系统疾病病人;(2)24 h内出院者;(3)因其他疾病入院的病人;(4)有恶性肿瘤病史的病人;(5)合并自身免疫性疾病或血液系统疾病等影响免疫功能的病人。
1.2 资料收集 回顾性收集病例资料包括年龄、性别、吸烟史、是否合并肺炎、格拉斯哥昏迷评分(GCS)、APACHEⅡ评分、查尔斯共病指数(CCI)、住院时间及住院费用等。记录入院24 h内首次实验室检查结果,包括WBC、淋巴细胞计数(LYM)、血清白蛋白(ALB)、Hb、CRP、PaO2、PaCO2、氧合指数(PaO2/FIO2)等;并计算PNI值、中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR)。其中,PNI=血清白蛋白(g/L)+5×淋巴细胞计数(×109)。
1.3 分组与回访 采用ROC曲线计算PNI最佳截断值,AUC>7提示PNI对预后诊断价值较高。入院后6个月采用电话回访病人生存状态,根据入院后6个月是否存活分为死亡组和存活组,比较2组间临床特征。
1.4 统计学方法 采用SPSS 26.0软件包分析数据,非正态分布计量资料采用中位数和四分位数[M(Q1,Q3)]表示,组间比较采用Mann-WhitneyU检验;定性资料采用频数和百分比(n,%)表示,组间比较采用卡方检验;建立多因素COX回归模型分析影响预后的因子,其中单因素COX分析中P<0.1的变量进入回归模型;采用 Kaplan-Meier曲线比较病人生存时间。P<0.05为差异有统计学意义。
2 结果
2.1 人口学和临床特征 本研究最终纳入132例病人,其中男94例(71.21%),女38例(28.79%),中位年龄78.00岁,其中吸烟44例(33.33%),101例(76.52%)入院时患有肺炎。回顾性研究随访期间无失访。132例病人中位生存时间为83 d,72例(54.55%)经确认均全因死于呼吸衰竭。死亡组病人中位生存时间为13.5 d。
2.2 PNI与老年COPD重症病人生存结局的ROC曲线 ROC曲线分析显示,PNI预测老年COPD重症病人死亡的AUC为0.703,P<0.001,95%CI为0.614~0.791,最佳截断值为37.32。其中,56例病人PNI<37.32,76例PNI≥37.32。
2.3 死亡组与存活组病人临床特征比较 单因素分析显示,2组病人年龄、pH、PNI<37.32比例、NLR、PLR、Hb、ALB、LYM、PNI差异均有统计学意义(P<0.05)。见表1。
2.4 影响病人预后的COX回归分析 进一步纳入上述单因素COX分析中P<0.1的因子进入多因素COX比例风险模型(ALB、LYM同PNI存在显著共线性不纳入回归方程),结果显示年龄、PNI<37.32、住院总时间是病人死亡的独立影响因素,当PNI<37.32时,老年重症COPD病人死亡风险显著增加(HR=2.281)。见表2。

表2 影响病人预后的多因素COX回归分析
2.5 PNI<37.32与PNI≥37.32病人的Kaplan-Meier生存曲线 低PNI病人平均生存时间为64.36(95%CI:45.449~83.266)d,高PNI病人平均生存时间为119.41(95%CI:101.763~137.053)d,差异有统计学意义(P<0.01)。见图1。与高PNI病人相比,低PNI病人有创通气时间、ICU住院时间、住院总时间、费用及死亡率均较高,差异具有统计学意义(P<0.05或P<0.01)。见表3。
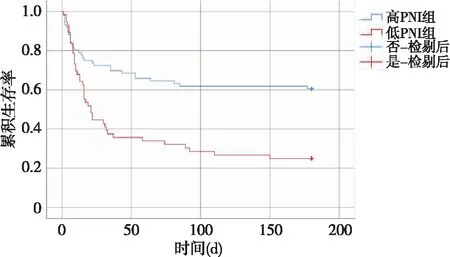
图1 PNI与病人预后的Kaplan-Meier生存曲线

表3 低PNI与高PNI病人住院情况及预后比较[M(Q1,Q3)]
3 讨论
营养不良不仅导致机体的活动能力下降,还常与各种疾病的并发症密切相关,造成失能率和病死率上升[8]。本研究回顾性分析了132例老年重症COPD病人,探讨PNI与生存预后的关系。
本回顾性研究中,34例(25.76%)病人住院期间死亡,38例(28.79%)在出院后6个月内死亡,共计死亡人数72例(54.55%),提示老年COPD病人病情重,短期及长期预后均较差。与存活组相比,死亡组病人年龄更大、营养水平更低,病情更严重,具体表现为更高的炎症水平以及更差的营养指标。GCS评分、APACHE Ⅱ评分和CCI由于受临床医师主观判断影响较大,2组间差异无统计学意义;2组病人辅助通气时间、住院时间及住院费用差异亦无统计学意义。多因素COX回归分析提示,年龄、PNI<37.25、住院总时间是病人死亡的独立影响因素,病人年龄越大、住院时间越长同时伴有PNI<37.32时,预示病人预后不佳,且PNI<37.32的病人死亡风险是PNI≥37.32者的2.281倍。低PNI病人与高PNI病人相比,住院时间、费用及死亡率均较高。
随着我国老龄化程度日渐加深,预计到2050年将有6200万营养不良的老年人[9],早期识别营养不良对于危重症病人非常重要[10]。老年重症COPD病人急性加重期全身炎症反应进一步激活,机体消耗增大,容易出现营养水平下降,并造成医疗负担增加和预后不良[11]。
目前,各级医院重症病人的营养评估较为单一,造成了不同程度的营养不良漏诊和延误治疗。PNI不仅是多种肿瘤预后的有效预测指标,也能评估非肿瘤病人死亡率。在非小细胞肺癌[12]、消化道肿瘤[13]和肥胖的肿瘤[14]病人中,PNI与全因死亡显著相关,低PNI组病人中位生存时间和总体存活率明显降低;同样,在急性心力衰竭[15-16]和COVID-19[17]病人中,PNI与长期预后独立相关,高PNI常预示结局更加良好。
低PNI与病人预后之间的关系与血清ALB和LYM相关。LYM反映自身免疫状态,低白蛋白血症反映病人营养水平。ALB是经典的营养指标之一,在COPD急性炎症状态下常受到抑制,常在临床上作为营养不良的生物标志物[18]。LYM是人体免疫系统的组成部分,其水平与炎症的进展呈负相关,淋巴屏障缺陷增加老年病人感染和死亡风险[19]。高龄、久病、制动、食欲降低等因素使得老年COPD病人更容易发生稳态失调和罹患低蛋白血症,从而出现营养不良。本文中的PNI最佳界值点为37.32,与国内一项关于重症监护病房中PNI预测成人死亡率的界值点相似[20],但相较于既往关于恶性肿瘤、心脏术后的病人来说,该值偏低,原因可能与样本量小、病人病情重、病史长、一般状况差等因素有关。
本研究存在一些不足:首先作为单中心回顾性研究可能存在不可避免的偏倚。其次所纳入的暴露变量有限,可能还有其他变量影响结果。第三,纳入的数据只反映了基线水平,而其动态变化是否影响病人预后尚不清楚。本研究结果还需要经过精心设计、前瞻性、多中心、随机对照研究的验证。
综上,PNI反映病人的营养状态和免疫状态,其对老年重症COPD病人的预后有较高的预测价值,可被推荐作为老年病人入院营养筛查指标,PNI<37.32预示预后不良。
