黄瓜嫁接愈合期阶段性光照强度筛选及作用机制初探
2022-09-16钟路明翟挺楷郝思怡林碧英储玉凡杨玉莹申宝营
钟路明,翟挺楷,郝思怡,林碧英,储玉凡,杨玉莹,申宝营
(1. 福建农林大学 园艺学院,福建 福州 350002;2. 福建农林大学 蔬菜研究所,福建 福州 350002)
黄瓜(Cucumis sativusL.)是世界广泛栽培的蔬菜之一[1],目前土传病害是其栽培的主要障碍。而嫁接能够有效地解决这一问题[2],已被广泛应用。同时,嫁接还在抵御低温[3]和提高产量[4]上有着重要贡献。幼苗的质量直接影响作物的产量和品质[5],想要获得优质的嫁接苗,如何提高嫁接愈合效果是最核心的问题。研究表明,光照作为植物光合作用的能量来源[6],并且调控着植物的激素代谢[7],对嫁接愈合有重要意义[8]。廖自月等[9]研究表明,在嫁接愈合期给与45 μmol/(m2·s)(1~3 d)—90 μmol/(m2·s)(4~6 d)—135 μmol/(m2·s)(7~10 d)的光照模式最有利于黄瓜嫁接愈合。同时,朱晨[10]的研究也得出类似的结论。另外,JANG 等[11]研究表明,较高的光照水平提高了黄瓜嫁接愈合的CO2交换率,有利于黄瓜的嫁接愈合。赵渊渊[12]在茄子上的研究也发现,嫁接愈合期给与适宜的光照有利于砧木和接穗的愈合。但这些研究仅限于设置不同光照模式进行筛选,对嫁接愈合期不同阶段实际需要的光照强度无从得知。另外,由于嫁接愈合本身是一个光照需求不断增强的过程,不同模式的比较无法获取准确的愈合机制。究其原因,在于嫁接愈合期植物表型变化不明显,而其内源生理生化变化复杂,学者难以找寻一个快速有效的检测方法。
快速叶绿素荧光技术作为一项先进的光学成像技术,对植物的检测具有快速、无损、操作简单等优点,并且能够进行高通量检测[13],有着极其广阔的应用前景。张传玉等[14]利用快速叶绿素荧光技术研究机械损伤下香樟树应对胁迫的信号传导和生理变化。潘俊峰等[15]也以快速叶绿素荧光技术为手段筛选机械损伤条件下9种水生植物的抗性情况。由此可见,叶绿素荧光和机械损伤胁迫息息相关。蔬菜嫁接作为一种典型的机械损伤,其胁迫状况能够被叶绿素荧光参数直接表征出来[16‑17]。另外叶绿素荧光还和植物机械损伤后产生的各类内源物质直接关联[18]。因此,可以利用叶绿素荧光和机械损伤之间的紧密关系来表征嫁接愈合的效果:嫁接愈合越好,对机械损伤的胁迫缓解就越好。本研究借助叶绿素荧光探针作为主要表征黄瓜嫁接愈合效果的技术手段,辅助其他愈合指标,力求获得精确的阶段性黄瓜嫁接愈合光照强度参数,为探究光照对黄瓜嫁接愈合影响的相关机制提供参考。
1 材料和方法
1.1 试验材料
选取南瓜种子壮士作为砧木,黄瓜种子冬青作为接穗,种子购于福建省福州市昌育农业有限公司。挑选大小一致的南瓜种子浸种催芽后播种在V(草炭)∶V(蛭石)∶V(珍珠岩)=3∶1∶1 的混合基质中,放到温室进行育苗培养。南瓜播种后第2 天进行黄瓜的浸种催芽,随后播种育苗。待南瓜第1 片真叶长出,黄瓜子叶彻底展平,在傍晚时分采用改良顶插固定嫁接法[19]嫁接。嫁接好的苗及时放入愈合室进行黑暗缓苗,第2 天6:00 开始进行不同光照处理。
1.2 试验方法
1.2.1 试验设计 试验于2021 年3—7 月在福建农林大学园艺学院设施系人工气候室进行。试验分3个阶段依次进行,第一阶段(S1)试验时,将嫁接好的黄瓜苗放入不同愈合室,按表1 相对应的光照强度进行光照处理,处理到第3 天18:00 时取样测定相关指标。在对第一阶段测定结果进行评定后得出第一阶段最优光照强度,然后进行第二阶段(S2)试验,将嫁接好的黄瓜苗放入不同愈合室,按表2相对应的光照强度进行光照处理,处理到第6 天18:00 时取样测定相关指标。在对第二阶段测定结果进行评定后得出第二阶段最优光照强度,然后进行第三阶段(S3)试验,将嫁接好的黄瓜苗放入不同愈合室,按表1相对应的光照强度进行光照处理,处理到第9 天18:00 时取样测定相关指标。然后对第三阶段测定结果进行评定后得出第三阶段最优光照强度。温湿度、光周期和通风管理措施如表2所示。每处理设3次重复。

表1 黄瓜嫁接愈合期不同阶段最优光照强度的筛选Tab.1 Screening of optimal light intensity at different stages of grafting healing period of cucumber μmol/(m2·s)

表2 黄瓜嫁接愈合期其他环境因素管理Tab.2 Management of other environmental factors during grafting healing period of cucumber
1.2.2 测定指标与方法 接合部直径:对不同阶段的试验,分别在第3、6、9天取样。采用PD-151数字型游标卡尺测定。每个处理每次试验随机取样9株。所测数据去除2个最大值和2个最小值。
接穗生长状态:对不同阶段的试验,分别在第3、6、9 天取样。使用数码照相机佳能EOS 600D 拍照记录。
砧穗叶绿素荧光参数:对不同阶段的试验,分别在第3、6、9 天取样。采用IMAGING-PAM 荧光成像仪分别测定砧木和接穗子叶叶绿素荧光参数Y(Ⅱ)(实际光化学量子效率)、Y(NO)(PSⅡ非调节性能量耗散)、qN(PSⅡ反应中心以热形式耗散的能力)、qP(PSⅡ电子传递速率)。每个处理每次试验随机取样5 株。每株分别取砧木和接穗子叶1 片,每片子叶打点6次,所测数据去除离散值进行分析。
1.3 数据处理
试验数据采用IBM SPSS Statistics 22.0 软件进行方差分析,使用Duncan’s 法进行多重比较(P<0.05);采用Excel 2010 软件、Photoshop CS6 软件和Origin 2019软件进行统计分析和图表绘制。
2 结果与分析
2.1 不同光照强度对黄瓜嫁接愈合期接合部直径和接穗形态的影响
由图1A 可知,嫁接愈合期第一阶段(1~3 d),黄瓜嫁接苗接合部直径随着光照强度的增强呈现先上升后下降的趋势,在光照强度为50 μmol/(m2·s)时嫁接苗接合部直径最大且与其他处理差异显著。由图1B 可知,嫁接愈合期第二阶段(4~6 d),黄瓜嫁接苗结合部直径随着光照强度的增强各处理之间无显著差异,表明黄瓜嫁接愈合期4~6 d,改变光照强度并不会影响黄瓜嫁接苗接合部直径的变化。由图1C 可知,嫁接愈合期第三阶段(7~9 d),黄瓜嫁接苗接合部直径随着光照强度的增强呈现先上升后下降的趋势,在光照强度为150 μmol/(m2·s)时嫁接苗接合部直径最大且与其他处理差异显著。
由图1D 可知,嫁接愈合期第一阶段(1~3 d),黄瓜嫁接苗接穗在光照强度为0~50 μmol/(m2·s)时,接穗均处于硬挺健康状态。而随着光照强度的进一步增强,当光照强度达到75 μmol/(m2·s)时开始出现萎蔫,而100 μmol/(m2·s)的光照强度下萎蔫程度出现不可逆。当嫁接愈合期进入第二阶段(4~6 d)(图1E),黄瓜嫁接苗接穗在光照强度为50~100 μmol/(m2·s)时,接穗均处于硬挺健康状态。而随着光照强度的进一步增强,在125 μmol/(m2·s)的光照强度下开始出现萎蔫,150 μmol/(m2·s)的光照强度下萎蔫程度出现不可逆。当嫁接愈合期进入第三阶段(7~9 d)(图1F),嫁接苗接穗随着光照强度的增强,真叶生长面积先增大后减小,其中,在光照强度为150 μmol/(m2·s)时真叶生长面积最大。
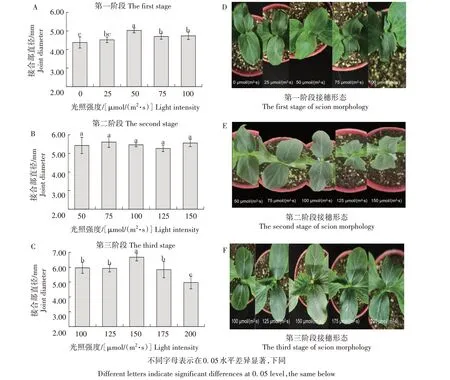
图1 不同光照强度对黄瓜嫁接愈合期接合部直径和接穗形态的影响Fig.1 Effects of different light intensity on the diameter of grafting joint and the morphology of scion at the grafting healing stage of cucumber
综上所述,黄瓜嫁接愈合期,第一阶段(1~3 d)光照强度设置为50 μmol/(m2·s)、第三阶段(7~9 d)光照强度设置为150 μmol/(m2·s)时最有利于黄瓜嫁接愈合期表型的发育。而第二阶段(4~6 d)最适的光照强度还有待进一步确定。
2.2 不同光照强度对黄瓜嫁接愈合期砧木和接穗叶绿素荧光参数的影响
2.2.1 第一阶段(1~3 d) 由图2 可知,嫁接愈合期第一阶段(1~3 d),黄瓜嫁接苗接穗Y(Ⅱ)和Y(NO)随着光照强度的增强分别呈现先上升后下降和先下降后上升的趋势,在光照强度为75 μmol/(m2·s)时分别取得最大值和最小值。除与光照强度为50 μmol/(m2·s)的处理无显著差异外,与其他处理差异均达显著水平。黄瓜嫁接苗接穗qN 在光照强度为0 μmol/(m2·s)时取得最小值,但其数据的分布情况极度离散。而光照强度为25、50、75 μmol/(m2·s)时,3种处理qN 无显著差异,其中数据集中性以50 μmol/(m2·s)最佳,且平均值最小。黄瓜嫁接苗接穗qP随着光照强度的增强,呈现先上升后下降的趋势,在光照强度为50 μmol/(m2·s)时取得最大值且数据集中性较好。由图3 可知,嫁接愈合期第一阶段(1~3 d),黄瓜嫁接苗砧木Y(Ⅱ)和Y(NO)随着光照强度的增强,分别呈现先上升后下降和先下降后上升的趋势,在光照强度为50 μmol/(m2·s)时取得最大值和最小值。黄瓜嫁接苗砧木qN 和qP 分别在0、50 μmol/(m2·s)光照强度时取得最小值和最大值。

图2 不同光照强度对黄瓜嫁接愈合期第一阶段(1~3 d)接穗叶绿素荧光的影响Fig.2 Effects of different light intensity on chlorophyll fluorescence of scions at the first stage(1—3 d)of grafting healing of cucumber
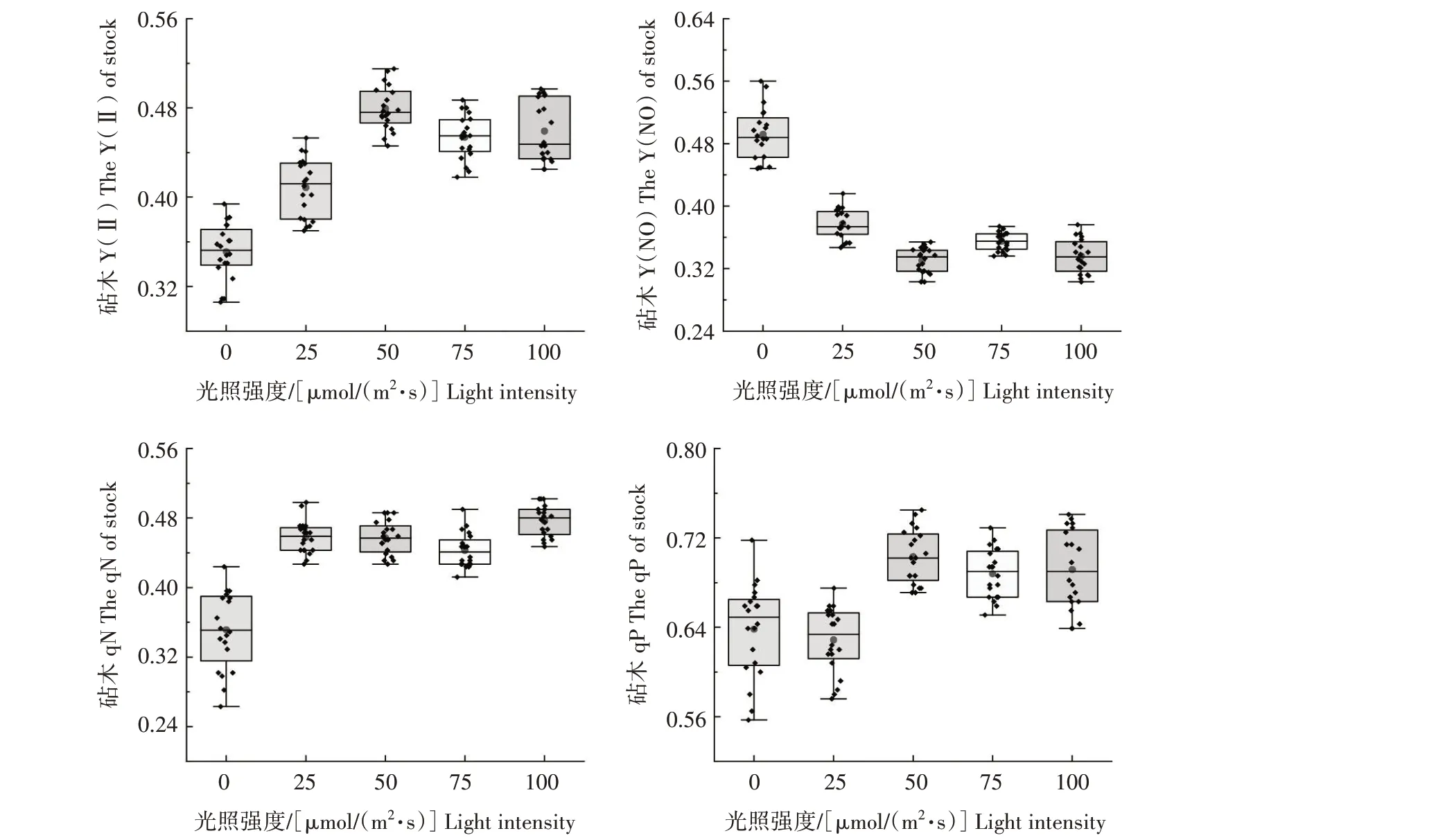
图3 不同光照强度对黄瓜嫁接愈合期第一阶段(1~3 d)砧木叶绿素荧光的影响Fig.3 Effects of different light intensity on chlorophyll fluorescence of rootstocks at the first stage(1—3 d)of grafting healing of cucumber
2.2.2 第二阶段(4~6 d) 由图4 可知,嫁接愈合期第二阶段(4~6 d),黄瓜嫁接苗接穗Y(Ⅱ)和Y(NO)随着光照强度的增强分别呈现先上升后下降再上升和先下降后上升再下降的趋势,且分别在光照强度为100 μmol/(m2·s)时取得最大值和最小值。100 μmol/(m2·s)光照强度处理下的Y(Ⅱ)除与光照强度70 μmol/(m2·s)处理无显著差异外,与其他处理差异均达显著水平,而Y(NO)则与其他处理均呈差异显著。黄瓜嫁接苗接穗qN 在光照强度为75 μmol/(m2·s)时取得最小值,但与光照强度50、100 μmol/(m2·s)2 个处理无显著差异。其中数据集中性以100 μmol/(m2·s)处理更佳,且与光照强度125 μmol/(m2·s)和150 μmol/(m2·s)处理差异显著。黄瓜嫁接苗接穗qP随着光照强度的增强,呈现先上升后下降再上升的趋势,其中在光照强度为100 μmol/(m2·s)时 取 得 最 大 值,且 数 据 集 中 性较好。

图4 不同光照强度对黄瓜嫁接愈合期第二阶段(4~6 d)接穗叶绿素荧光的影响Fig.4 Effects of different light intensity on chlorophyll fluorescence of scions at the second stage(4—6 d)of grafting healing of cucumber
由图5 可知,嫁接愈合期第二阶段(4~6 d),黄瓜嫁接苗砧木Y(Ⅱ)随着光照强度的增强变化不明显。黄瓜嫁接苗砧木Y(NO)在不同光照强度处理下,结果差异性也极其微小。黄瓜嫁接苗砧木qN则表现为50、125 μmol/(m2·s)的光照强度下更小,而qP 除50 μmol/(m2·s)的光照强度外,其他处理间无显著差异。

图5 不同光照强度对黄瓜嫁接愈合期第二阶段(4~6 d)砧木叶绿素荧光的影响Fig.5 Effects of different light intensity on chlorophyll fluorescence of rootstocks at the second stage(4—6 d)of grafting healing of cucumber
2.2.3 第三阶段(7~9 d) 由图6 可知,嫁接愈合期第三阶段(7~9 d),黄瓜嫁接苗接穗Y(Ⅱ)和Y(NO)随着光照强度的增强均呈现先上升后下降的趋势,且均在光照强度为150 μmol/(m2·s)时取得最大值。150 μmol/(m2·s)光照强度处理下的Y(Ⅱ)除与光照强度为200 μmol/(m2·s)的处理无显著差异外,与其他处理差异均达显著水平,而Y(NO)则与其他处理差异均显著。黄瓜嫁接苗接穗qN 在光照强度为150 μmol/(m2·s)时取得最小值,且与其他处理差异显著,数据集中性也较好。黄瓜嫁接苗接穗qP随着光照强度的增强,呈现先上升后下降再上升的趋势,且在光照强度为150 μmol/(m2·s)时取得最大值,数据集中性也好。


图6 不同光照强度对黄瓜嫁接愈合期第三阶段(7~9 d)接穗叶绿素荧光的影响Fig.6 Effects of different light intensity on chlorophyll fluorescence of scions at the third stage(7—9 d)of grafting healing of cucumber
由图7 可知,嫁接愈合期第三阶段(7~9 d),黄瓜嫁接苗砧木Y(Ⅱ)随着光照强度增强呈现先上升后下降的趋势,在光照强度为150 μmol/(m2·s)时取得最大值且与其他处理差异显著。黄瓜嫁接苗砧木Y(NO)随着光照强度的增强也呈现先上升后下降趋势,在光照强度为175 μmol/(m2·s)时取得最大值,且与其他处理差异显著。黄瓜嫁接苗砧木qN则表现为150 μmol/(m2·s)的光照强度下最大,但数据集中性极差,而其他处理差异不显著。qP的表现状态则为随着光照强度的增强呈现先上升后下降的趋势,且在光照强度为150 μmol/(m2·s)时取得最大值,与其他处理差异显著。
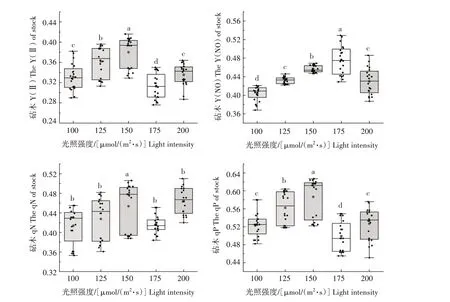
图7 不同光照强度对黄瓜嫁接愈合期第三阶段(7~9 d)砧木叶绿素荧光的影响Fig.7 Effects of different light intensity on chlorophyll fluorescence of rootstocks at the third stage(7—9 d)of grafting healing of cucumber
2.3 不同光照强度对黄瓜嫁接愈合期3个阶段愈合效果影响的综合评价
运用隶属函数法[20]对各项指标进行标准化处理,随后运用雷达分析法进行综合评价,雷达图面积越大即表明该光照强度对黄瓜嫁接苗各项指标的综合影响越大,即黄瓜嫁接苗的愈合效果越好。由图8可知,第一阶段(1~3 d)、第二阶段(4~6 d)、第三阶段(7~9 d)分别在50、100、150 μmol/(m2·s)的光照强度下综合表现最优。因此,黄瓜嫁接愈合期给与50 μmol/(m2·s)(1~3 d)—100 μmol/(m2·s)(4~6 d)—150 μmol/(m2·s)(7~9 d)的光照强度最有利于黄瓜嫁接愈合。

图8 不同光照强度对黄瓜嫁接愈合期3个阶段愈合效果影响的综合评价Fig.8 Comprehensive evaluation of the effects of different light intensity on the healing effect at three stages of grafting healing period of cucumber
3 结论与讨论
3.1 不同光照强度对黄瓜嫁接愈合期3个阶段表型的影响
植物表型是植物基因、转录、蛋白质和代谢等综合作用的结果[21],对嫁接植物表型的研究能够直观有效地探查黄瓜嫁接愈合的效果。接合部直径和接穗形态均能表现黄瓜嫁接愈合部位的愈合状态,直径越大,接穗形态越好,表明愈合状态越好。本研究表明,第一阶段(1~3 d)和第三阶段(7~9 d)随着光照强度的增强,黄瓜接合部直径均先增大后减小,即嫁接愈合部位的细胞分裂数量随着光照的增强先上升后下降。其可能的原因是光照促进了接合部激素的生成,加速了细胞分裂活动[22],但过强的光照会导致愈伤组织褐化和细胞严重坏死[23]。然而第二阶段(4~6 d),接合部直径随着光照强度的增加,变化不显著,即愈合部位的细胞分裂数量差异不明显。可能是黄瓜嫁接愈合4~6 d,接合部细胞处于维管束形成期,主要进行分化活动[10]。
3.2 不同光照强度对黄瓜嫁接愈合期3个阶段砧木和接穗叶绿素荧光的影响
叶绿素荧光参数常用于评价环境胁迫对植物的影响和光合机构的功能[24],是研究逆境对植物光合作用影响的重要指标[25]。其中Y(Ⅱ)反映PSⅡ实际的光化学量子效率,高Y(Ⅱ)代表着高光合效率[26]。而qP 表示PSⅡ天线色素吸收的光能用于光化学电子传递的份额,qP 较大,一定程度上反映了植物PSⅡ反应中心的开放程度较高[27]。Y(NO)表示PSⅡ非调节性的能量耗散,Y(NO)较小,说明植物光化学能量转换和自我保护调节机制都比较强[27]。qN 则表示植物PSⅡ反应中心将光能转化为热能的能力[28]。
本研究发现,第一阶段(1~3 d)、第二阶段(4~6 d)、第三阶段(7~9 d)分别给与50、100、150 μmol/(m2·s)的光照强度,黄瓜嫁接苗砧木和接穗子叶的叶绿素荧光参数最优。由此表明,黄瓜嫁接愈合期给与50 μmol/(m2·s)(1~3 d)—100 μmol/(m2·s)(4~6 d)—150 μmol/(m2·s)(7~9 d)的光照强度最有利于缓解黄瓜嫁接苗的机械损伤胁迫,即最有利于黄瓜嫁接愈合。这与廖自月等[9]和朱晨[10]对黄瓜的研究结果类似,但更加精确。由此证明,将叶绿素荧光作为评价嫁接愈合期愈合效果的核心参数是可行的。
分析各阶段黄瓜嫁接苗砧木和接穗子叶叶绿素荧光参数随光照强度的变化趋势还能够进一步探讨相关的愈合机制。本研究发现,嫁接愈合期3个阶段砧木和接穗子叶Y(Ⅱ)和qP 大体上随着光照强度的增强先上升后下降,分别在50、100、150 μmol/(m2·s)的光照强度下取得最大值,且与其他处理差异显著。表明嫁接愈合期各阶段适宜增强光照强度有利于提高黄瓜嫁接愈合期的光合效率和电子传递速率,从而缓解嫁接损伤胁迫,同时驱动生成更多的ATP[29]促进嫁接愈合。值得注意的是,嫁接愈合期第二阶段(4~6 d)砧木子叶的Y(Ⅱ)和qP 随光照强度增强并无显著差异。并且第一阶段砧木子叶的Y(Ⅱ)和qP 均值分别在0.36~0.48 和0.64~0.68,第二阶段的光合水平则有着明显的下降趋势,Y(Ⅱ)和qP 均值分别维持在0.37~0.39 和0.56~0.60。推测其原因可能是,此时黄瓜嫁接愈合正处于愈伤组织已大量形成并开始分化成维管束阶段[30],黄瓜嫁接苗的活动中心集中在砧穗接合部,砧木和接穗子叶的光合作用将主动减弱,以此维持嫁接愈合的高效率。
本研究还发现,嫁接愈合期第一阶段(1~3 d)和第二阶段(4~6 d),Y(NO)随着光照强度的增强呈现先下降后上升的趋势,并且分别在50、100 μmol/(m2·s)的光照强度下取得最小值。由此表明,嫁接愈合期适当增强光照强度有利于提高黄瓜嫁接愈合期面对胁迫的自我保护调节能力,从而缓解嫁接胁迫促进嫁接愈合。有趣的是,第三阶段(7~9 d),随光照强度增强,砧木和接穗子叶的Y(NO)均呈现先上升后下降的趋势,其原因有待进一步探索。
总而言之,可以确定嫁接愈合期适当提高光照强度有利于黄瓜嫁接愈合,并且在1~3 d、4~6 d、7~9 d 分别给与50、100、150 μmol/(m2·s)的光照强度最有利于黄瓜嫁接愈合。另外,嫁接愈合期适当增强光照强度能够增加接合部愈伤组织数量,提高砧木和接穗子叶光合效率和电子传递速率,同时提升嫁接苗对嫁接胁迫的自我调节能力,有效促进黄瓜嫁接愈合。
